- 2021-06-19 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2013中考化学复习身边的化学物质水和溶液
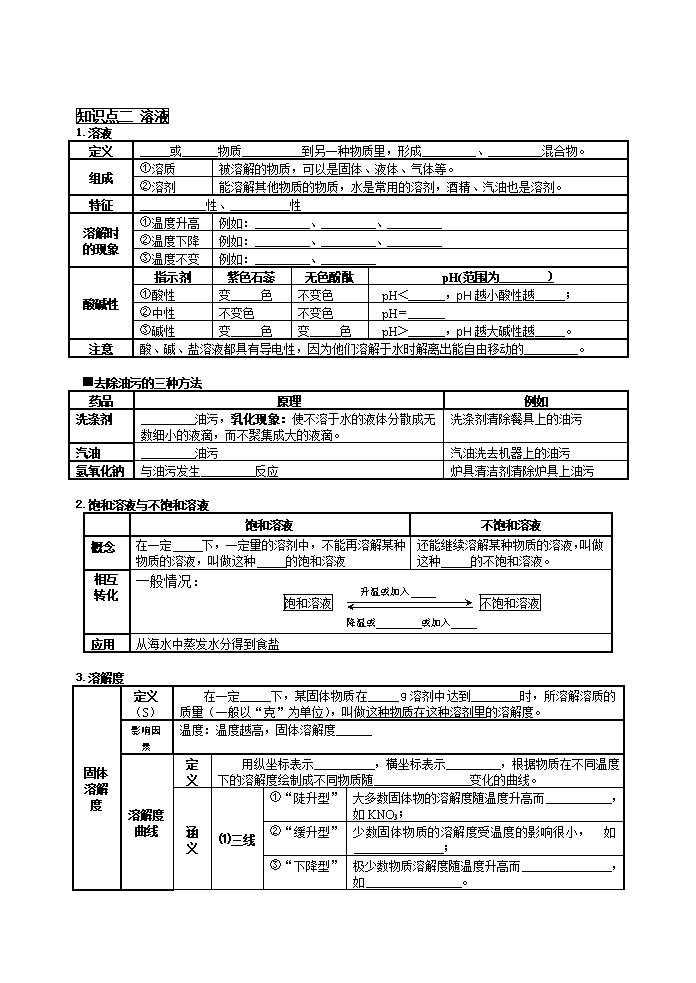
东田庄学校2013中考化学复习身边的化学物质:水和溶液 中考说明 1.水: ①认识水的组成。 ②知道纯水与矿泉水、硬水与软水等的区别。 ③了解吸附、沉淀、过滤和蒸馏等净化水的常用方法。 ④理解水对生命活动的重要意义,认识水是宝贵的自然资源,形成保护水资源和节约用 水的意识。 2.溶液: ①认识溶解现象。②知道水是最重要的溶剂,酒精、汽油也是常见的溶剂。 ③了解饱和溶液和溶解度的含义。④能配制一定溶质质量分数的溶液。 ⑤了解结晶现象。⑥能说出一些常见的乳化现象。 ⑦了解溶液在生产、生活中的重要作用。⑧能进行溶质质量分数的简单计算。 解读考纲 围绕考纲我们应掌握如下要点: 1.水: ①正确描述水的组成、性质及用途。知道水组成的测定方法。 ②能区分纯水与矿泉水、硬水与软水,掌握鉴别硬水与软水的方法。 ③学会吸附、沉淀、过滤和蒸馏等净化水的常用方法。 ④理解水对生命活动的重要意义,了解保护水资源和节约用水的常见措施。 2.溶液: ①能正确描述溶液的组成,理解溶液和溶质、溶剂的概念,明确它们的关系。 ②通过实验认识水溶液的一些性质。 ③了解饱和溶液和溶解度的含义。 ④认识溶液由溶质和溶剂组成,水是常用的溶剂。 ⑤正确领会饱和溶液、不饱和溶液的概念,知道它们在一定的条件下是可以相互转化的。 ⑥记住溶解性和溶解度的概念,明确它们的关系。认识固体物质溶解度曲线,正确描述温度对固体溶解度的影响规律,并会简单的应用。 ⑦结晶方法及其在生产生活中的应用。 ⑧学会溶质质量分数的计算及一定溶质质量分数的溶液的配制。 考情回顾 (河北省) 考点 年份 考查方式 水 ①对水的综合认识 2012年4题(2分)单选 考查对水的认识 ②电解水 2011年30题(4分) 2012年14题(2分)单选 考查水电解实验 ③水的净化 2011年29题(3分)填空 以水的组成、净化、软硬水综合认识水 溶液 ①溶液 2011年29题(2分)填空 考查溶液形成、乳化作用 2012年14题(2分) 选填 以图示形式考查溶解热量变化 ②饱和溶液& 不饱和溶液 2012年6题(2分)单选 考查饱和与不饱和的转化、结晶 ③溶解度、溶解度曲线 2011年6题(2分)选择 以溶解度曲线考查溶解度及应用 2012年7题(2分)选择 ④溶质的质量分数 2011年36题(5分) 利用守恒关系解方程式计算表格沉淀 2012年36题(5分)计算 利用守恒关系解方程式计算图示气体 创设具体情景,以“节约用水,防止水污染”为主题的信息题、开放题是中考的热点之一;围绕水的组成和性质、水的电解实验、水的净化设计考题是有关水的知识又是一个热点。 命题预测 溶液这部分内容常以填空与说明题形式考查有关溶解度的图表分析,以计算题考查溶质质量分数的计算,溶解度曲线、溶质质量分数的计算是近年来必考内容。 【教材放大镜】 知识点一 水(H2O) 1.水的组成、性质与用途 组成 水是由 和 两种元素组成的 ,也是一种氧化物。 构成 每个水分子是由 和 构成。 性 质 物性 色、 气味、 味道的液休,凝固点 ℃,沸点 ℃,4℃时密度最 ,为1g/cm3,冰的密度比水 。 化性 化学反应 化学方程式 现象 ①水通电分解 ②水与二氧化碳反应 ③水与氧化钙反应 用途 水是生命产生、存在、发育和繁殖的基本前提,没有水就没有生命。水是农业的命脉,是工业的基础。 2.水与硬水、软水、矿泉水等的区别 不同的水 水 矿泉水 硬水 软水 海水 成分 水 含有可溶性矿物质 较多可溶性Ca2+、Mg2+ 较少Ca2+、Mg2+ 还含有较多可溶性盐等物质 本质区别 纯净物 混合物 3.水的净化 由低到高 原理 作用 沉淀 ①静置沉淀(如用大水缸盛水);②吸附沉淀(用明矾做吸附剂) 除去不溶性杂质 过滤 把液体与不溶于液体的固体分离,过滤器的使用:“一贴二低三靠” 除去不溶性杂质 吸附 利用活性炭的吸附天然水中一些可溶性杂质和臭味物质 除去可溶性杂质和不溶性杂质 蒸馏 根据液体中各物质的沸点不同,通过加热使水中的钙、镁化合物等分解生成沉淀 ①除去可溶性杂质和不溶性杂质; ②硬水软化。 4.爱护水资源 水的存在 地球表面约 被水覆盖。海洋是地球最大的储水库,其储水量占全球总储水量的96.5%,且其中含有的化学元素有 多种,淡水只约占全球储水量的2.53%,但可利用的淡水不到 。 水资源危机 ①生活、生产的用水量不断增加; ②工业生产中的“三废”( 、 、 )的任意排放; ③农业中化肥、农药的不合理施用; ④生活污水的任意排放。 爱护 水资源 节约 ①工业用水循环使用;②农业采用滴灌、喷灌;③生活上做到一水多用。 防治 措施 ①清除污染源:工业“三废”处理达标后再排放; 农业上农药、化肥合理使用; 生活污水集中处理达标后再排放。 ②加强对水质的监测,及时化解水质危机; 知识点二 溶液 1.溶液 定义 或 物质 到另一种物质里,形成 、 混合物。 组成 ①溶质 被溶解的物质,可以是固体、液体、气体等。 ②溶剂 能溶解其他物质的物质,水是常用的溶剂,酒精、汽油也是溶剂。 特征 性、 性 溶解时 的现象 ①温度升高 例如: 、 、 ②温度下降 例如: 、 、 ③温度不变 例如: 、 酸碱性 指示剂 紫色石蕊 无色酚酞 pH(范围为 ) ①酸性 变 色 不变色 pH< ,pH越小酸性越 ; ②中性 不变色 不变色 pH= ③碱性 变 色 变 色 pH> ,pH越大碱性越 。 注意 酸、碱、盐溶液都具有导电性,因为他们溶解于水时解离出能自由移动的 。 ■去除油污的三种方法 药品 原理 例如 洗涤剂 油污,乳化现象:使不溶于水的液体分散成无数细小的液滴,而不聚集成大的液滴。 洗涤剂清除餐具上的油污 汽油 油污 汽油洗去机器上的油污 氢氧化钠 与油污发生 反应 炉具清洁剂清除炉具上油污 2.饱和溶液与不饱和溶液 饱和溶液 不饱和溶液 概念 在一定 下,一定量的溶剂中,不能再溶解某种物质的溶液,叫做这种 的饱和溶液 还能继续溶解某种物质的溶液,叫做这种 的不饱和溶液。 饱和溶液 不饱和溶液 降温或 或加入 升温或加入 相互 转化 一般情况: 应用 从海水中蒸发水分得到食盐 3.溶解度 固体 溶解度 定义 (S) 在一定 下,某固体物质在 g溶剂中达到 时,所溶解溶质的质量(一般以“克”为单位),叫做这种物质在这种溶剂里的溶解度。 影响因素 温度:温度越高,固体溶解度 溶解度曲线 定义 用纵坐标表示 ,横坐标表示 ,根据物质在不同温度下的溶解度绘制成不同物质随 变化的曲线。 涵义 ⑴三线 ①“陡升型” 大多数固体物的溶解度随温度升高而 ,如KNO3; ②“缓升型” 少数固体物质的溶解度受温度的影响很小, 如 ; ③“下降型” 极少数物质溶解度随温度升高而 ,如 。 ⑵四点 ①曲线上的点 所示某温度下某物质的溶解度(该温度下 状态)。 ②两曲线交点 两物质在该点所示温度下的溶解度数值 。 ③线上方的点 在该温度下,该溶液是 且有部分 ; ④线下方的点 该温度下,该溶液是 。 应用 参见下方练习题 气体 溶解度 定义 在压强为101 kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。 影响 因素 ①温度:温度越高,气体溶解度 ,如烧开水时的现象:“响水不开,开水不响”; ②压强:压强越大,气体溶解度 ,如打开雪碧易拉罐后,气体喷涌而出。 溶解性 定义 指一种物质在另一种物质中的溶解能力,是物质的一种物理性质。 影响因素 溶质种类、溶剂种类、温度等。 与溶解度关系 物质的溶解性 易溶 可溶 难溶(不溶) 20℃时溶解度 >10g 0.01g-1g 【例题】认真分析溶解度曲线图,回答下列问题。 ①Q点的含义: 。 ②P点的含义: 。 ③t1℃时甲、乙、丙的溶解度由大到小的顺序为 。 ④t3℃时,甲物质的饱和溶液中,溶质质量、溶剂质量与溶液质量之比为 。 ⑤t3℃时,将甲物质的不饱和溶液转变成饱和溶液可采取的方法有 或 。 ⑥t3℃时甲、乙、丙的饱和溶液各W克,降温到t1℃时,析出晶体最多 是 物质,无晶体析出是 物质。 ⑦从甲溶液中获取甲晶体(即提纯甲晶体)可用 的方法获取晶体。 ⑧从乙溶液中获取乙晶体(即提纯乙晶体)可用 的方法获取晶体。 ⑨除去甲中的泥沙用 法;分离甲与乙(含量少)的混合物,用 法。 ⑩在t2℃时,30g 甲物质加入到50g水中不断搅拌,能形成80g溶液吗? (填“能”或“不能”)为什么? 。 4.结晶 5.配制一定溶质质量分数的溶液 类型 步骤 仪器 用固体配制 计算、称量、溶解 天平、药匙;量筒、滴管;烧杯、玻璃棒 用浓溶液稀释 计算、量取、稀释 量筒、滴管;烧杯、玻璃棒 6.有关溶液中溶质的质量分数的计算 ⑴有关公式(注意单位统一): ①溶液的质量=溶质的质量+溶剂的质量=溶液的体积×溶液的密度 ②溶质的质量分数= 的质量÷ 的质量×100% ③饱和溶液中溶质的质量分数: 饱和溶液中溶质的质量分数= ————————×100% ⑵计算类型 ①溶液加水稀释的计算: 稀释前后溶质的质量相等:m(浓)×a%(浓)=[m(浓)+m(水)] ×a%(稀) ②溶质质量分数不同的同溶质溶液混合问题: m(浓)×a%(浓)+m(稀)×a%(稀)=m(混)×a%(混) ③求化学反应后所得溶液中溶质质量分数的问题: 通过化学反应计算出溶质质量,再分析各量间关系求出溶液总质量,运用公式计算出反应后溶液中溶质的质量分数. 求反应后所得溶液质量的一般方法:质量守恒法,即:m液==m总---m↓---m↑ ■溶解度&溶质质量分数的比较 溶解度 溶质质量分数 定义 在一定 下,某固体物质在 g溶剂中达到 时,所溶解溶质的质量。 溶质质量与 质量之比。 表示意义 ①物质溶解性大小的定量表示。 ②表示某温度时的饱和溶液中溶质的质量与溶剂的质量关系。 ①是溶液浓稀的定量表示。 ②表示某溶液中溶质的质量与溶液的质量关系。 温度要求 与温度 关 与温度 关 溶剂的量 在 g溶剂中 溶剂的量不一定是100g 溶液类型 一定是 溶液 饱和溶液与不饱和溶液均可 单位 克(g) 比值无单位。常用百分数(%)表示 计算公式 溶解度(S)=——————×100g 溶质的质量分数=————×100% ■重点疑点讨论 1、凡是澄清透明的、均一稳定的液体就是溶液吗?举例说明。 2、只要升高温度就一定能使饱和溶液变为不饱和溶液吗? 3、一定温度下饱和NaCl溶液中还能溶解KNO3吗?请说明理由。 4、溶液长期放置溶质能否从溶液中分离出来? 5、怎样理解“溶质的质量是指溶解在溶液中的物质的质量,而不是加入 到溶剂中的物质的质量”这句话?举例说明。 6、为什么说一定温度下,某物质饱和溶液的溶质的质量分数最大? 7、“饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液”此说法合理吗? 8、不饱和溶液变为饱和溶液后溶质的质量分数一定增大吗?饱和溶液中 析出晶体后,剩余溶液的溶质的质量分数一定减小吗?请分别举例说明。 9、溶液混合时,溶液的质量可以相加,其体积能否直接相加?为什么? ■知识系统再现 1.水是常用溶剂,物质溶于水能使水溶液的沸点升高,凝固点下降,导电性增强。 2.饱和和不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,且可以相互转化:一般情况 ①降温②加溶质③蒸发溶剂 不饱和溶液 饱和溶液 ①加溶剂②升温 3.溶解性是一种物质在另一种物质中的溶解能力,它与溶质、溶剂的性质有关,与外界的条件有关(如温度),气体物质还与压强有关。 4.固体物质溶解度随温度变化可用溶解度曲线表示,利用该曲线可查找某温度下某物质的溶解度,可利用根据曲线判断某物质溶解度受温度影响情况,也可以比较同温度下不同物质的溶解度的大小等。 5.溶解度和溶质质量分数的关系: 溶解度 溶质的质量分数 区别 受温度影响 不受温度影响 指一定温度下,100g溶剂中最多溶解溶质的质量 指溶液中所含溶质的质量分数 单位g 无单位 联系 饱和溶液中溶质质量分数=×100% 6.溶液的酸碱性的表示方法:pH值,测定酸碱性用指示剂,测定酸碱度用pH测纸。 7.乳化是液体小液滴悬浮在水中形成的乳浊液,这一原理可以帮助我们理解清除油污的原理。 8.有关计算: 计算类型 依据 内容 计算式 1.基本计算 溶质的质量分数的概念 m水、m质、m液及ω互换 ω=(m质/m液)×100% =[ m质/(m质+m水) ]×100% 2.与溶液密度有关的溶质的质量分数的计算 溶液密度与溶质的质量分数概念 ρ、m质、m液及ω计算 ω=m质/(ρ·V液)×100% 3.稀释计算 稀释前后溶质的质量相等 溶液加水稀释计算 m1×ω=[m1+m水]×ω2 ⑴.溶质的质量分数表示溶质在溶液里的相对含量。当溶液的质量一定时,溶质的质量越大,溶质的质量分数也越大;当溶质的质量一定时,溶液的质量越大,溶质的质量分数就越小。 ●计算时的注意点: ①溶质的质量分数是质量比而不是体积比,若是体积,必须先用物理公式ρ=m/v进行换算,然后计算; ②在运算过程中,质量的单位要统一; ③因为通常溶液均为水溶液,所以溶质应为无水的物质;能与水反应的物质,其溶质应是反应后的生成物,而不是原来加入的物质,因此计算时应先算出反应后的生成物的质量。 ④若溶质虽不与水发生反应,但没全部溶解,则溶质的质量只能计算已经溶解的部分,未溶解的部分不能参加计算。 ⑤若溶质为结晶水合物,溶于水后,其溶质的质量就不包括结晶水的质量。 ⑥关于酸、碱、盐溶液间发生的化学反应,求反应后溶液中溶质质量分数的计算,要明确生成的溶液中溶质是什么,再求出其质量是多少,最后运用公式计算出反应后溶液中溶质的质量分数。 ●解题思路:审题 → 写出配平的化学方程式 → 找出关系量 → 列出比例式 → 求解。 ⑵.溶液的稀释与浓缩的计算 ①溶液中溶质质量分数增大的方法有两种:一是加溶质,另一种是蒸发溶剂(即浓缩)。 ②溶液稀释的方法是加溶剂。 一、选择题(每题2分,共40分。) 1、下列关于水的性质的叙述中,属于化学性质的是( ) A.降温到0℃,水结成冰 B.加热到100℃,水变成水蒸气 C.水蒸气遇冷,凝结成水 D.给水通电,生成氧气和氢气 2、从一杯食盐水的上部取出一些溶液,测定它的密度是ag/mL,再从下部取出一些溶液,测定它的密度,其数值应该是( ) A.大于 a B、小于a C、等于a D、无法判断 3、小兰通过化学方程式知道,通电分解水时生成氢气和氧气的体积应该为2:1,但实验所得数据氢气和氧气的体积比略大于2:1。针对这一发现你认为下列做法中不可取的是( ) A. 反复多次实验查找原因 B. 实验所得数据与理论值相差不多,可以诊断实验已经成功 C. 大胆提出假设:氧气比氢气易溶于水 D. 查找实验装置是否漏气 4、已知20℃时食盐的溶解度为36g。20℃时把20g食盐放入50g水中,充分搅拌后,所得饱和溶液的质量是( ) 版权:侯红吉 A.70g B.69g C.68g D.67g 5、海洋是人类未来开发利用资源的主要场所。下列操作不能用来淡化海水的是( ) A.过滤 B.蒸馏 C.使海水结冰脱盐 D.多级闪急蒸馏 6、地球上的总储水量虽然很大,但淡水很少,爱护水资源是每个公民的责任和义务。下列行为属于节约用水的是( ) A.公共场所不用随手关水龙头 B.洗完菜的水用来浇花 C.不间断放水刷牙 D.用大容量马桶可以冲洗得更干净 7、今年春季,我国西南地区发生了百年一遇的特大旱灾,国家投入大量人力物力来保障灾区人民的基本生活用水。下列关于水的认识正确的是( ) A.水是良好的溶剂,许多物质都能溶于水 B.通过电解水试验,可知水是有氢气和氧气组成的 C.为了节约用水,提倡用工业废水直接灌溉农田 D.用沉淀法、过滤法和蒸馏法净化水,效果最好的是过滤法 8、灾区人民解决用水困难的一个应急办法,是将浑浊的河水直接静置(或投入沉淀剂静置)后过滤。若在化学实验室进行过滤操作,下列仪器不需要的是( ) 9、用氯化钠配制l00g溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。正确的操作顺序是( ) A.①②③④ B.⑤②④① C.①③⑤②④① D.①③⑥⑤②④① 10、据报道,我市人均水资源量仅为全国人均水资源量的14%,属于严重缺水的城市。并且地处淮河水系下游和入海口,污染水多。因此,节约用水和污水处理就显得尤为重要。下列是保护市区主要供水河流——蔷薇河水质的建议,其中不合理的是( ) A.严禁将含磷废水排入河中 B.坚决杜绝岸边农田使用农药和化肥 版权:侯红吉 C.严禁在河边随意堆放生活垃圾 D.严禁在河北丢弃含汞、铅等金属的废旧电池 11、将70℃的硝酸钠饱和溶液降温到10℃,有晶体析出(晶体中不含水),下列各量没有发生变化的是( ) A.硝酸钠的溶解度 B.溶液中溶质的质量 C.溶液中溶剂的质量 D.溶液中溶质的质量分数 12、今年世界各国频发地震。为防止震后疾病传染须对饮用水源进行处理,采取的措施有: ①煮沸 ②消毒 ③过滤 ④自然沉降,合理处理的顺序是( ) A.③①②④ B.②④③① C.④③①② D.④③②① 13、下列说法中不正确的是( ) A、碘酒中的溶剂是酒精,溶质是碘 B、浓溶液加水稀释过程中,溶质的质量保持不变 C、析出晶体的溶液是该溶质的饱和溶液 D、葡萄糖、植物油、蛋清都可溶于水形成溶液 14、在一定温度下,向盛有氯化钠饱和溶液的烧杯中加入氯化钠晶体后,则( ) A.晶体质量减少 B.晶体质量不变 C.溶质质量分数增大 D.氯化钠溶解度增大 15、在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是( ) A.将20g硝酸钾饱和溶液蒸发掉10g水 B.将20g硝酸钾不饱和溶液蒸发掉10g水 C.在10g10﹪的硝酸钾溶液中,加入5g40﹪的硝酸钾溶液 D.将10g硝酸钾不饱和溶液中加入10g硝酸钾固体 16、稀释质量分数为98%(密度为1.84g/ mL)的浓硫酸配制500 mL质量分数为20%的稀硫酸(密度为1.14g/ mL),稀释时需用的水的体积约为( ) A.436.8 mL B.453.7mL C.456.0 mL D.458.3mL 17、右图是a、b两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是( ) A.b的溶解度大于a的溶解度 B.t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等 C.将t2℃时的b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液 D.t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数 18、下图为氯化铵和硫酸钠的溶解度曲线。下列说法中不正确的是( ) A.30℃时,氯化铵、硫酸钠的溶解度相同 B.氯化铵的溶解度随温度的升高而增大 C.将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析出 D.将60℃时硫酸钠的饱和溶液降温至40℃,溶质的质量分数不变 19、室温下,称取氯化钠和碳酸钠各30g放入同一烧杯中,加入l00g水充分搅拌后静置,得到二者的混合溶液。请参照氯化钠、碳酸钠两物质的溶解度表判断,以下结论不正确的是( ) A.20℃时,氯化钠的溶解度大于碳酸钠的溶解度 B.20℃时,未溶解固体是氯化钠和碳酸钠的混合物 C.30℃时,溶液中氯化钠和碳酸钠的质量分数相同 D.30℃时,溶液为氯化钠和碳酸钠的不饱和溶液 20、甲、乙两种固体的溶解度曲线如右图。将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里。升高温度后,下列有关说法正确的是( ) A.①②两溶液的质量一定相等 B.①②两溶液均变为不饱和溶液 C.①溶液质量增加,②溶液质量减少 版权:侯红吉 D.①溶液中溶质的质量分数一定大于②溶液 二、简答题(每空2分,共40分。) 21.2010年4月14日07时49分,青海玉树发生了7.1级地震,震后当地生态环境和生活条件受到极大破坏,水源受到一定程度污染。灾区人们日常生活用水必需经过一系列的精华处理才能使用。 ⑴向水样中加入明矾,经溶解、静置、 (填操作名称),除去不溶性杂质,然后加入活性炭,利用其 性除去异味,再杀菌消毒,得到生活用水。 ⑵“中水”是指生活污水经处理后,达到规定的水质标准,可在一定范围内再次使用的非饮用水,利用“中水”的实际意义是 。 22.化学中有许多概念是相对的,又是统一的。下图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系。 ⑴从右图可以看出,饱和溶液与浓溶液、稀溶液的关系是 。 ⑵0.9%的医用生理盐水可归于上图中 区域(选填“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”)。 ⑶生产上要配制5000g10%的盐酸来清洗钢材,需38%的盐酸(密度为1.19g/cm3 )__________mL(计算结果保留小数点后一位)。 23.运用溶解度表与溶解度曲线回答下列问题: ⑴B是 的溶解度曲线。 ⑵60℃时,100g水中加入100g硝酸钾,所得溶液是 (填“饱和”或“不饱和”)溶液,当60℃的该溶液降温到30℃时,析出晶体的质量为 g。 24.请根据如图中A、B两种固体物质的溶解度曲线,回答下列问题。 ⑴t2℃时,100g水中溶解 gA物质恰好达到饱和,该饱和溶液中溶质的质量分数为 ,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 g。 ⑵将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是 。 ⑶要把B的a溶液转化为b的溶液,你可用 。 25.小明同学绘制了如右图所示A、B两种固体物质的溶液度曲线: ⑴若将B物质从溶液中结晶析出,宜采用的方法是 。 ⑵我国有许多盐碱湖,湖中溶有大量的氯化钠和硝酸钾,那里的人们“冬天捞碱,夏天晒盐。”据此你认为图中 (填“A”或“B”)物质的溶解度曲线与纯碱的相似。 26.下表列出了固体物质A在不同温度时的溶解度: 温度/℃ 0 10 20 30 40 50 60 70 80 90 溶解废/g 36 35 34 33 32 31 30 29 28 27 (1)70℃时,向盛有100g水的烧杯中加入30g固体A,充分溶解形成的是 (填“饱和”或“不饱和”)溶液,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为 (填最简整数比); (2)通过对上表数据的分析,物质A的溶解度曲线应是右图中的 (填“甲”或“乙”); (3)80℃时,配制一定量甲物质的溶液,将其降温到60℃,是否有固体析出? (填“有”、“没有”或“不确定”)。 三、实验探究题(每空1分,共10分。) 版权:侯红吉 27.下图是小明配制100g质量分数为18.5%的蔗糖溶液的实验操作示意图: ① ② ③ ④ ⑤[ ⑴配制上述溶液,小明要称取蔗糖 g。 ⑵上图①、②、④中相同的仪器名称是 。 ⑶用上图所示的序号表示正确配制该溶液的操作顺序为 。 ⑷若上图③中砝码的质量为15 g,游码的读数为3.5 g,则小明称得的蔗糖质量实际为 g。若所量取的水的质量没有错误,实际配制的溶质质量分数为 。 ⑸用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。 A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母 28.人类的生活和工农业生产都离不开水。下图是自来水厂净水过程示意图。 请根据图示回答下列问题: ⑴自来水厂生产自来水时,使用的净水方法有______________; A.沉淀 B.过滤 C.煮沸 D.蒸馏 E.吸附 ⑵过滤是一种净水的方法,利用过滤的方法,可将不溶于水的固体杂质与水分离开来。如右图是过滤操作示意图,请指出两点错误: ① ; ② ; ⑶若过滤后仍然浑浊,则原因可能有: 。 29. 根据如图所示的信息计算: ⑴加入的稀硫酸质量为 g. ⑵所用稀硫酸溶质的质量分数.(化学方程式:2KOH+H2SO4═K2SO4+2H2O) 30. 过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小。小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数。他们取出该溶液51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如 图37-21所示。 (1)完全反应后生成氧气的质量为________。 (2)计算该溶液中溶质的质量分数。 查看更多