- 2021-06-21 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学大二轮优选习题 专题三 元素及其化合物 专题突破练10 常见金属及其重要化合物
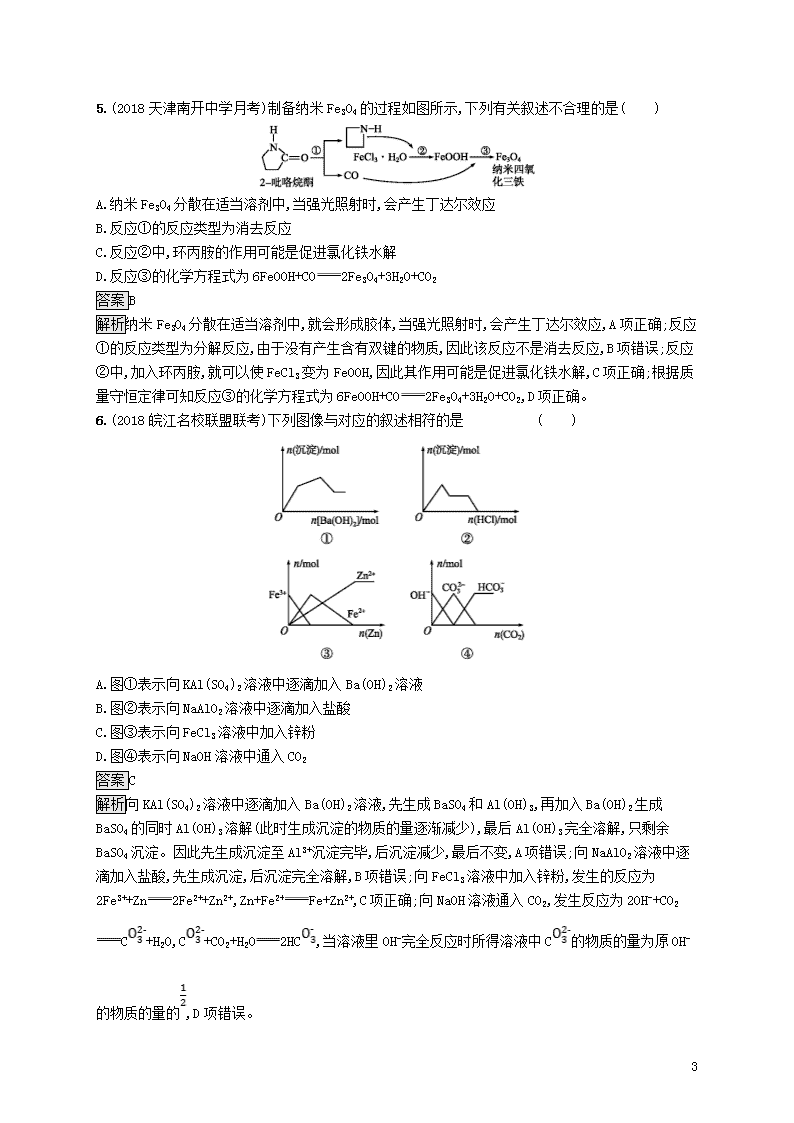
专题突破练10 常见金属及其重要化合物 一、选择题(本题包括10个小题,每小题6分,共60分) 1.(2018辽宁大连高三双基考试)在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况。下列反应中不存在此类情况的是( ) A.氢气与过量的碘蒸气反应(500 ℃) B.铝片与过量浓硝酸反应(常温) C.铜粉与过量浓硝酸反应(常温) D.浓硫酸与过量铜片反应(共热) 答案C 解析氢气与碘的反应是可逆反应,两种物质都不能完全反应,A项不符合;常温下,铝片在浓硝酸中能钝化,B项不符合;铜粉在过量的浓硝酸中能完全反应,C项符合;铜片只能与浓硫酸在加热时反应,故两者都不能完全反应,D项不符合。 2.(2018河北衡水中学高三质检)甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下,下列说法不正确的是( ) 甲乙丙 A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙 B.若乙为NaHCO3,则丙一定是CO2 C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 答案B 解析若A为硝酸,则甲为铁,乙为硝酸亚铁,丙为硝酸铁,则甲与丙反应可生成乙,A项正确;若乙为NaHCO3,A为氢氧化钠,则甲为二氧化碳,丙可以为碳酸钠,所以丙不一定是CO2 9 ,B项错误;若A为NaOH溶液,X为短周期的金属元素,则甲为氯化铝,乙为氢氧化铝,丙为偏铝酸钠,C项正确;若A为金属单质,乙的水溶液遇KSCN溶液变红,则A为铁,甲可以为氯气,乙为氯化铁,丙为氯化亚铁,D项正确。 3.下列关于钠及其化合物的说法中正确的是( ) A.将2.3 g Na投入到97.7 g水中充分反应,所得溶液的质量分数为4.0% B.相同质量的铝分别与足量的盐酸和NaOH溶液反应,生成气体物质的量之比为1∶3 C.将CO2和H2O的混合气体a mol,与足量的Na2O2固体充分反应,生成的O2在标准状况下的体积为11.2a L D.120 mL 0.20 mol·L-1碳酸钠的溶液与200 mL盐酸进行滴加反应,将前者滴入后者和将后者滴入前者,滴加完全后,产生的气体在相同条件下体积不等,则盐酸的浓度可能为2 mol·L-1 答案C 解析钠与水反应的化学方程式为2Na+2H2O2NaOH+H2↑,溶质的物质的量为n(NaOH)=n(Na)==0.1 mol,溶液的质量因生成氢气而小于100 g,所以溶质的质量分数大于4.0%,故A项错误;Al与盐酸、NaOH溶液反应的离子方程式分别为2Al+6H+2Al3++3H2↑,2Al+2OH-+2H2O2Al+3H2↑,由于盐酸和氢氧化钠过量,因此等量的铝产生氢气的物质的量相等,故B项错误;根据化学方程式2CO2+2Na2O22Na2CO3+O2和2H2O+2Na2O24NaOH+O2↑,无论是CO2还是H2O,消耗2 mol气体,都产生1 mol O2,因此a mol混合气体参与反应产生氧气的体积为11.2a L,故C项正确;碳酸钠滴入盐酸中:Na2CO3+2HCl2NaCl+H2O+CO2↑,盐酸滴入碳酸钠中:HCl+Na2CO3NaHCO3+NaCl,NaHCO3+HClNaCl+CO2↑+H2O,假设无论前者滴入后者还是后者滴入前者,生成CO2气体体积相等,则盐酸中HCl的物质的量为2×120×10-3×0.2 mol=0.048 mol,此时盐酸浓度c(HCl)==0.24 mol·L-1,因此产生气体体积不相等时,盐酸浓度应小于0.24 mol·L-1,故D项错误。 4.(2018湖南长沙明德中学月考)下列关于元素及其化合物的说法正确的是( ) A.光导纤维的主要成分为硅单质 B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同 C.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法 答案C 解析光导纤维的主要成分是二氧化硅,A项错误;Al和NaOH溶液发生氧化还原反应时铝作还原剂,Cl2和NaOH溶液发生氧化还原反应时,氯气既作氧化剂又作还原剂,B项错误;Na易与空气中氧气反应生成Na2O,Na2O与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3·xH2O,Na2CO3·xH2O风化脱水又生成Na2CO3,C项正确;从溶液中制备FeCl3、CuCl2固体,为防止金属阳离子水解,应采用将溶液在氯化氢气流中蒸干的方法,D项错误。 9 5.(2018天津南开中学月考)制备纳米Fe3O4的过程如图所示,下列有关叙述不合理的是( ) A.纳米Fe3O4分散在适当溶剂中,当强光照射时,会产生丁达尔效应 B.反应①的反应类型为消去反应 C.反应②中,环丙胺的作用可能是促进氯化铁水解 D.反应③的化学方程式为6FeOOH+CO2Fe3O4+3H2O+CO2 答案B 解析纳米Fe3O4分散在适当溶剂中,就会形成胶体,当强光照射时,会产生丁达尔效应,A项正确;反应①的反应类型为分解反应,由于没有产生含有双键的物质,因此该反应不是消去反应,B项错误;反应②中,加入环丙胺,就可以使FeCl3变为FeOOH,因此其作用可能是促进氯化铁水解,C项正确;根据质量守恒定律可知反应③的化学方程式为6FeOOH+CO2Fe3O4+3H2O+CO2,D项正确。 6.(2018皖江名校联盟联考)下列图像与对应的叙述相符的是 ( ) A.图①表示向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 B.图②表示向NaAlO2溶液中逐滴加入盐酸 C.图③表示向FeCl3溶液中加入锌粉 D.图④表示向NaOH溶液中通入CO2 答案C 解析向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,先生成BaSO4和Al(OH)3,再加入Ba(OH)2生成BaSO4的同时Al(OH)3溶解(此时生成沉淀的物质的量逐渐减少),最后Al(OH)3完全溶解,只剩余BaSO4沉淀。因此先生成沉淀至Al3+沉淀完毕,后沉淀减少,最后不变,A项错误;向NaAlO2溶液中逐滴加入盐酸,先生成沉淀,后沉淀完全溶解,B项错误;向FeCl3溶液中加入锌粉,发生的反应为2Fe3++Zn2Fe2++Zn2+,Zn+Fe2+Fe+Zn2+,C项正确;向NaOH溶液通入CO2,发生反应为2OH-+CO2C+H2O,C+CO2+H2O2HC,当溶液里OH-完全反应时所得溶液中C的物质的量为原OH-的物质的量的,D项错误。 9 7.工业上用含有少量氧化铁杂质的废铜粉为原料,制取硫酸铜的主要过程如下图所示: 下列有关说法不正确的是( ) A.“过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3 B.通入的气体A可以是O2或Cl2 C.通入气体A之前的混合溶液中存在的阳离子是Fe2+、Cu2+、H+ D.将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜 答案B 解析制取硫酸铜,“过量酸”应为稀硫酸,不适合用硝酸,因为会引入硝酸铜杂质;也不适合用浓硫酸,因为会产生二氧化硫气体而污染空气,加入固体B的作用是调节溶液的pH,使Fe3+变为沉淀而除去,为了不引入新的杂质,可选用CuO、Cu(OH)2或Cu2(OH)2CO3,A项正确;向混合溶液中通入气体A的作用是将溶液中的亚铁离子氧化为铁离子,气体A应为氧气,不能使用氯气,因为会生成氯化铜杂质,B项错误;废铜粉与稀硫酸反应:Fe2O3+6H+2Fe3++3H2O,2Fe3++Cu2Fe2++Cu2+,由于稀硫酸过量,因此通入气体A之前混合溶液中存在的阳离子为Fe2+、Cu2+、H+,C项正确;将从溶液中得到的硫酸铜晶体在空气中加热,晶体将失去结晶水,得到无水硫酸铜,D项正确。 8.(2018清华大学附属中学月考)某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉的混合物,转化关系如下图所示。下列说法不正确的是( ) 铁铝 混合物 A.x为NaOH溶液,y为盐酸 B.a→b发生的反应为Al+H++H2OAl(OH)3↓ C.按照本流程,x和y调换后也能达到实验目的 D.b、c都既能与强酸又能与强碱反应 答案C 解析根据转化关系,加入试剂x得到溶液和Fe,利用的是Al能与NaOH溶液反应,Fe不与NaOH溶液反应,因此试剂x为NaOH溶液,即a的主要成分是NaAlO2,根据转化关系,试剂y应为盐酸,发生反应Al+H++H2OAl(OH)3↓,然后氢氧化铝受热分解成Al2O3,最后通过电解的方法得到金属Al。根据上述分析,x为NaOH溶液,y为盐酸,故A项正确;a→b的反应是Al+H++H2OAl(OH)3↓,故B项正确;如果x和y互换,a为FeCl2和AlCl3,加入NaOH溶液,则得到Fe(OH)2和Al(OH)3沉淀,按照流程无法得到金属铝,故C项错误;b和c分别是Al(OH)3和Al2O3,都属于两性化合物,既能与强酸反应,又能与强碱反应,故D项正确。 9 9.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程: 下列说法不正确的是( ) A.溶液1中的阳离子可与N、HC、I-、S在同一溶液中大量共存 B.向溶液2中加入3~5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 C.向固体2中加入足量NaOH溶液,发生反应的离子方程式为Al(OH)3+OH-Al+2H2O D.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 答案A 解析根据烧渣的成分,Fe2O3属于碱性氧化物,加入足量的酸后,与酸反应生成Fe3+,Al2O3属于两性氧化物,与酸反应后生成Al3+,SiO2属于酸性氧化物,不与酸反应,即溶液1中含有阳离子H+、Fe3+和Al3+,这三种离子不能与HC大量共存,Fe3+和I-能发生氧化还原反应,因此不能大量共存,A项错误。根据流程,溶液2中含有Fe2+,因此加入K3[Fe(CN)6]可产生蓝色沉淀,B项正确。固体2应是Al(OH)3,氢氧化铝表现两性,能与强碱反应:Al(OH)3+OH-Al+2H2O,故C项正确;Fe2+具有还原性,容易被氧气氧化,同时FeSO4·7H2O容易失去结晶水,因此制备FeSO4·7H2O时,应注意防止其氧化和分解,D项正确。 10.(2018河南豫南豫北名校高三精英联赛)向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙 。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸,此时反应生成CO2的体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( ) A.原NaOH溶液的物质的量浓度为0.5 mol·L-1 B.当0查看更多