- 2021-06-21 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学真题分类汇编物质的推断1含解析
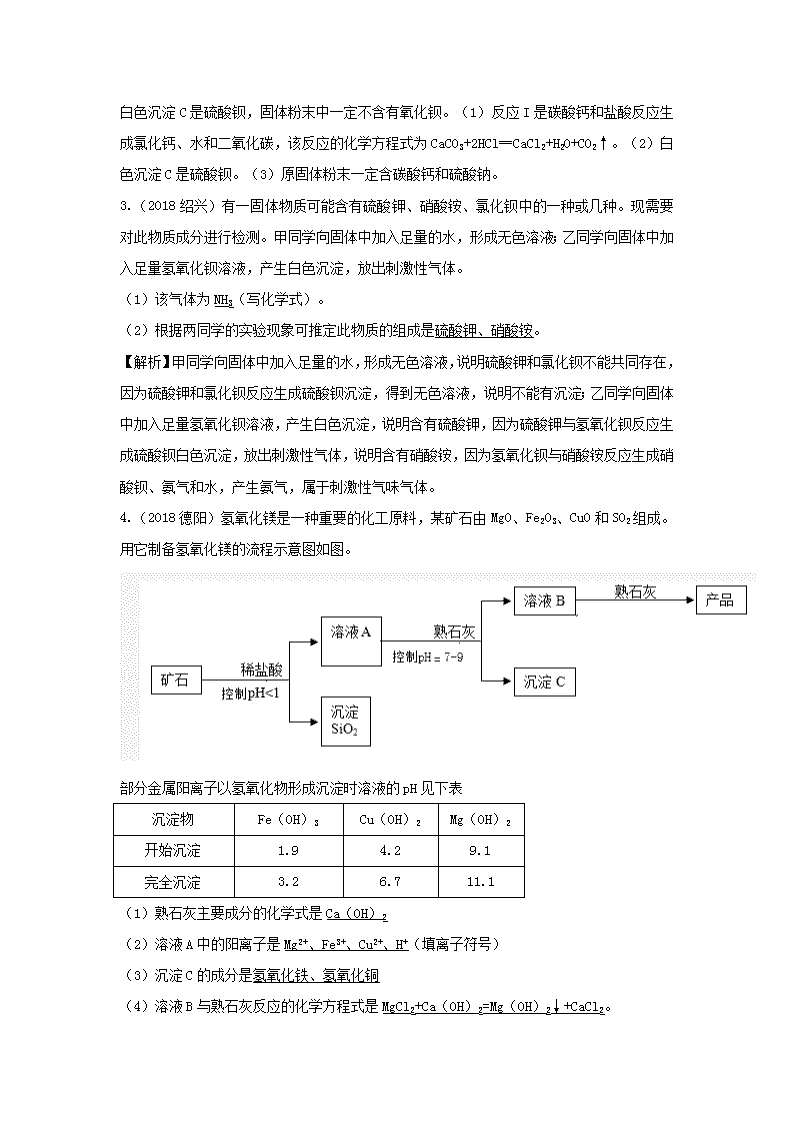
专题分类:物质的推断 1.(2018天津)某固体粉末可能含有碳酸钙、氧化铜、氧化铁、木炭粉中的几种,取mg该固体粉末按下列流程进行实验(本流程涉及到的反应均为初中化学常见的反应,且各步均恰好完全反应)。下列说法中正确的是(BC) A.溶液N中只含一种溶质 B.原固体粉末中可能含有碳酸钙 C.白色沉淀Y一定是碳酸钙,气体W一定是氢气 D.原固体粉末中一定没有氧化铜,一定含有碳酸钙 【解析】根据题目给出的流程图和信息:某固体粉末高温的条件下生成气体X,X能使澄清的石灰水变浑浊,二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,说明X是二氧化碳,Y是碳酸钙;固体Z5.6g加入100g7.3%的盐酸恰好完全反应,生成气体W,固体Z全部溶解得到浅绿色溶液N,因此Z是铁,W是氢气,浅绿色溶液N中有氯化亚铁溶液;因此原固体粉末中一定有氧化铁和木炭粉,一定没有氧化铜,碳酸钙可能有可能没有。 2.(2018巴中)某固体粉末可能含有碳酸钙,硫酸钠,氧化钡,硫酸铜中的一种或几种。为确定该固体粉末的成分,进行如下实验: 回答下列问题: (1)反应I的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑。 (2)白色沉淀C是BaSO4(填化学式)。 (3)原固体粉末一定含CaCO3、Na2SO4(填化学式)。 【解析】固体粉末加足量的水得到无色滤液和白色沉淀,由于硫酸铜溶液是蓝色的,故一定不会含有硫酸铜,产生的别说沉淀A甲足量的稀盐酸会全部溶解产生气体,故白色沉淀A是碳酸钙,无色滤液B加入硝酸钡溶液产生白色沉淀C,故无色滤液B中含有硫酸钠,产生 的白色沉淀C是硫酸钡,固体粉末中一定不含有氧化钡。(1)反应I是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,该反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑。(2)白色沉淀C是硫酸钡。(3)原固体粉末一定含碳酸钙和硫酸钠。 3.(2018绍兴)有一固体物质可能含有硫酸钾、硝酸铵、氯化钡中的一种或几种。现需要对此物质成分进行检测。甲同学向固体中加入足量的水,形成无色溶液;乙同学向固体中加入足量氢氧化钡溶液,产生白色沉淀,放出刺激性气体。 (1)该气体为NH3(写化学式)。 (2)根据两同学的实验现象可推定此物质的组成是硫酸钾、硝酸铵。 【解析】甲同学向固体中加入足量的水,形成无色溶液,说明硫酸钾和氯化钡不能共同存在,因为硫酸钾和氯化钡反应生成硫酸钡沉淀,得到无色溶液,说明不能有沉淀;乙同学向固体中加入足量氢氧化钡溶液,产生白色沉淀,说明含有硫酸钾,因为硫酸钾与氢氧化钡反应生成硫酸钡白色沉淀,放出刺激性气体,说明含有硝酸铵,因为氢氧化钡与硝酸铵反应生成硝酸钡、氨气和水,产生氨气,属于刺激性气味气体。 4.(2018德阳)氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SO2组成。 用它制备氢氧化镁的流程示意图如图。 部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表 沉淀物 Fe(OH)3 Cu(OH)2 Mg(OH)2 开始沉淀 1.9 4.2 9.1 完全沉淀 3.2 6.7 11.1 (1)熟石灰主要成分的化学式是Ca(OH)2 (2)溶液A中的阳离子是Mg2+、Fe3+、Cu2+、H+(填离子符号) (3)沉淀C的成分是氢氧化铁、氢氧化铜 (4)溶液B与熟石灰反应的化学方程式是MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。 【解析】(1)熟石灰的主要成分是氢氧化钙,化学式是Ca(OH)2。(2)加入盐酸发生了以下反应:MgO+2HCl═MgCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O、CuO+2HCl═CuCl2+H2O,溶液A的pH<1,说明反应后溶液呈强酸性,盐酸过量,因此溶液A中的阳离子有Mg2+、Fe3+、Cu2+、H+。(3)控制pH值在7﹣9之间,氢氧化镁不能沉淀,生成了氢氧化铁沉淀和氢氧化铜沉淀。(4)溶液B与熟石灰反应的反应物是氯化镁和氢氧化钙,生成物是氢氧化镁沉淀和氯化钙,所以方程式是:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。 5.(2018泸州)已知:SiO2不与稀盐酸反应。牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏对牙齿的摩擦和去污,牙膏摩擦剂一般由CaHPO4、CaCO3、Al(OH)3、SiO2中的一种或几种组成。牙膏中只有摩擦剂不溶于水。请回答下列问题: (1)上述几种物质中属于盐的是CaCO3和CaHPO4(填化学式);Al(OH)3的名称是氢氧化铝。 (2)已知某品牌牙膏中的摩擦剂是CaCO3、Al(OH)3和SiO2中的一种或两种,将适量的牙膏溶于水,静置后过滤,向滤渣中加人足量稀盐酸,没有观察到气泡,且有不溶物,则该牙膏中一定不含CaCO3,一定含SiO2。 (3)用如图所示装置(夹持仪器略去)测定另一品牌牙膏中碳酸钙的含量。请回答下列问题: ①装置B中仪器X的名称是烧杯。 ②装置A中滴加盐酸反应完全后,打开活塞K缓缓通入N2,其作用是将A中残留的CO2气体全部排到B中。 ③准确称取5.0g牙膏样品进行实验,测得B中沉淀质量为1.2g。则样品中碳酸钙的质量分数为24%。 【解析】(1)几种物质中属于盐的是CaCO3和CaHPO4,Al(OH)3的名称是氢氧化铝。 (2)将适量的牙膏溶于水,静置后过滤,向滤渣中加人足量稀盐酸,没有观察到气泡,则该牙膏中一定不含碳酸钙,且有不溶物,则一定含SiO2。 (3)①装置B中仪器X的名称是烧杯。②装置A中滴加盐酸反应完全后,打开活塞K缓缓通入N2,其作用是将A中残留的CO2气体全部排到B中,使实验结果更准确。 ③设牙膏中碳酸钙质量为x, 由CaCO3+2HCl═CaCl2+H2O+CO2↑,Ca(OH)2+CO2═CaCO3↓+H2O可知,CaCO3~CO2~CaCO3↓, CaCO3~CO2~CaCO3↓, 100100 x1.2g =,x=1.2g, 则样品中碳酸钙的质量分数为:×100%=24%。 6.(2018长沙)我市教育主管部门为了让同学们过好传统佳节一一端午节,特意将中考提前一天。化学兴趣小组的同学们为庆祝端午佳节,决定自己动手制作传统食品一一皮蛋。制作皮蛋料泥的原料主要有:生石灰、纯碱、草木灰(含K2CO3)等。将他们按一定比例混合加入适量水得到皮蛋料泥。料泥的主要成分是什么呢?同学们进行了如图所示的探究: (1)步骤②的操作所需的玻璃仪器有:烧杯、玻璃棒、漏斗; (2)步骤③的现象说明滤渣中一定含有的物质为:碳酸钙; (3)由上述实验现象推断,滤液中的溶质一定含有:氢氧化钙、氢氧化钠、氢氧化钾。 【解析】(1)步骤②的操作是过滤,所需的玻璃仪器有:烧杯、玻璃棒、漏斗。(2)步骤③中,产生气泡,是因为稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,说明滤渣中一定含有的物质是碳酸钙。(3)由上述实验现象推断可知,加入二氧化碳时产生白色沉淀,说明溶液中含有氢氧化钙,溶液中含有氢氧化钙时,则溶液中一定不含有碳酸钠和碳酸钾,因此滤液中的溶质一定含有氢氧化钙、氢氧化钠和氢氧化钾。 7.(2018安徽)废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。 已知:Sn+SnCl2=2SnCl4 (1)SnCl4中锡元素的化合价是_____________________。 (2)铜的金属活动性比锡的________(填“强”或“弱”),固体A中一定含有的金属元素是_______。 (3)写出步骤②发生反应的化学方程式________________________________________。 (4)相比于直接焚烧废旧旧电路板回收金属,该工艺主要优点是__________________(回答一点即可)。 【答案】(1)+4(1分)(2)弱(1分) Cu(1分)(3)2SnCl2Sn+SnCl4分解反应(2分)(4)避免焚烧塑料产生污染,更加环保(1分)(其他合理答案均给分) 【解析】(1)氯元素显-1价,根据正负化合价等于0,计算出SnCl4中锡元素的化合价是+4价;(2)根据金属活动性顺序表判断铜的金属活动性比锡的弱,Cu不与SnCl2反应,固体A中一定含有的金属铜;(3)根据流程图判断2SnCl2Sn+SnCl4分解反应;(4)避免焚烧塑料产生污染,更加环保或节能环保。 8.(2018河北)A→L是初中化学常见物质,它们之间的转化关系如图13所示。(反应条件已略去)。其 中G是大理石的主要成分,A和I为红色固体,B、D和L为气体。 请回答下列问题: (1)G的化学式为_____________。 (2)E的组成元素在化合物中常呈现的化合价有______。 (3)反应③的化学方程式为_____________。 (4)上述转化中,B和L表现出相应的化学性质是_______。 【答案】(1)CaCO3;(2)+2,+3;(3)Fe+CuSO4=FeSO4+Cu(CuCl2,Cu(NO3)2也可以); (4) 还原性。 【解析】(1)大理石的主要成分碳酸钙,G的化学式是CaCO3;(2)根据“A和I为红色固体,B、D和L为气体”和图示反应关系判断A为Fe2O3,B为CO,C为Ca(OH)2,D为CO2,E为Fe,F为CuSO4(CuCl2,Cu(NO3)2也可以),H为H2O,I为Cu,J为FeSO4(FeCl2,Fe(NO3)2也可以),K为CuO,L为H2,Fe的组成元素在化合物中常呈现的化合价有+2,+3;(3)铁比铜活泼,可以把铜从它的盐溶液置换出来,即Fe+CuSO4=FeSO4+Cu(CuCl2,Cu(NO3)2也可以);(4)CO和H2具有还原性,可以把金属从它的氧化物中置换出来。 9.(2018陕西)现有一包白色粉末,可能是由氯化钾、氢氧化钠、硝酸钠和硫酸铜中的一种或多种物质组成。为确定其成分,某兴趣小组同学进行了如下探究。 (1)甲同学通过观察颜色,认为该粉末中不含硫酸铜,他是根据物质的____性质得出该结论的。乙同学认为甲同学的方法不能确定该粉末中不含硫酸铜。 (2)他们设计并进行了如下实验。(已知Ag2SO4微溶于水) ①写出生成蓝色沉淀的化学方程式________。 ②通过以上实验,不能确定白色粉末中是否含有______。 ③加入过量Ba(NO3)2溶液和稀硝酸的目的是_________。 【答案】(1).物理;(2).2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;(3).NaNO3或硝酸钠;(4).排除SO42-的干扰(合理答案即可) 【解析】(1)根据硫酸铜溶液显蓝色,属于物理性质解答;(2)①根据氢氧化钠溶液与硫酸铜反应生成氢氧化铜和硫酸钠解答;②根据框图中发生的反应和现象分析解答;③根据Ba2+与SO42-不能共存分析解答。(1)甲同学通过观察颜色,认为该粉末中不含硫酸铜,他是根据物质的物理性质得出该结论的;(2)①氢氧化钠溶液与硫酸铜反应生成氢氧化铜和硫酸钠,反应的化学方程式为2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;②由白色粉末加足量水,过滤得到蓝色沉淀滤液A可知,原固体中含有氢氧化钠和硫酸铜;向滤液A中加过量Ba(NO3)2溶液和稀硝酸得到白色沉淀和滤液B可知,将硫酸铜反应完;再向滤液B中加AgNO3溶液得到白色沉淀可知,原白色固体中含有氯化钾。故通过以上实验,不能确定白色粉末中是否含有NaNO3(或硝酸钠);③加入过量Ba(NO3)2溶液和稀硝酸的目的是排除SO42-的干扰。查看更多