- 2021-06-19 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学第20讲溶液的pH与中和反应一轮专题目复习题目
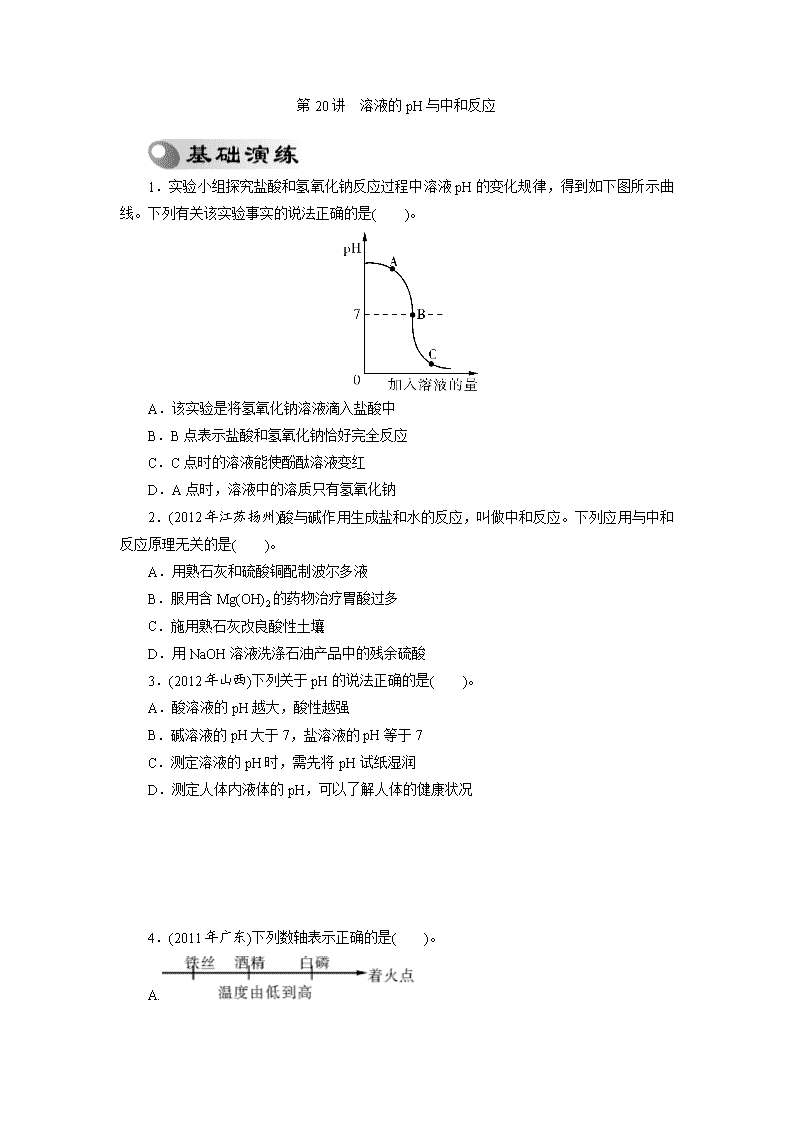
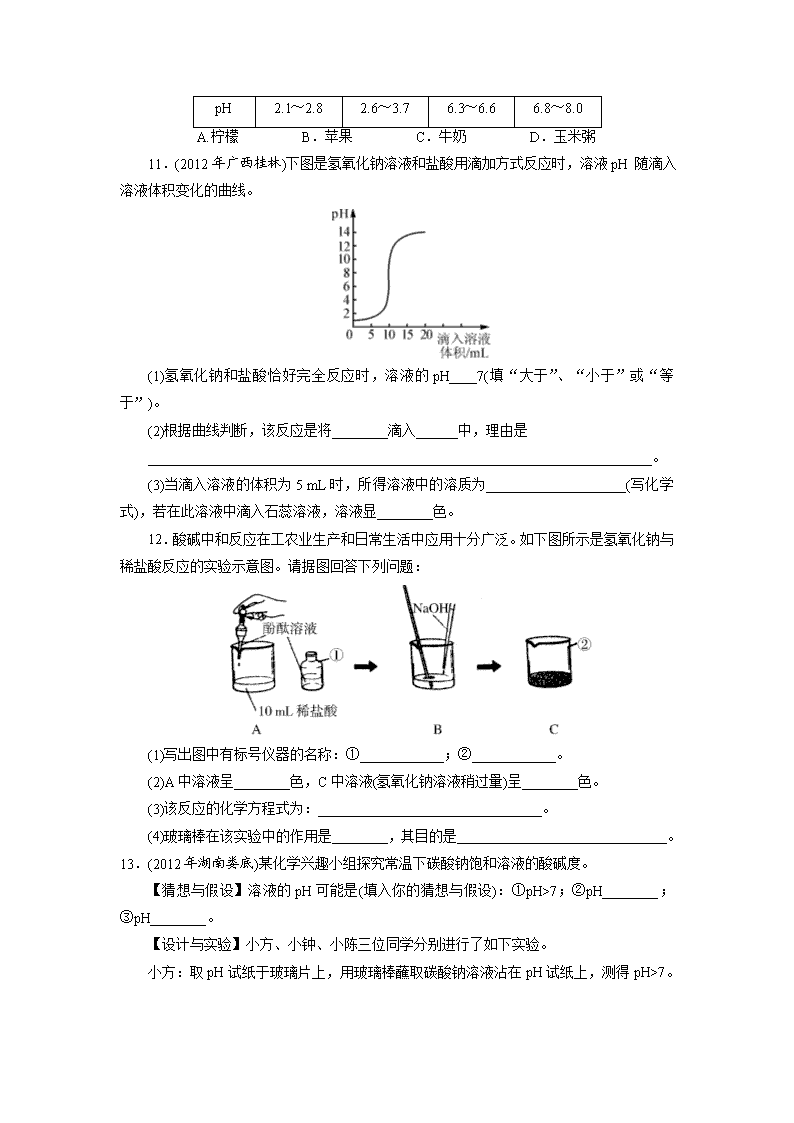
第20讲 溶液的pH与中和反应 1.实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如下图所示曲线。下列有关该实验事实的说法正确的是( )。 A.该实验是将氢氧化钠溶液滴入盐酸中 B.B点表示盐酸和氢氧化钠恰好完全反应 C.C点时的溶液能使酚酞溶液变红 D.A点时,溶液中的溶质只有氢氧化钠 2.(2012年江苏扬州)酸与碱作用生成盐和水的反应,叫做中和反应。下列应用与中和反应原理无关的是( )。 A.用熟石灰和硫酸铜配制波尔多液 B.服用含Mg(OH)2的药物治疗胃酸过多 C.施用熟石灰改良酸性土壤 D.用NaOH溶液洗涤石油产品中的残余硫酸 3.(2012年山西)下列关于pH的说法正确的是( )。 A.酸溶液的pH越大,酸性越强 B.碱溶液的pH大于7,盐溶液的pH等于7 C.测定溶液的pH时,需先将pH试纸湿润 D.测定人体内液体的pH,可以了解人体的健康状况 4.(2011年广东)下列数轴表示正确的是( )。 A. B. C. D. 5.(2012年山东日照)下列说法错误的是( )。 A.碱中一定含有氢元素 B.Ca和Ca2+两种微粒的质子数相同 C.用pH试纸测定溶液的pH时,应先用蒸馏水将试纸润湿 D.洗过的玻璃仪器内壁附着的水既不聚成水滴也不成股流下时,表示仪器已洗净 6.(2010年广东肇庆)实验测得人体内一些液体的pH如下,其中酸性最强的是( )。 A.唾液:6.6~7.1 B.胃液:0.9~1.5 C.汗液:6.6~7.6 D.血浆:7.35~7.45 7.在A+B―→盐+水的反应中,A、B分别是( )。 A.硫酸和熟石灰 B.纯碱和熟石灰 C.小苏打和盐酸 D.熟石灰和氯化铵 8.(2012年浙江丽水)下表是一些食物的pH,胃酸过多的病人空腹时最宜食用的是 ( )。 物质 番茄 葡萄 牛奶 玉米粥 pH 4.0~4.4 3.5~4.5 6.3~6.6 6.8~8.0 A.番茄 B.葡萄 C.牛奶 D.玉米粥 盐酸 CuSO4 溶液 NaCl 溶液 水 Na2CO3 溶液 NaOH 溶液 pH <7 <7 =7 =7 >7 >7 9.(2010年广东佛山)不同物质的溶液的酸碱性不同,根据下表中各溶液pH的情况判断,下列说法中正确的是( )。 A.pH<7一定是酸的溶液 B.pH>7 一定是碱的溶液 C.pH=7一定是盐的溶液 D.盐的溶液可能显酸性、碱性或中性 10.(2012年广西百色)下表是一些食物的pH,胃酸过多的病人空腹时最宜食用的是( )。 物质 柠檬 苹果 牛奶 玉米粥 pH 2.1~2.8 2.6~3.7 6.3~6.6 6.8~8.0 A.柠檬 B.苹果 C.牛奶 D.玉米粥 11.(2012年广西桂林)下图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH 随滴入溶液体积变化的曲线。 (1)氢氧化钠和盐酸恰好完全反应时,溶液的pH____7(填“大于”、“小于”或“等于”)。 (2)根据曲线判断,该反应是将________滴入______中,理由是 ________________________________________________________________________。 (3)当滴入溶液的体积为5 mL时,所得溶液中的溶质为____________________(写化学式),若在此溶液中滴入石蕊溶液,溶液显________色。 12.酸碱中和反应在工农业生产和日常生活中应用十分广泛。如下图所示是氢氧化钠与稀盐酸反应的实验示意图。请据图回答下列问题: (1)写出图中有标号仪器的名称:①____________;②____________。 (2)A中溶液呈________色,C中溶液(氢氧化钠溶液稍过量)呈________色。 (3)该反应的化学方程式为:________________________________。 (4)玻璃棒在该实验中的作用是________,其目的是______________________________。 13.(2012年湖南娄底)某化学兴趣小组探究常温下碳酸钠饱和溶液的酸碱度。 【猜想与假设】溶液的pH可能是(填入你的猜想与假设):①pH>7;②pH________;③pH________。 【设计与实验】小方、小钟、小陈三位同学分别进行了如下实验。 小方:取pH试纸于玻璃片上,用玻璃棒蘸取碳酸钠溶液沾在pH试纸上,测得pH>7。 小钟:取pH试纸于玻璃片上,先用蒸馏水润湿pH试纸,然后用玻璃棒蘸取碳酸钠溶液沾在pH试纸上,测得pH>7。 小陈:取pH试纸直接浸入碳酸钠溶液中,测得pH>7。 【评价】以上三位同学中操作规范的是______同学,其余两位同学操作上的错误是_______________;___________________________________________。 【结论】从物质的类别看,碳酸钠是一种________(填“酸”、“碱”或“盐”),它的溶液显碱性,说明显碱性的溶液________(填“一定”或“不一定”)是碱的溶液。 【应用】根据碳酸钠溶液显碱性,说出它在日常生活中的一种用途:________________________________________________________________________。 14.(2012年湖南株洲)今有①肥皂水;②食盐水;③杨梅汁;④白糖水;⑤蒸馏水五种液体。根据你的生活经验判断:其中pH<7的是________(填序号,下同),pH>7的是________。 上图是氢氧化钠与盐酸反应的微观示意图,请仔细观察、分析此图,写出一条你从图中获取的信息(用文字或化学用语表述):____________________________________________。 15.(2012年山西)同学们在学习酸碱的化学性质时构建了如下图知识网络,A、B、C、D是不同类别的无机化合物,“—”表示物质在一定条件下可以发生化学反应。请回答下列问题: (1)反应①的化学方程式为:____________________________,实验现象为________________________。 (2)写出图中一个中和反应的化学方程式:______________________________________。 (3)物质C应具备的条件是___________________________________________________。 16.(2012年陕西)某化学课堂围绕“酸碱中和反应”的主题,将学生分成若干小组,在老师的引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格。 【演示实验】将一定量的稀硫酸加入到盛有NaOH溶液的小烧杯中。 【学生板演】该反应的化学方程式:________________________。 【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中的溶质是什么呢? 【假设猜想】针对疑问大家纷纷提出猜想。甲组同学的猜想如下: 猜想一:只有Na2SO4; 猜想二:有Na2SO4和H2SO4; 猜想三:有Na2SO4和NaOH; 猜想四:有Na2SO4、H2SO4和NaOH。 乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是________________。 【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有________________。 实验 方案 测溶液pH 滴加Na2CO3 溶液 滴加BaCl2 溶液 实验 操作 实验 现象 试纸变色,对比 比色卡,pH<7 __________ 产生白色 沉淀 实验 结论 溶液中有 H2SO4 溶液中有 H2SO4 溶液中有 H2SO4 (2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。 【得出结论】通过探究,全班同学一致确定猜想二是正确的。 【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验探究】(2)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误: (1)实验操作中的错误是___________________________________________________。 (2)实验方案中也有一个是错误的,错误的原因是____________________________。 ________________________________________________________________________。 17.(2011年广东深圳)在用稀盐酸和氢氧化钡溶液进行中和反应实验时,反应过程中溶液酸碱度变化及相关数据如图所示。 (1)根据此变化曲线,你认为实验操作是将________滴加到另一种溶液中。 (2)当加入溶液的质量是a g时,滴入无色酚酞溶液,溶液呈________色,此时溶液中溶质是__________________(写化学式)。 (3)求恰好完全反应时溶液中溶质的质量(需写出计算过程)。 第20讲 溶液的pH与中和反应 【中考演练】答案 1.B 解析:该曲线是将盐酸滴入氢氧化钠溶液中,A点呈碱性,C点呈酸性,B点恰好完全反应。 2.A 3.D 4.B 5.C 6.B 7.A 8.D 解析:胃酸过多,宜用弱碱性物质中和。 9.D 10.D 11.(1)等于 (2)氢氧化钠溶液 盐酸 随着滴入溶液的增加,溶液的pH增大 (3)NaCl、HCl 红 12.(1)①细口瓶 ②烧杯 (2)无 红 (3)NaOH+HCl===NaCl+H2O (4)搅拌 使盐酸与氢氧化钠充分反应 13.[猜想与假设]②=7 ③<7 [评价]小方 小钟用蒸馏水润湿pH试纸 小陈直接将pH试纸浸入Na2CO3溶液中 [结论]盐 不一定 [应用]作洗涤剂,用于除油污(合理答案均可) 14.③ ① NaOH+HCl===NaCl+H2O(或氢氧化钠与盐酸反应生成氯化钠和水) 15.(1)Fe2O3+6HCl===2FeCl3+3H2O 红色(或红棕色)固体不断溶解,溶液由无色变成黄色 (2)Ca(OH)2+H2SO4===CaSO4+2H2O(合理即可) (3)(可溶性)盐,且和Ca(OH)2、HCl反应符合复分解反应发生的条件 16.[学生板演]H2SO4+2NaOH===Na2SO4+2H2O [假设猜想]猜想四 [实验探究](1)NaOH (2)有气泡产生 [评价反思] (1)pH试纸直接浸入溶液中测溶液的pH (2)滴加BaCl2溶液,不能证明一定有H2SO4存在(其他合理答案均可) 17.(1)稀盐酸 (2)红 Ba(OH)2和BaCl2 (3)解:设恰好完全反应时溶质的质量为x。 Ba(OH)2+2HCl===BaCl2+2H2O 73 208 20 g×7.3% x = 解得:x=4.16 g 答:恰好完全反应时溶质质量为4.16 g。查看更多