- 2021-06-19 发布 |
- 37.5 KB |
- 22页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
浙江省名校新高考研究联盟(Z20)2020届高三第二次联考化学试题 Word版含解析
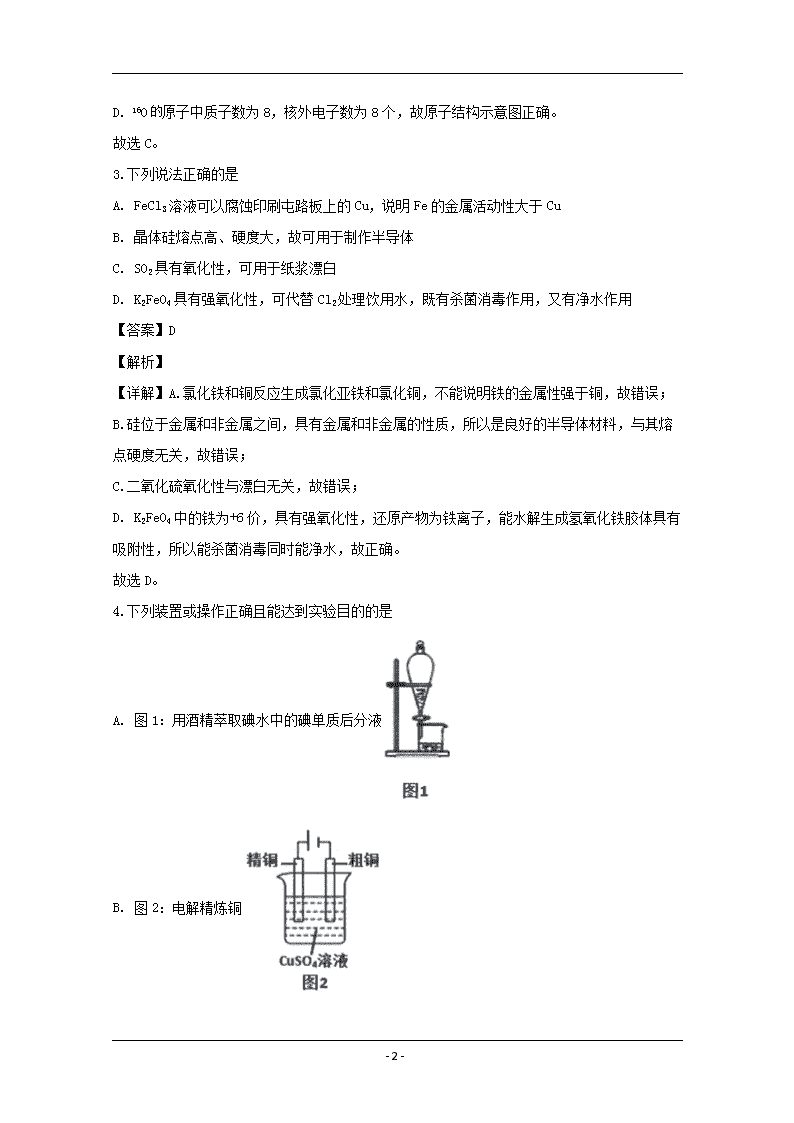
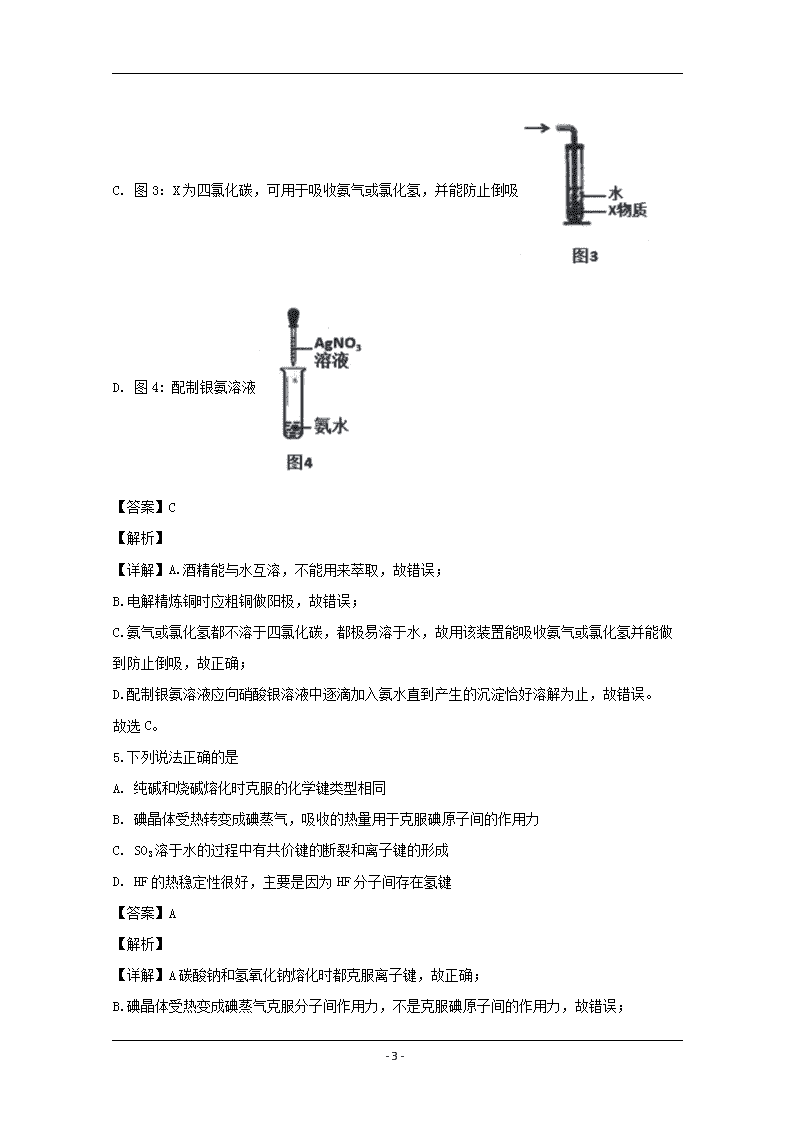
www.ks5u.com 浙江省名校新高考研究联盟(Z20联盟)2020届第二次联考 化学试题 1.化学与社会、环境密切相关,下列说法不正确的是 A. 植物秸秆可用于制造酒精与沼气等燃料 B. 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”循环利用 C. 雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 D. 小苏打可用于治疗胃酸过多,也可用于发酵粉制作面包 【答案】C 【解析】 【详解】A.植物秸秆的主要成分为纤维素,能水解生成葡萄糖,葡萄糖条能反应生成酒精,可以在一定条件下生成甲烷,故正确; B.二氧化碳合成聚合物,其聚合物能降解,实现了碳的循环,故正确; C.雷雨天时空气中的氧气有些变成了臭氧,所以空气感觉清新,故错误; D. 小苏打能与胃酸反应,用于治疗胃酸过多,碳酸氢钠能受热分解生成二氧化碳,可用于发酵粉制作面包,故正确。 故选C。 2.下列化学用语正确的是 A. CCl4分子的比例模型: B. CSO的电子式: C. 对硝基苯酚的结构简式: D. 16O的原子结构示意图: 【答案】B 【解析】 【详解】A.四氯化碳中的氯原子半径比碳原子半径大,故其比例模型错误; B. CSO的电子式应类似二氧化碳的电子式,即氧原子和碳原子之间形成两对共用电子,故正确; C. 对硝基苯酚中的硝基中的氮原子与苯环上的碳原子连接,故结构简式为,故错误; - 22 - D. 16O原子中质子数为8,核外电子数为8个,故原子结构示意图正确。 故选C。 3.下列说法正确的是 A. FeCl3溶液可以腐蚀印刷屯路板上的Cu,说明Fe的金属活动性大于Cu B. 晶体硅熔点高、硬度大,故可用于制作半导体 C. SO2具有氧化性,可用于纸浆漂白 D. K2FeO4具有强氧化性,可代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 【答案】D 【解析】 【详解】A.氯化铁和铜反应生成氯化亚铁和氯化铜,不能说明铁的金属性强于铜,故错误; B.硅位于金属和非金属之间,具有金属和非金属的性质,所以是良好的半导体材料,与其熔点硬度无关,故错误; C.二氧化硫氧化性与漂白无关,故错误; D. K2FeO4中的铁为+6价,具有强氧化性,还原产物为铁离子,能水解生成氢氧化铁胶体具有吸附性,所以能杀菌消毒同时能净水,故正确。 故选D。 4.下列装置或操作正确且能达到实验目的的是 A. 图1:用酒精萃取碘水中的碘单质后分液 B. 图2:电解精炼铜 - 22 - C. 图3:X为四氯化碳,可用于吸收氨气或氯化氢,并能防止倒吸 D. 图4: 配制银氨溶液 【答案】C 【解析】 【详解】A.酒精能与水互溶,不能用来萃取,故错误; B.电解精炼铜时应粗铜做阳极,故错误; C.氨气或氯化氢都不溶于四氯化碳,都极易溶于水,故用该装置能吸收氨气或氯化氢并能做到防止倒吸,故正确; D.配制银氨溶液应向硝酸银溶液中逐滴加入氨水直到产生的沉淀恰好溶解为止,故错误。 故选C。 5.下列说法正确的是 A. 纯碱和烧碱熔化时克服的化学键类型相同 B. 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 C. SO3溶于水的过程中有共价键的断裂和离子键的形成 D. HF的热稳定性很好,主要是因为HF分子间存在氢键 【答案】A 【解析】 【详解】A碳酸钠和氢氧化钠熔化时都克服离子键,故正确; B.碘晶体受热变成碘蒸气克服分子间作用力,不是克服碘原子间的作用力,故错误; - 22 - C.三氧化硫溶于水的过程中有共价键的断裂和形成,没有离子键的形成,故错误; D.氟化氢的稳定性好,是因为氟化氢中的共价键键能高,与氢键无关,故错误。 故选A。 【点睛】掌握氢键的位置和影响因素。氢键是分子间的作用力,影响物质的物理性质,不影响化学性质。 6.下列转化,在给定条件下能实现的是 ①NaCl(aq) Cl2(g) FeCl3(s) ②Fe2O3FeCl3(aq) 无水FeCl3 ③N2NH3NH4Cl(aq) ④SiO2SiCl4 Si A. ①③ B. ⑨④ C. ①②④ D. ①②⑧④ 【答案】A 【解析】 【详解】①NaCl溶液电解的得到氯气,氯气和铁在点燃的条件下反应生成氯化铁,故正确;②Fe2O3和盐酸反应生成氯化铁,氯化铁溶液加热蒸发,得到氢氧化铁,不是氯化铁,故错误;③N2和氢气在高温高压和催化剂条件下反应生成氨气,氨气和氯化氢直接反应生成氯化铵,故正确;④SiO2和盐酸不反应,故错误。 故选A。 7.下列离子方程式正确的是 A. Fe2(SO4)3溶液中加入足量Ba(OH)2溶液:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ B. Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH- +O2↑ C. Na2SO3溶液使酸性高锰酸钾溶液褪色:6H++5SO32-+2MnO4-=5SO42-+2Mn2++3H2O D. 向苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- 【答案】C 【解析】 【详解】A. Fe2(SO4)3溶液中加入足量Ba(OH)2溶液的离子方程式为:2Fe3++3SO42-+3Ba2++6OH-=2Fe(OH)3↓+3BaSO4↓,故错误; B. Na2O2溶于水产生O2的离子方程式为:2Na2O2+2H2O=4Na++4OH- +O2↑,故错误; - 22 - C. Na2SO3溶液使酸性高锰酸钾溶液褪色的离子方程式为:6H++5SO32-+2MnO4-=5SO42-+2Mn2++3H2O,故正确; D. 向苯酚钠溶液中通入少量CO2: C6H5O-+H2O+CO2→C6H5OH+HCO3-,故错误。 故选C。 8.下列说法不正确的是 A. 淀粉、食用花生油、鸡蛋清都能发生水解反应 B. amol苯和苯甲酸混合物在足量氧气中完全燃烧后,消耗氧气7.5a mol C. 按系统命名法,有机物的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 D. 七叶内酯(),和东莨菪内酯(),都是某些中草药中的成分,它们具有相同的官能团,互为同系物 【答案】D 【解析】 【详解】A.食用花生油是油脂,、鸡蛋清的主要成分为蛋白质,淀粉、油脂和蛋白质都能发生水解反应,故正确; B.1mol苯或苯甲酸燃烧都消耗7.5mol氧气,所以amol混合物在足量氧气中完全燃烧后,消耗氧气7.5a mol,故正确; C. 按系统命名法,有机物的命名时,从左侧开始编号,所以名称为2,2,4,4,5-五甲基-3,3-二乙基己烷,故正确; D. 七叶内酯()官能团为酚羟基和酯基,东莨菪内酯()的官能团为酚羟基和酯基和醚键,不属于同系物,故错误。 故选D。 【点睛】掌握同系物的定义,即结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物。所谓结构相似,指具有相同的官能团。 9.图为元素周期表的一部分,X、Y、W、R为短周期元素,四种元素的最外层电子数之和为21。下列说法不正确的是 - 22 - X W Y R Z A. 最高价氧化物对应水化物的酸性R>X>Y B. 84号元素与Z元素同主族 C. R、W的某些单质或两元素形成的某些化合物可作水的消毒剂 D. Z2W3具有氧化性和还原性 【答案】B 【解析】 【详解】假设X的最外层电子数为x-1,则Y的最外层电子数为x-1,Z的最外层电子数为x,W的最外层电子数为x+1,R的最外层电子数为x+2,有关系式x-1+ x-1+ x+1+ x+2=21,解x=5,则X为碳元素,Y为硅元素,Z为砷元素,W为氧元素,R为氯元素。 A. 因为元素非金属性越强,其最高价氧化物对应水化物的酸性越强,所以酸性强弱顺序为高氯酸>碳酸>硅酸,故正确; B. 84号元素都在第ⅥA主族, Z元素在第ⅤA主族,故错误; C.氯气或二氧化氯或臭氧等可作水的消毒剂,故正确; D. As2O3中砷为中间价态,具有氧化性和还原性,故正确。 故选B。 10.设ⅣA表示阿伏加德罗常数的值,下列说法正确的是 A. 足量Zn与一定量的浓硫酸反应产生22.4L气体时,转移的电子数为2NA B. 15.6g的Na2S和Na2O2固体混合物中,阴离子数为0.2NA C. 1 L 0.1 mol∙L-1的CH3COONa溶液中含有的CH3COO-数目为0.1NA D. 12g金刚石中含有的碳碳单键数约为4NA 【答案】B 【解析】 【详解】A. 未说明气体是否在标况下,不能计算,故错误; - 22 - B. Na2S和Na2O2二者的摩尔质量相同,所以 15.6g的Na2S和Na2O2固体混合物中即0.2mol,阴离子数为0.2NA,故正确; C. CH3COONa溶液中醋酸根离子水解,不能计算其离子数目,故错误; D. 12g金刚石即1mol,每个碳原子与4个碳原子形成共价键,所以平均每个碳形成2个键,则该物质中含有的碳碳单键数约为2NA,故错误。 故选B。 11.己知ROH固体溶于水放热,有关过程的能量变化如图(R=Na、K): 下列说法正确的是 A. △H1+△H2>0 B. △H4(NaOH)>△H4(KOH)>0 C. △H6(NaOH>△H6(KOH) D. △H1+△H2+△H4+△H5+△H6=0 【答案】B 【解析】 【详解】A. △H1+△H2表示ROH固体溶于水过程,该过程放热,所以应小于0,故错误; B. △H4表示ROH破坏离子键的过程,因为氢氧化钠中钠离子半径比钾离子半径小,所以破坏离子键吸收的能量氢氧化钠多,即△H4(NaOH)>△H4(KOH)>0,故正确; C. △H6都表示氢氧根离子从气态变液体,能量应相同,故错误; D. 根据盖斯定律分析,有△H1+△H2=△H4+△H5+△H6,因为ROH固体溶于水过程放热,故△H1+△H2+△H4+△H5+△H6不等于0,故错误。 故选B。 12.有一种锂离子电池,在室温条件下可进行循环充放电,实现对磁性的可逆调控。一极为纳米Fe2O3,另一极为金属锂和石墨的复合材料,电解质只传导锂离子。电池总反应为:Fe2O3+6Li2Fe+3Li2O,关于此电池,下列说法不正确的是 A. 放电时,此电池逐渐靠近磁铁 B. 放电时,正极反应为Fe2O3+6Li++6e-= 2Fe+3Li2O C. 放电时,正极质量减小,负极质量增加 D. 充电时,阴极反应为Li++e-=Li - 22 - 【答案】C 【解析】 【详解】A. 放电时,锂为负极,氧化铁在正极反应,所以反应生成铁,此电池逐渐靠近磁铁,故正确; B. 放电时,正极为氧化铁变成铁,电极反应为Fe2O3+6Li++6e-= 2Fe+3Li2O,故正确; C. 放电时,正极反应WieFe2O3+6Li++6e-= 2Fe+3Li2O,正极质量增加,负极锂失去电子生成锂离子,质量减少,故错误; D. 充电时,阴极锂离子得到电子,电极反应为Li++e-=Li,故正确。 故选C。 【点睛】掌握原电池和电解池的工作原理,注意电解质的存在形式对电极反应的书写的影响,本题中电解质只能传到锂离子,所以电极反应中出现的离子只能为锂离子。 13.不同温度下,三个体积均为1L的密闭容器中发生反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是 容器编号 温度/K 起始物质的量/mol 平衡物质的量/mol CH4 NO2 N2 CO2 H2O NO2 I T1 0.50 1.2 0 0 0 0.40 II T2 0.30 0.80 0.20 0.20 0.40 0.60 III T3 0.40 0.70 0.70 0.70 1.0 A. T1查看更多