- 2021-06-18 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习常考题型大通关10化学实验基础含解析
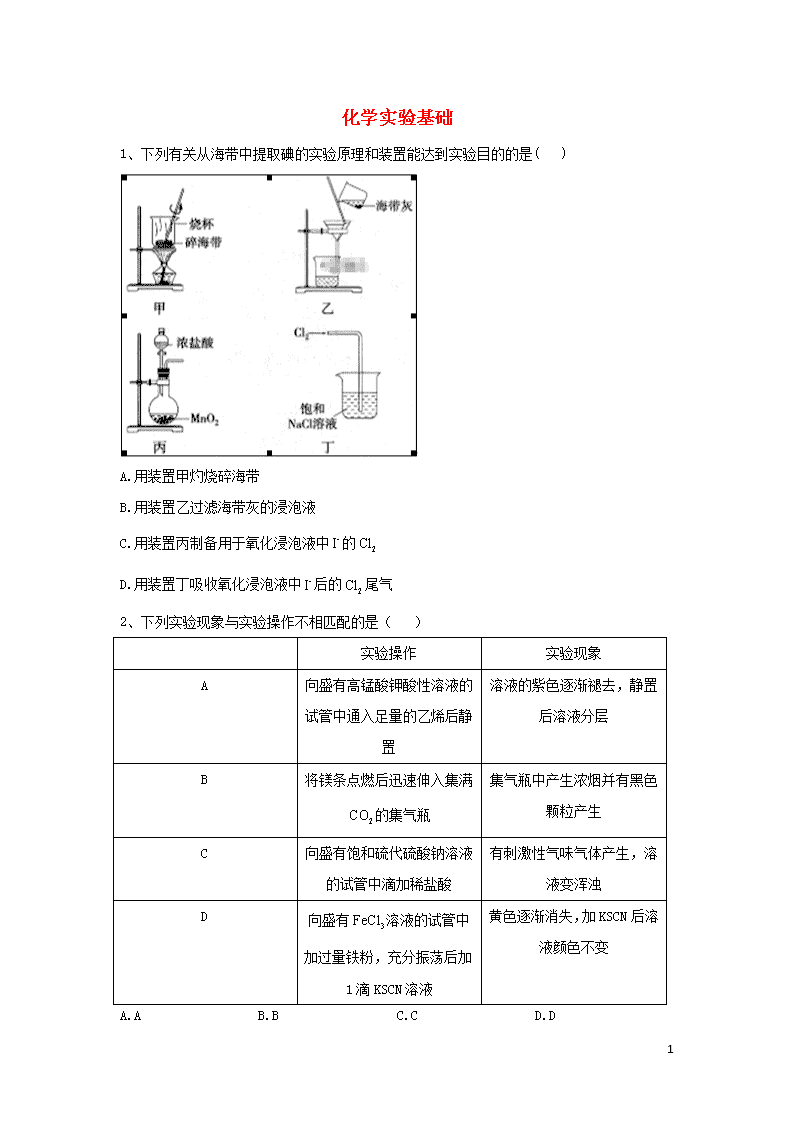
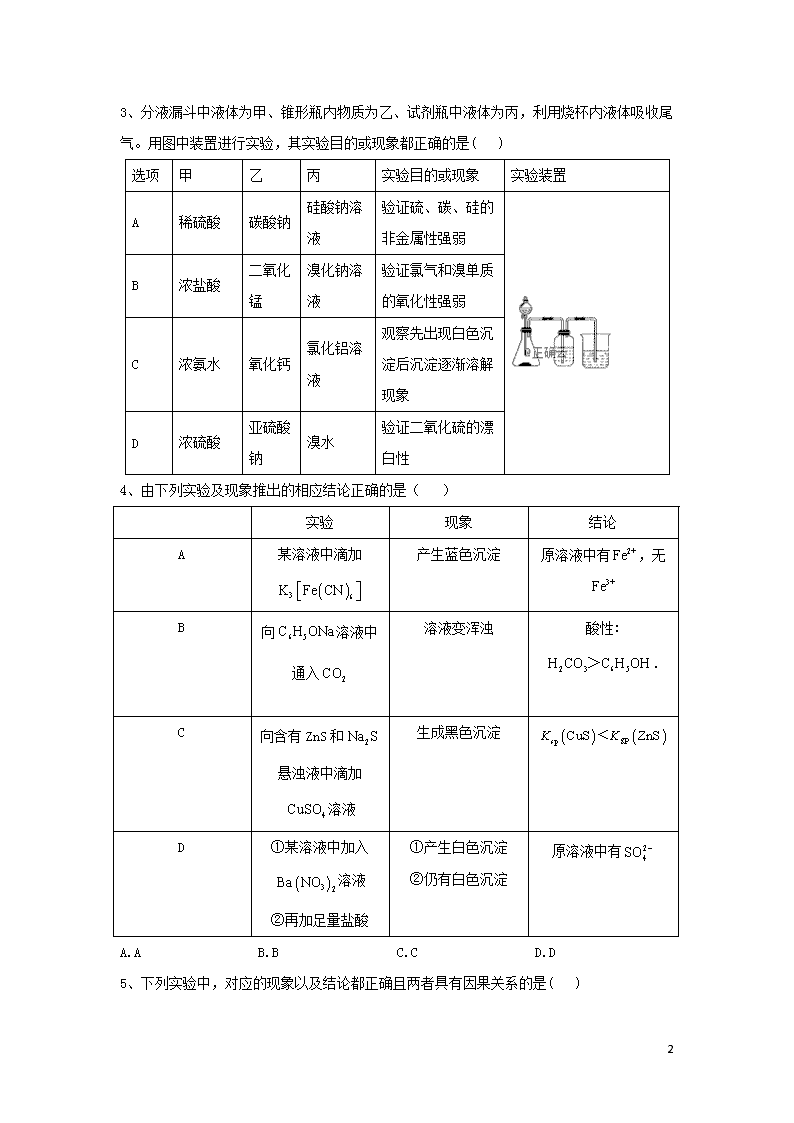
化学实验基础 1、下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( ) A.用装置甲灼烧碎海带 B.用装置乙过滤海带灰的浸泡液 C.用装置丙制备用于氧化浸泡液中的 D.用装置丁吸收氧化浸泡液中后的尾气 2、下列实验现象与实验操作不相匹配的是( ) 实验操作 实验现象 A 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 溶液的紫色逐渐褪去,静置后溶液分层 B 将镁条点燃后迅速伸入集满的集气瓶 集气瓶中产生浓烟并有黑色颗粒产生 C 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 有刺激性气味气体产生,溶液变浑浊 D 向盛有溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 黄色逐渐消失,加KSCN后溶液颜色不变 A.A B.B C.C D.D 13 3、分液漏斗中液体为甲、锥形瓶内物质为乙、试剂瓶中液体为丙,利用烧杯内液体吸收尾气。用图中装置进行实验,其实验目的或现象都正确的是( ) 选项 甲 乙 丙 实验目的或现象 实验装置 A 稀硫酸 碳酸钠 硅酸钠溶液 验证硫、碳、硅的非金属性强弱 B 浓盐酸 二氧化锰 溴化钠溶液 验证氯气和溴单质的氧化性强弱 C 浓氨水 氧化钙 氯化铝溶液 观察先出现白色沉淀后沉淀逐渐溶解现象 D 浓硫酸 亚硫酸钠 溴水 验证二氧化硫的漂白性 4、由下列实验及现象推出的相应结论正确的是( ) 实验 现象 结论 A 某溶液中滴加 产生蓝色沉淀 原溶液中有,无 B 向溶液中通入 溶液变浑浊 酸性:. C 向含有ZnS和悬浊液中滴加溶液 生成黑色沉淀 D ①某溶液中加入溶液 ②再加足量盐酸 ①产生白色沉淀 ②仍有白色沉淀 原溶液中有 A.A B.B C.C D.D 5、下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( ) 13 选项 实 验 现象 结论 A 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液呈血红色 稀硝酸将Fe氧化为Fe3+ B 将铜粉加1.0mol·L-1 Fe2(SO4)3溶液中 溶液变蓝、有黑色固体出现 金属铁比铜活泼 C 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 无液态铝滴落 金属铝的熔点高 D 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 先有白色沉淀生成后变为浅蓝色沉淀 Cu(OH)2的溶度积比Mg(OH)2的小 A.A B.B C.C D.D 6、下列实验操作规范且能达到目的的是( ) 选项 目的 操作 A 取20.00mL盐酸 在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余A盐酸放入锥形瓶 B 清洗碘升华实验所用试管 先用酒精清洗,再用水清洗 C 测定醋酸钠溶液pH 用玻璃棒蘸取溶液,点在湿润的pH试纸上 D 配制浓度为0.010 moL的溶液 称取MnO4固体0.158g,放入100mL容量瓶中,加水溶解并稀释至 A.A B.B C.C D.D 7、利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3·6H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3·6H2O。下列装置不能达到实验目的的是( ) 13 A.用装置甲制备NH3 B.用装置乙制备Cu(NH3)4Cl2溶液并沉铁 C.用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3 D.用装置丁将FeCl3溶液蒸干制备FeCl3·6H2O 8、实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是( ) A. B. C. D. 9、下列实验方案、现象、得出的结论均正确的是( ) 选项 实验及现象 结论 A 用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰 该样品含钠元素 B 向NaHCO3溶液中加入过量盐酸振荡、静置、有气泡产生 证明非金属性:Cl>C C 向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入 BaCl2产生白色沉淀 证明SO2被氧化为 D 将 10mL 2mol/L 的 KI 溶液与 1mL 1mol/L FeCl3 溶液 混合充分反应后滴加KSCN.溶液颜色变红 KI与FeCl3反应有可逆性 13 A.A B.B C.C D.D 10、下列选项中的实验操作、现象与结论完全一致的是( ) 选项 实验操作 现象 结论 A 用玻璃棒蘸取次氯酸钠溶液,点在pH试纸上 试纸最终显蓝色 次氯酸钠溶液显碱性 B 用pH试纸分别测定的溶液和的 溶液的pH 溶液的pH约为10.溶液的pH约为8 结合能力: C 用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热 熔化后的液态铝滴落下来 金属铝的熔点低 D 分别将乙烯与通入溴水中 溴水均褪色 两种气体使溴水褪色的原理相同 A.A B.B C.C D.D 11、按如图装置进行实验,下列推断正确的是( ) 选项 Ⅰ中试剂 Ⅱ中试剂及现象 推断 A 氯化铵 酚酞溶液不变红色 氯化铵稳定 B 硫酸亚铁 品红溶液褪色 FeSO4分解生成FeO和SO2 C 涂有石蜡油的碎瓷片 酸性高锰酸钾溶液褪色 石蜡油发生了化学变化 D 铁粉与水蒸气 肥皂水冒泡 13 铁粉与水蒸气发生了反应 A.A B.B C.C D.D 12、已知草酸晶体()的熔点为101℃,170℃分解。下列选用的装置和药品能达到实验目的的是( ) A. B. C. D. 13、下列实验中,现象及结论都正确,且二者之间有因果关系的是( ) 13 选项 实验操作 现象 结论 A 常温下,向等体积、等浓度的 NaHCO3 和CH3COONa 溶液中分别滴加2 滴酚酞 两份溶液均变红, NaHCO3 溶液红色更深 常温下的水解平衡常数: Kh(CH3COO-)<Kh() B 向等量同浓度的 H2O2 溶液中分别加入CuCl2、FeCl3 溶液 加 FeCl3 溶液的 H2O2 产生气泡较快 Fe3+对 H2O2分解的催化效果较好 C 使石蜡油蒸汽通过炽热的碎瓷片,将产生的气体通入酸性 KMnO4 溶液 酸性 KMnO4 溶液褪色 石蜡油裂解一定生成了乙烯 D 用两支试管各取 5 mL 0.1 mol/L 酸性 KMnO4 溶液,分别加入 2 mL 0.1 mol/L和 0.2 mol/L H2C2O4 溶液 两试管溶液均褪色,且加 0.2 mol/L H2C2O4 的试管中褪色更快 其它条件不变,H2C2O4 浓度越大,化学反应速率越大 14、易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下。下列说法错误的是( ) A.溶解废渣时不能用稀盐酸代替稀 B.除去可采用FeS C.流程中a→b的目的是富集 D.操作Ⅰ为蒸发浓缩、冷却结晶 15、实验室以空气和镁为原料制备Mg3N2的装置如图所示(夹持和加热装置略去): 下列说法正确的是( ) A.装置 A、B中可依次加入浓硫酸、NaOH 溶液 B.若去掉装置C,对产品纯度无影响 13 C.实验时应先加热C,通入一段时间空气后再加热D D.E中碱石灰的作用是吸收尾气 答案以及解析 1答案及解析: 答案:B 解析:灼烧碎海带应使用坩埚,A项错误;海带灰的浸泡液用过滤法分离获得含I-的溶液,B项正确;MnO2与浓盐酸反应制Cl2需要加热,反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,C项错误;Cl2在饱和NaCl溶液中溶解度很小,不能用饱和NaCl溶液吸收尾气Cl2,尾气Cl2应用NaOH溶液吸收,D项错误。 2答案及解析: 答案:A 13 解析:本题涉及的考点有乙烯的化学性质镁单质及其化合物的性质、硫及其化合物的性质、铁及其化合物的性质与检验,考查了学生对元素及其化合物基础知识的复述、再现、辨认并能融会贯通的能力,能从微观层面认识物质的性质和变化并用来解决宏观的实际问题,体现了以宏观辨识与微观探析为主的学科核心素养。 A项,乙烯可被酸性溶液氧化,生成,所以实验现象为溶液紫色逐渐褪去,静置后溶液不分层,故错误;B项,发生反应的化学方程式为,集气瓶中产生浓烟(MgO)并有黑色颗粒(C)产生,故正确;C项,发生反应的离子方程式为,有刺激性气味气体()产生,溶液变浑浊(生成S),故正确;D项,发生反应的离子方程式为,加入过量铁粉,完全反应,黄色逐渐消失,滴加KSCN溶液不变色,故正确。 易错提醒:乙烯被酸性溶液氧化后的产物是,故不会与水溶液分层。 3答案及解析: 答案:A 解析:A. H2SO4、H2CO3、H2SiO3均为对应元素最高价氧化物的水化物,因此通过比较其酸性可比较硫、碳、硅的非金属性强弱,故A正确; B. 二氧化锰与浓盐酸反应制备氯气需加热,图中缺少加热,故B错误; C. 氢氧化铝不能溶解在氨水中,生成沉淀不能溶解,故C错误; D. 二氧化硫与Br2的反应是氧化还原反应,该反应不能表现二氧化硫的漂白性,体现其还原性,故D错误; 故选:A。 4答案及解析: 答案:B 解析:A项,说明原溶液中有,但不能确定是否有,不正确;B项,说明制出了,正确;C项,与直接反应生成CuS黑色沉淀,不能说明,不正确;D项原溶液中若有,酸性条件下可将氧化为,不正确 温馨提示:注意酸性条件下有强氧化性。 5答案及解析: 答案:D 13 解析:A. 过量铁粉,反应生成亚铁离子,加入溶液、溶液不显红色,故A错误; B. 和发生氧化还原反应,反应方程式为,所以没有黑色沉淀生成,溶液由黄色变为蓝色,故B错误; C. 将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,形成氧化膜,三氧化二铝的熔点高于铝的熔点,包住了熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落,故C错误; D. 将溶液滴入溶液至不再有沉淀产生,说明完全反应,再滴加溶液,先有白色沉淀生成后变为浅蓝色沉淀,说明发生了沉淀的转化,溶度积大的物质向溶度积小的物质转化,所以的溶度积比的小,故D正确。 故选:D。 6答案及解析: 答案:B 解析:由于在酸式滴定管下端还有较长一段没有刻度的部分,故将滴定管(量程为50mL)中初始读数为30.00mL的液体全部放出后,所得的液体体积大于20.00mL,A错误:碘单质易溶于乙醚、乙醇等有机溶剂,故可先用酒精清洗试管中的碘单质,再用水洗去试管壁上附着的酒精,B正确:润湿的pH试纸会稀释醋酸钠溶液,造成测定的pH偏低,C错误;容量瓶只能用来定容,不能在容量瓶中溶解固体,D错误 7答案及解析: 答案:D 解析:A.实验室制备氨气,可用氢氧化钙、氯化铵在加热条件下进行,故A正确; B.氨气易溶于水,注意防止倒吸,氨气与溶液反应生成Cu(NH3)4Cl2和氢氧化铁,故B正确; C.分离固体和液体,可用过滤的方法,故C正确; D.应在蒸发皿中蒸发,且避免氯化铁水解,更不能直接蒸干,故D错误。 8答案及解析: 答案:A 13 解析:A项,HCl极易溶于水,不溶于四氯化碳,将HC通入四氯化碳中,隔绝与水的接触,四氯化碳有缓冲作用能防止倒吸故A正确;B项,重铬酸钾具有强氧化性,能氧化橡胶,应该用酸式滴定管,故B错误;C项,二氧化碳气体应从长导管进入故C错误D项,从,溶液中获得无水的方法是在不断通入HCl的条件下将,溶液蒸干,故D错误。 知识拓展:碱式滴定管不能用于盛放酸和强氧化性溶液;酸式滴定管不能用于盛放碱液。 9答案及解析: 答案:D 解析:玻璃中含有钠元素,干扰钠离子的检验,应用铁丝或铂丝,故A错误;NaHCO3溶液中加入过董盐酸,可知酸性盐酸大于碳酸,但盐酸为无氧酸,则不能比较Cl、C的非金属性,故B错误;向酸化的KMnO,溶液通入SO2,向反应后的溶液中加入盐酸酸化的 BaCl2产生白色沉淀.如果高锰酸钾溶液使用的是硫酸进行的酸化.则不能确定SO2是后来生成的还是原溶液中的,故C错误; 10mL 2mol/L的KI溶液与1mL 1mol/L FeCl3溶液混合.其中KI过量.混合充分反应后滴加KSCN,溶液颜色变红,证明溶液 中还存在三价铁离子,因此可证明KI与FeCl3反应进行不彻底,有可逆性,故D正确。 10答案及解析: 答案:B 解析:A项, NaCIO具有强氧化性,能把pH试纸漂白,故A错误;B项,依据越弱越水解,溶液的pH约为10, 溶液的pH约为8,说明水解程度大于,即结合能力:故B正确;C项,铝为活泼金属,容易与氧气反应生成氧化铝,氧化铝的熔点高于铝单质,因此现象是熔化而不滴落,故C错误;D项,乙烯与溴水发生加成反应,与溴水发生氧化还原反应褪色原理不相同,故D错误。 11答案及解析: 答案:C 解析:A.氯化铵加热分解生成氨气和HCl,遇冷时氨气与氯化氢又能够反应生成氯化铵,所以酚酞溶液不变红色,故A错误; B.该反应为氧化还原反应,生成二氧化硫的反应为还原反应,则亚铁离子应该被氧化成+3 13 价的Fe2O3,即FeSO4分解生成Fe2O3和SO2,故B错误; C.石蜡油蒸气在炽热碎瓷片的作用下,发生裂解生成乙烯,酸性高锰酸钾溶液褪色说明了有乙烯生成,从而证明石蜡油发生了化学变化,故C正确; D.加热铁粉与水蒸气,由于气体加热膨胀,能够使肥皂水冒泡,所以不能根据肥皂水冒泡得出铁粉与水蒸气发生了反应,故D错误。 故选:C。 12答案及解析: 答案:D 解析:A项,铜和稀硫酸不反应,A错误B项,常温下铝遇浓硝酸钝化而无法制取二氧化氮,B错误;C项,草酸晶体熔化温度低于分解温度,试管口应略向上倾斜,C错误;D项,苯与溴苯的沸点相差较大,可用蒸馏法分离,D正确。 审题方法:充分解读题目信息,“已知草酸晶体()的熔点为101℃,170℃分解”,说明草酸晶体受热未分解先熔化,若试管口向下倾斜,则液体流出。 13答案及解析: 答案:A 解析:A.常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞,两份溶液均变红,NaHCO3溶液红色更深,说明水解程度大,所以常温下的水解平衡常数:Kh(CH3COO−)查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档