- 2021-06-03 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版电解应用学案
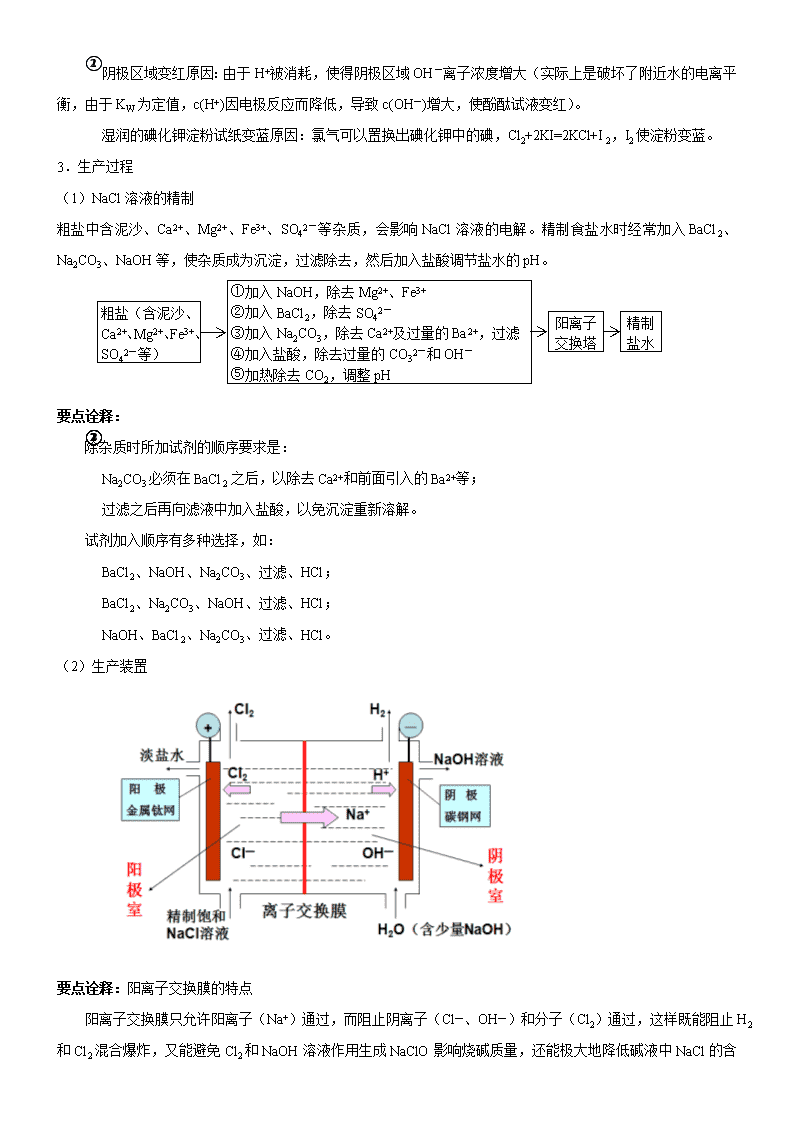
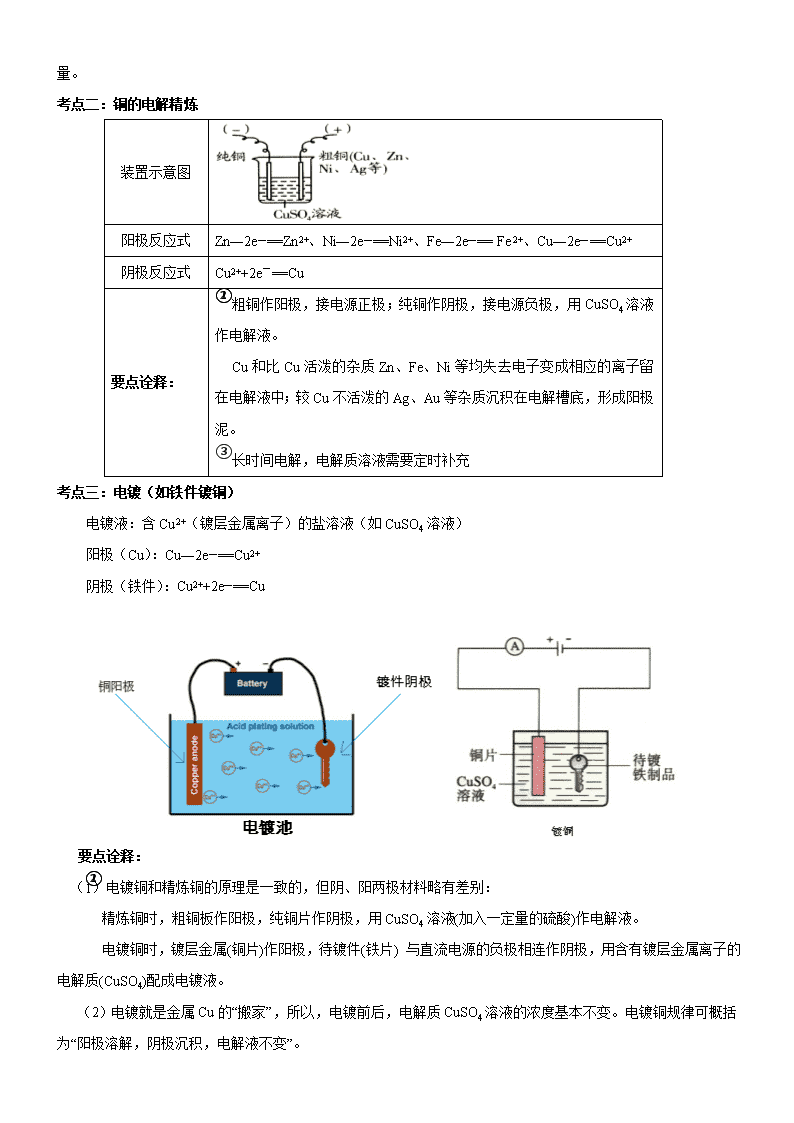
2019年全国卷高考化学总复习《电解应用》专题突破 【考纲要求】 1.巩固电解池的工作原理和电解规律。 2.了解电解原理在氯碱工业、电镀、电冶金属等方面的应用。 【考点梳理】 考点一:氯碱工业 1.定义 工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。 2.电解饱和食盐水 (1)反应原理 饱和食盐水成分:溶液存在Na+、Cl-、H+、OH-四种离子。 电极反应式: 阴极:2H++2e-=H2↑(还原反应); 阳极:2Cl--2e-=Cl2↑(氧化反应)。 电解总化学方程式: (2)实验简易装置 如图所示在烧杯里装入饱和食盐水,滴入几滴酚酞试液。用导线把铁钉、石墨捧、电流表接在直流电源上。观察现象,并用湿润的碘化钾淀粉试纸检验阳极放出的气体。 (3)实验现象 阳极(石墨棒)上有气泡逸出、该气体呈黄绿色,有刺激性气味,使湿润的碘化钾淀粉试纸变蓝;石墨棒附近的溶液由无色变为黄绿色。阴极(铁钉)上逸出气体,该气体无色、无味;阴极附近的溶液由无色先后变为浅红色、红色,且红色区域逐渐扩大。 要点诠释: ①阴极区域变红原因:由于H+被消耗,使得阴极区域OH-离子浓度增大(实际上是破坏了附近水的电离平衡,由于KW为定值,c(H+)因电极反应而降低,导致c(OH-)增大,使酚酞试液变红)。 ②湿润的碘化钾淀粉试纸变蓝原因:氯气可以置换出碘化钾中的碘,Cl2+2KI=2KCl+I2,I2使淀粉变蓝。 3.生产过程 (1)NaCl溶液的精制 粗盐中含泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,会影响NaCl溶液的电解。精制食盐水时经常加入BaCl2、Na2CO3、NaOH等,使杂质成为沉淀,过滤除去,然后加入盐酸调节盐水的pH。 粗盐(含泥沙、Ca2+、Mg2+、Fe3+、SO42-等) ①加入NaOH,除去Mg2+、Fe3+ ②加入BaCl2,除去SO42― ③加入Na2CO3,除去Ca2+及过量的Ba2+,过滤 ④加入盐酸,除去过量的CO32―和OH― ⑤加热除去CO2,调整pH 阳离子 交换塔 精制 盐水 要点诠释: 除杂质时所加试剂的顺序要求是: ①Na2CO3必须在BaCl2之后,以除去Ca2+和前面引入的Ba2+等; ②过滤之后再向滤液中加入盐酸,以免沉淀重新溶解。 试剂加入顺序有多种选择,如: ①BaCl2、NaOH、Na2CO3、过滤、HCl; ②BaCl2、Na2CO3、NaOH、过滤、HCl; ③NaOH、BaCl2、Na2CO3、过滤、HCl。 (2)生产装置 要点诠释:阳离子交换膜的特点 阳离子交换膜只允许阳离子(Na+)通过,而阻止阴离子(Cl―、OH―)和分子(Cl2)通过,这样既能阻止H2和Cl2混合爆炸,又能避免Cl2和NaOH溶液作用生成NaClO影响烧碱质量,还能 极大地降低碱液中NaCl的含量。 考点二:铜的电解精炼 装置示意图 阳极反应式 Zn―2e―==Zn2+、Ni―2e―==Ni2+、Fe―2e―== Fe 2+、Cu―2e―==Cu2+ 阴极反应式 Cu2++2e-==Cu 要点诠释: ①粗铜作阳极,接电源正极;纯铜作阴极,接电源负极,用CuSO4溶液作电解液。 ②Cu和比Cu活泼的杂质Zn、Fe、Ni等均失去电子变成相应的离子留在电解液中;较Cu不活泼的Ag、Au等杂质沉积在电解槽底,形成阳极泥。 ③长时间电解,电解质溶液需要定时补充 考点三:电镀(如铁件镀铜) 电镀液:含Cu2+(镀层金属离子)的盐溶液(如CuSO4溶液) 阳极(Cu):Cu―2e―==Cu2+ 阴极(铁件):Cu2++2e―==Cu 要点诠释: (1)电镀铜和精炼铜的原理是一致的,但阴、阳两极材料略有差别: ①精炼铜时,粗铜板作阳极,纯铜片作阴极,用CuSO4溶液(加入一定量的硫酸)作电解液。 ②电镀铜时,镀层金属(铜片)作阳极,待镀件(铁片) 与直流电源的负极相连作阴极,用含有镀层金属离子的电解质(CuSO4)配成电镀液。 (2)电镀就是金属Cu的“搬家”,所以,电镀前后,电解质CuSO4溶液的浓度基本不变。电镀铜规律可概括为“阳极溶解,阴极沉积,电解液不变”。 考点四:电解冶炼活泼金属 一些较活泼的金属常用电解的方法冶炼,如Na、Mg、Al等金属(这是因为这些金属的阳离子的氧化性很弱,难以找到经济实用的还原剂,从这个意义上看,电源的负极是最强的还原剂)。 电解熔融的电解质,可冶炼活泼金属(如K、Na、Ca、Mg、Al等)。 冶炼原理:金属阳离子在阴极上得到电子而被还原。 1、钠的冶炼 ①原料:NaCl ②阴极材料:不锈钢 ③阳极材料:石墨 ④电极反应: 阴极:2Na++2e—= 2Na 阳极:2Cl--2e—=Cl2↑ ⑤总方程式: 2、镁的冶炼 ①原料:MgCl2 ②阴极材料:不锈钢 ③阳极材料:石墨 ④电极反应: 阴极:Mg2++2e—= Mg 阳极:2Cl--2e—=Cl2↑ ⑤总方程式: 3、铝的冶炼 1000℃成为共熔体、节约能源 Al2O3熔点很高2045℃ 冰晶石(Na3AlF 6)作熔剂 电离:Al2O3(熔融) 2Al3++3O2- 电极方程式: 阳极(石墨C):6O2--12e— = 3O2↑ 阴极(不锈钢Fe):4Al3++12e— = 4Al 电解方程式: 阳极副反应 C+O2 = CO2 需补充碳块 【典型例题】 类型一:氯碱工业 例1、氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下图所示。依据下图完成下列填空: (1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为________,与电源负极相连的电极附近,溶液pH_______。(选填“不变”、“升高”、或“下降”) (2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 , 。 (3)如果粗盐中SO42—含量较高,必须添加钡试剂除去SO42—,该钡试剂可以是______。 A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2 (4)为有效除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为______。 A.先加NaOH,后加Na2CO3,再加钡试剂 B.先加NaOH,后加钡试剂,再加Na2CO3 C.先加钡试剂,后加NaOH,再加Na2CO3 (5)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为______ 。 【答案】 (1)2Cl——2e—=Cl2↑,升高 (2)Ca2++CO32—=CaCO3↓,Mg2++2OH—=Mg(OH)2↓ (3)A C (4)B C (5) Cl2十2NaOH=NaCl十NaClO十H2O 【解析】电解NaCl溶液时,在与电源正极相连的电极上(阳极),Cl—失去电子生成Cl2:2Cl——2e—=Cl2↑;在与电源负极相连的电极(阴极)发生的反应为2H+十2e—=H2↑,消耗H+,产生OH—,所以附近的pH上升。 工业食盐中含有较多的Ca2+、Mg2+杂质,可以用试剂NaOH、Na2CO3除去,所以离子反应式为Ca2++CO32—=CaCO3↓,Mg2++2OH—=Mg(OH)2↓,如果含有SO42—,则可加Ba2+形成BaSO4白色沉淀。由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2。为了有效除去Mg2+、Ca2+和SO42— ,必须先加钡试剂或NaOH,最后加入Na2CO3溶液,如果先加入Na2CO3溶液,后加BaCl2或Ba(OH)2,则多余Ba2+无法除去。 经过一段时间的电解,NaCl溶液浓度在下降,NaOH溶液浓度在上升。当NaOH溶液质量分数变成10%,NaCl溶液质量分数变成16%时,停止电解,电解液加热蒸发,由于NaOH的溶解度大于NaCl,冷却后经过滤可得NaCl固体,NaCl可循环使用。 若在电解过程中,不使用隔膜,则在阳极区生成的氯气与阴极区生成的NaOH溶液混合,发生反应,其反应式为Cl2十2NaOH=NaCl十NaClO十H2O。连同电解时发生的反应 ,两步反应可合并成 。 举一反三: 【变式1】下列描述中,不符合生产实际的是( ) A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极 C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀锌,用锌作阳极 【答案】A 【变式2】下列关于离子交换膜电解槽的叙述错误的是( ) A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室 C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成 【答案】D 【解析】用离子交换膜电解槽电解饱和食盐水时,C1-在阳极放电,H2O电离出的H+在阴极放电,因此食盐水和纯水分别进入阳极室和阴极室,A、B对;在阴极H+放电,生成H2的同时,产生大量OH-,故H2和NaOH为阴极产物,C项对;电解槽的阳极材料用金属钛网制成(一种惰性材料),不能用非惰性材料铁网,D错。 【变式3】如下图所示,用石墨电极电解100 mL 0.2 mol / L的氯化钾溶液时,接通电源前在KCl溶液中滴入2滴酚酞试液;接通电源后,观察到湿润的KI淀粉试纸逐渐变蓝。试回答下列问题: (1)还能观察到的实验现象是: ①________________________________; ②________________________________。 (2)电源中a为________极,阳极反应式为________________________。 (3)总反应式为________________________。 (4)若生成标准状况下11.2 mL H2,则溶液的pH=________(假定溶液体积仍为100 mL)。 【答案】(1)①阴、阳两极均产生气泡 ②阴极附近溶液出现红色 (2)负 2Cl――2e―==Cl2↑ (3)2KCl+2H2O2KOH+H2↑+Cl2↑ (4)12 类型二:金属的电解精炼 例2.下列关于电解法精炼粗铜的叙述中不正确的是( ) A.粗铜板作阳极,纯铜片作阴极,CuSO4溶液作电解液 B.电解时,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-=Cu C.粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥 D.电解铜的纯度可达99.95%∽99.98% 【答案】C 【解析】精炼某金属,含杂质金属应作阳极,纯单质作阴极,含该种金属元素的离子作电解液,金属活动性在Cu后面的金属杂质形成阳极泥,活动性在Cu前面的金属先放电进入溶液但其阳离子不放电,从而将该金属与杂质分离。 举一反三: 【变式1】下列关于铜电极的叙述正确的是( ) A.铜锌原电池中铜作负极 B.在铁制品上电镀铜时,用铜作阴极 C.电解饱和食盐水制烧碱时,用铜作阳极 D.电解法精炼铜时,粗铜连接电源的正极 【答案】D 【变式2】金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)( ) A.阳极发生还原反应,其电极反应式:Ni2++2e-==Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和Pt 【答案】D 【解析】阳极应发生氧化反应。电解后溶液中的阳离子主要为Ni2+。根据金属原子的还原性顺序和金属阳离子的氧化性顺序知,阳极反应为:Zn-2e-==Zn2+,Fe-2e-==Fe2+。Ni-2e-==Ni2+,Cu、Pt在该条件下不失电子,形成阳极泥。阴极反应为:Ni2++2e-==Ni,Zn2+、Fe2+在该条件下不得电子。比较两电极反应,因Zn、Fe、Ni相对原子质量不等,当两电极通过电量相等时,阳极减少质量与阴极增加质量不等。 类型三:电镀(如铁件镀锌) 例3.在铁制品上镀一定厚度的锌层,以下方案设计正确的是( ) A.锌作阳极,镀件作阴极,溶液中含有锌离子 B.铂作阴极,镀件作阳极,溶液中含有锌离子 C.铁作阳极,镀件作阴极,溶液中含有亚铁离子 D.锌作阴极,镀件作阳极,溶液中含有锌离子 【答案】A 【解析】在铁制品上镀锌,即要求锌作阳极,镀件铁为阴极,电解质溶液中含锌离子。阳极Zn放电生成Zn2+进入溶液补充由于在阴极放电而消耗的Zn2+,Zn2+在阳极铁(镀件)上析出。 举一反三: 【变式1】若在铁片上镀铜,以下叙述中错误的是( ) A.可把铁片与电源的正极相连 B.电解质必须用含有铜离子的可溶性盐 C.铜极发生氧化反应 D.铁极的电极反应式为Cu2++2e-=Cu 【答案】A 类型四:冶炼活泼金属 例4.金属冶炼和处理常涉及氧化还原反应。 (1)由下列物质冶炼相应金属时采用电解法的是 。 a.Fe2O3 b.NaCl c.Cu2S d.Al2O3 (2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是 ,当1molO2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。 (3)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。 (4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用是 。 【答案】(1)b、d (2)Cu2S;4;氢气 (3)a;2H++NO3-+e-→NO2↑+H2O (4)做电解质溶液(或导电) 【解析】(1)活泼金属的冶炼常采用电解法,故选b、d。 (2)反应过程中Cu2S中铜元素和硫元素化合价均升高,Cu2S为还原剂,1molCu2S共失去10mol电子,1molO2发生反应消耗molCu2S,转移4mol电子;CuSO4 水解使溶液显酸性,加入镁条可生成H2。 (3)电解精炼银,粗银做阳极,阴极发生还原反应,NO3-在酸性条件下得电子生成NO2。 (4)本题中处理银器表面Ag2S的方法是利用原电池原理,Ag2S得电子转化成Ag,食盐水做电解质溶液形成闭合回路。 举一反三: 【变式1】铝和氢氧化钾都是重要的工业产品。请回答: (1)工业冶炼铝的化学方程式是________。 (2)铝与氢氧化钾溶液反应的离子方程式是________ (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。 ①该电解槽的阳极反应式是 。 ②通电开始后,阴极附近溶液pH会增大,请简述原因_______ ③除去杂质后的氢氧化钾溶液从液体出口________(填“A”或“B”)导出。 【答案】(1)2Al2O34Al+3O2↑ (2)2Al+2OH-+2H2O==2AlO2-+3H2↑ (3)①4OH--4e-==2H2O+O2↑ ②H+放电,促进水的电离,OH-浓度增大 ③B 【解析】离子交换膜法电解提纯KOH时,阳极反应为:4OH--4e-==2H2O+O2↑,阴极反应为:4H2O+4e-==4OH-+2H2↑。电解过程中阳极附近的K+通过阳离子交换膜向阴极移动,含氧酸根离子不能通过离子交换膜。一段时间后,阴极附近K+、OH-浓度变大,从B处(阴极区)得到溶液蒸发结晶后可得较纯净的KOH。 离子交换膜电解槽的导电原理是:(1)在外电路导线内通过自由电子的定向移动导电;(2)在两极上分别发生氧化(失e-)、还原(得e-)反应导电;(3)在电解质溶液中通过阳离子(阳离子交换膜)定向移动导电。查看更多