- 2021-05-28 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版化学九年级下册第8单元测试卷
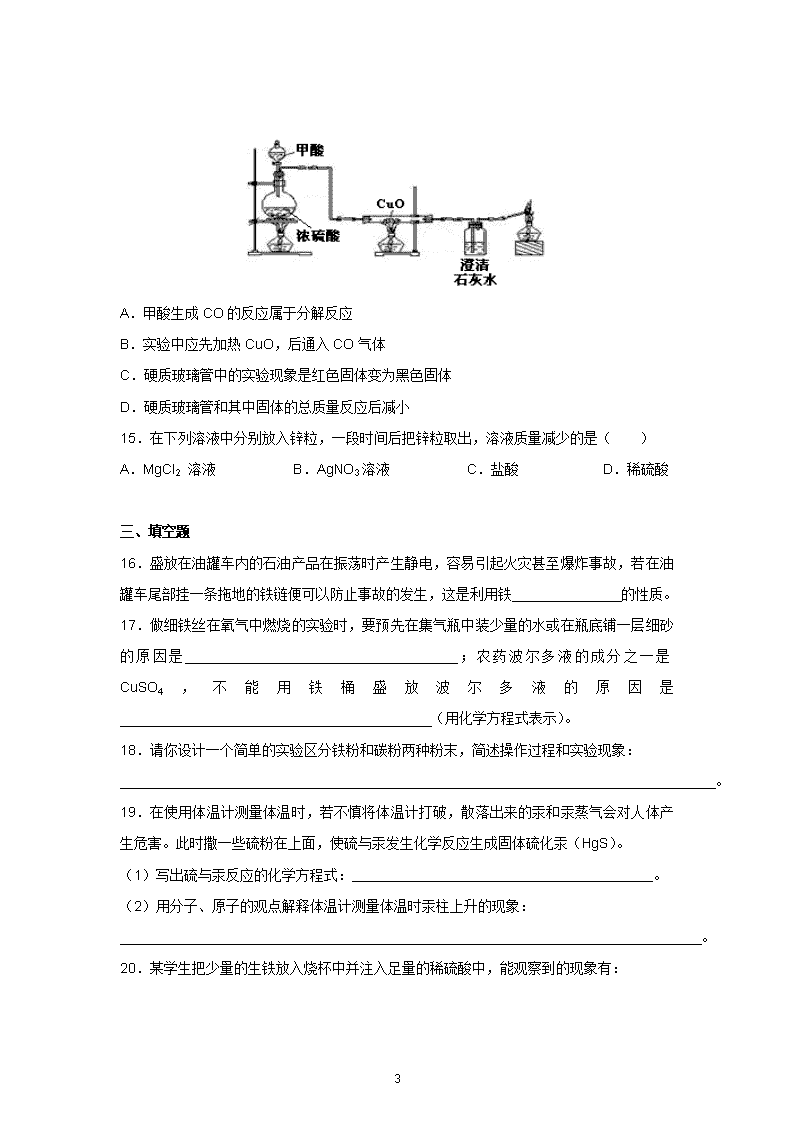
第八单元测试卷 姓名 班级 学号 一、选择题(每小题只有1个选项符合题意。) 1.下列变化属于化学变化的是( ) A.铁受热熔化成铁水 B.铁在潮湿的空气中生锈 C.用砂纸打磨铁制品表面的锈 D.冶炼时将铁矿石粉碎 2.食品包装袋中经常使用到铝箔,铝能制成铝箔是因为铝具有良好的( ) A.导电性 B.抗腐蚀性 C.导热性 D.延展性 3.下列关于钢的说法不正确的是( ) A.钢是一种铁的合金 B.钢的许多性能优于生铁 C.钢的含碳量高于生铁 D.钢属于金属材料 4.已知X、Y、Z三种金属能发生下列反应:X + H2SO4 == XSO4 + H2↑;Y + Z(NO3)2 == Y(NO3)2 + Z;Z + X(NO3)2 == Z(NO3)2 + X。则X、Y、Z三种金属与氢的活动性由强到弱的顺序为( ) A.X>H>Y>Z B.X>H>Z>Y C.Z>Y>X>H D.Y>Z>X>H 5.下列反应中不属于置换反应的是( ) A.一氧化碳和氧化铁反应得到铁 B.铁与稀硫酸反应得到氢气 C.氢气与氧化铜反应得到铜 D.铜与硝酸银溶液反应得到银 6.某合金与铁的物理性质比较如下,熔点:某合金为2500℃,铁为1535℃;密度:某合金为3.00g/cm3, 铁为7.86 g/cm3;硬度(以金刚石硬度为10作为标准):某合金为7.4,铁为4.5;导电性(以银的导电性为100作为标准):某合金为2.3,铁为17。还已知某合金耐腐蚀、强度大。根据以上信息,你认为该合金适合用作( ) A.导线 B.保险丝 C.飞机外壳 D.炊具 7. 要除去铜粉中的少量铁粉,可加入下列试剂中的( ) A.水 B.稀盐酸 C.硫酸亚铁 D.硝酸银溶液 9 8.将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液中,搅拌,使其充分反应后,过滤,滤纸上留下的金属是( ) A.Ag B.Fe、Ag C.Zn、Fe D.Zn、Fe 、Ag 9.质量相同的下列金属与足量的稀硫酸反应,生成氢气最多的是( ) A.铝 B.镁 C.铁 D.锌 10.在天平两盘上的烧杯中,各放入质量相同的稀硫酸,调节天平至平衡。分别向两边烧杯各加入5g镁和5g铁,镁和铁全部反应而消失后,天平的指针( ) A.偏向加铁的一边 B.偏向加镁的一边 C.仍停留在原来的位置 D.无法确定 二、选择题(每小题有1~2个选项符合题意。) 11.下列有关金属的说法正确的是( ) A.铜的导电性是金属中最好的,故用于制作电线 B.铝比铁金属活动性强,但铝制品比铁制品耐腐蚀 C.铜、黄铜、锡、焊锡都属于单质 D.镀锌的“白铁皮”不易生锈,说明锌没有铁活泼 12.下列物质中,不能用金属跟稀酸反应直接制得的是( ) A.硫酸锌 B.氯化镁 C.氯化铁 D.硫酸铜 13.铁及其合金在生产、生活中应用广泛。下列关于铁及其合金的说法中正确的是( ) A.铁是地壳中含量最丰富的金属元素 B.不锈钢的抗腐蚀性好,可用于制造医疗器械 C.铁丝能在氧气中剧烈燃烧、火星四射,生成氧化铁 D.铁生锈是铁与空气中的氧气、水发生缓慢氧化的过程 14.常温下甲酸(HCOOH)是一种无色、有刺激性气味的液体,与浓硫酸混合加热的反应为:HCOOH CO↑+H2O。实验室可利用下图装置制取CO并还原CuO。下列说法不正确的是 ( ) 9 A.甲酸生成CO的反应属于分解反应 B.实验中应先加热CuO,后通入CO气体 C.硬质玻璃管中的实验现象是红色固体变为黑色固体 D.硬质玻璃管和其中固体的总质量反应后减小 15.在下列溶液中分别放入锌粒,一段时间后把锌粒取出,溶液质量减少的是( ) A.MgCl2 溶液 B.AgNO3溶液 C.盐酸 D.稀硫酸 三、填空题 16.盛放在油罐车内的石油产品在振荡时产生静电,容易引起火灾甚至爆炸事故,若在油罐车尾部挂一条拖地的铁链便可以防止事故的发生,这是利用铁______________的性质。 17.做细铁丝在氧气中燃烧的实验时,要预先在集气瓶中装少量的水或在瓶底铺一层细砂的原因是___________________________________;农药波尔多液的成分之一是CuSO4,不能用铁桶盛放波尔多液的原因是________________________________________(用化学方程式表示)。 18.请你设计一个简单的实验区分铁粉和碳粉两种粉末,简述操作过程和实验现象: 。 19.在使用体温计测量体温时,若不慎将体温计打破,散落出来的汞和汞蒸气会对人体产生危害。此时撒一些硫粉在上面,使硫与汞发生化学反应生成固体硫化汞(HgS)。 (1)写出硫与汞反应的化学方程式: 。 (2)用分子、原子的观点解释体温计测量体温时汞柱上升的现象: 。 20.某学生把少量的生铁放入烧杯中并注入足量的稀硫酸中,能观察到的现象有: 9 ①生铁表面有 产生,②溶液逐渐变为 ,③完全反应后烧杯底部有黑色残渣,其化学式为 。以上反应的化学方程式为 。 21.铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关。 (1)按人类开始使用这三种金属的先后排序为 (用元素符号表示)。 (2)在空气中铝制品更耐腐蚀的原因是 。 (3)只用一种试剂即可验证这三种金属的活动性顺序,下列试剂中能达到目的的是 (填序号)。 A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液 (4)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度 (填“大”或“小”)。 22.A~H都是初中化学常见的物质,它们的转化关系如下图所示。A、B均为黑色粉末;D、F均为红色固体,且D为单质;C能使澄清石灰水变浑浊。请回答: (1)反应①的化学方程式为 ,所属基本反应类型为 反应。 (2)反应②所属基本反应类型为 反应。 (3)反应③的化学方程式为 ,在该反应中E表现出 性。 (4)请写出一个能实现反应④的化学方程式 。 23.相同质量的M、N两种活泼金属,分别与足量的同种浓度稀盐酸在室温下发生反应(M、N在生成物中的化合价为均为+2价),生成H2的质量m和反应时间t的关系如右图所示。 (1)金属活动顺序是M比N (填“强”或“弱”),相对原子质量是M比N的 (填“大”或“小”)。 9 (2)M与稀盐酸反应结束后,消耗稀盐酸中HCl的质量为 g。 四、实验题 24.某研究小组为验证铁、铜、锌、银的金属活动性顺序,设计如右图所示三个实验(三种金属均已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同)。 (1)一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为 色,这说明铜比银的金属活动性 (选填“强”或“弱”),该反应的化学方程式为 。 (2)甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是 。 (3)乙、丙两位同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,两人分别选用不同的金属与不同类的化合物溶液,各自补做了一个实验,装置均如右图所示,且都实现了探究目的。 乙同学的实验:X是金属 ,Y是 溶液; 丙同学的实验:X是金属 ,Y是 溶液。 25.小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。 【查阅资料】真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金;铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜,碱式碳酸铜受热易分解生成CuO、H2O和CO2。据上述资料可推知,碱式碳酸铜由 种元素组成。 【实验探究】将该枚戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。 (1)小明认为:气体中除了含有CO2,还可能含有少量 。实验室常用 的方法检验这种可能含有的气体。 (2)小红认为,除了水外,蓝绿色溶液中只含有氯化锌。小华认为除了水和氯化锌外,蓝绿色溶液中还应该含有 、 。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了现象:① ,② ,证实了自己的观点。 9 (3)小娟取适量新制的FeCl2溶液,加入锌粒,一段时间后,溶液颜色变浅。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是 。 (4)小明想进一步探究“金戒指”中铜元素的含量,取一枚同材质的“金戒指”,称得质量为3.8g。在老师的指导下,将“金戒指”经浓硝酸氧化、碱化等步骤处理后,最终得到纯净的氧化铜,称得质量仍然为3.8g(实验过程中铜元素损失忽略不计)。则“金戒指”中铜元素的质量分数是多少?(写出计算过程) 五、计算题 26.某炼铁厂用赤铁矿石冶炼生铁。若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿石多少吨? 六、附加题 27.某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是( ) A.Zn和Fe B.Cu和Au C.Zn和Cu D.Mg和Al 28.向只溶解有硝酸银和硝酸铜的溶液中加入一定量的铁粉,充分反应后溶液中仍有金属固体。过滤后往滤渣中加入盐酸,没有气体放出。根据上述现象,下列说法正确的是( ) A.滤渣中一定没有Fe B.滤渣中一定有Ag和Cu C.滤液中一定有Fe(NO3)2 D.滤液中一定没有AgNO3,一定有Cu(NO3)2 29.探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和浓度均相等。 9 (1) 该实验的目的是 、 。两支长颈漏斗中产生的现象的不同之处是 。 (2)若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量________(填“多”、“少”或“相等”)。 探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。 A:称取一定质量的样品,加入足量的稀盐酸,搅拌,过滤、洗涤、干燥、称量所得固体质量 B:称取一定质量的样品,加入足量的硫酸铜溶液,搅拌,过滤、洗涤、干燥、称量所得固体质量 (3)两种方案,你认为不能达到目的的是 (填“A”或“B”),理由是 。 (4)在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数________(填“偏大”、“偏小”、“不变”或“无法判断”)。 9 参考答案及评分标准 一、选择题(若不完成附加题,每小题2分,共20分;若完成附加题,每小题1分,共10分。) 1 2 3 4 5 6 7 8 9 10 B D C D A C B B A A 二、选择题(每小题2分,共10分) 11 12 13 14 15 B CD BD BC B 三、填空题[23题(2)2分,其余每空1分,共24分。] 16.可导电. 17.防止高温熔化物溅落使瓶底炸裂 Fe+CuSO4==Cu+FeSO4 18.用磁铁分别靠近两种固体,被吸引的是铁,不能被吸引的是碳(合理答案均可) 19.(1)Hg+S==HgS (2)受热后,汞原子的间隔变大,汞柱上升 20.气泡 浅绿色 C Fe+H2SO4==FeSO4+H2↑ 21.(1)Cu Fe Al(2)铝在常温下易与氧气反应生成一层致密的氧化物保护膜 (3)B(4)大 22.(1)C+2CuO2Cu+CO2↑ 置换 (2)化合 (3)Fe2O3+3CO2Fe+3CO2 还原 (4)Fe+CuSO4===FeSO4+Cu(合理答案均可) 23.(1)强 小 (2)36.5 四、实验题[25题(4)4分,其余每空1分,共20分。] 24.(1)蓝 强 Cu+2AgNO3===Cu(NO3)2+2Ag (2)锌与盐酸反应产生氢气比铁快 (3)Fe CuSO4 Cu HCl(合理答案均可) 25.【查阅资料】4 【实验探究】(1)氢气 点燃 9 (2)HCl CuCl 铁片表面产生气泡 最后光亮的银白色铁片表面出现红色物质 (3)铜<铁<锌; (4)3.8gCuO中含铜元素质量为:3.8g×64/80=3.04g “金戒指”中铜元素的质量分数=3.04g/3.8g×100%=80% 五、计算题(共6分。) 26.解:铁的质量为1120t×95%=1064t 设赤铁矿的质量为x Fe2O3~2Fe 160 112 80%x 1064t 160/80%x=112/1064t x=1900t 答:需赤铁矿石1900t。 六、附加题(共10分。) 27.A(2分) 28.AC(2分) 29.(1)比较镁、铁与稀盐酸反应的剧烈程度(1分) 比较相同时间内镁、铁与稀盐酸反应放出热量的多少(1分) 甲装置长颈漏斗中的液面比乙装置中的高(1分) (2)相等 (1分) (3)B(0.5分) 铁未被完全除尽(0.5分) (4)偏小(1分) 9查看更多