- 2021-05-28 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第4讲 氮及其重要化合物-4硝 酸
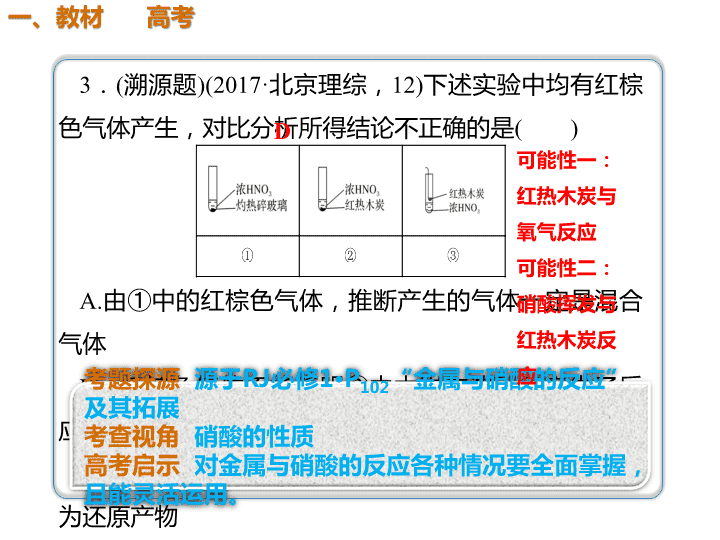
01 02 03 04 拓展提升 典例剖析 反思归纳 教材 高考 3.(溯源题)(2017·北京理综,12)下述实验中均有红棕 色气体产生,对比分析所得结论不正确的是( ) A.由①中的红棕色气体,推断产生的气体一定是混合 气体 B.红棕色气体不能表明②中木炭与浓硝酸产生了反 应 C.由③说明浓硝酸具有挥发性,生成的红棕色气体 为还原产物 D.③的气体产物中检测出CO2,由此说明木炭一定与 浓硝酸发生了反应 D 可能性一: 红热木炭与 氧气反应 可能性二: 硝酸挥发与 红热木炭反 应 3.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3 的物质的量浓度分别是4 mol·L-1和2 mol·L-1,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束 后,可产生标准状况下的气体的体积为(设反应中 HNO3被还原成NO)( ) A.0.448 L B.0.672 L C.0.896 L D.0.224 L 解析 金属和混酸反应通过离子方程式计算比较简 便,3Fe+8H++2NO===3Fe2++2NO↑+4H2O(铁 过量,产物为Fe2+),反应中Fe和H+过量,生成的 NO的量以NO为准来计算,共得NO 0.448 L,若只 考虑到这一步反应,得答案A是错误的,因为过量 的铁还可以和溶液中过量的H+反应产生H2,即有Fe +2H+===Fe2++H2↑,生成的H2为0.224 L,所以气 体体积共计0.672 L,应选B。 B 金属与硝酸反应计算题的一般方法 铜与一定量浓硝酸反应,得到硝酸铜溶液 和NO2、N2O4、NO的混合气体,这些气体 与5.6 L O2(标准状况)混合后通入水中, 所有气体完全被水吸收生成硝酸。则消耗 铜的质量为 g。 32 两个氧化还原反应过程,得失电子守 恒可得关系式2Cu ~ O2 ~ 4e- 对应成比 例计算可得答案。查看更多