- 2021-05-28 发布 |
- 37.5 KB |
- 70页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
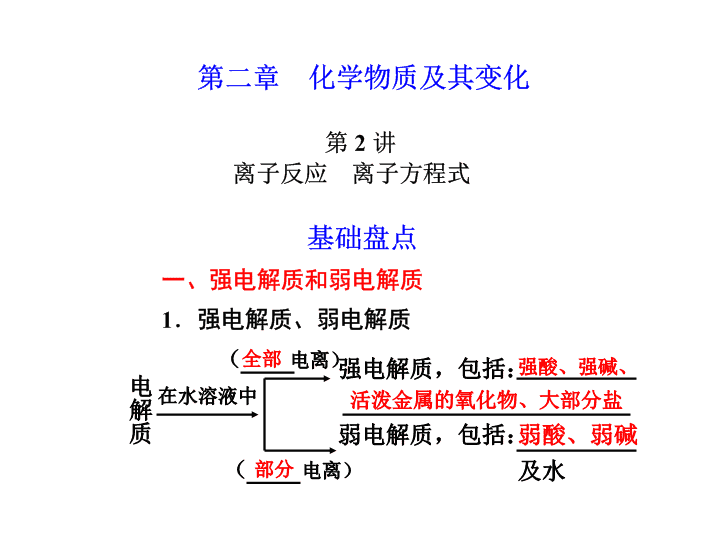
化学高考一轮复习课件:第2章 第2讲 离子反应、离子方程式
电离)电 解 质在水溶液中 电离) 全部 部分 强电解质,包括: 弱电解质,包括: 强酸、强碱、 活泼金属的氧化物、大部分盐 弱酸、弱碱 及水 ( ( HS-H++S2- H2SO4===2H++SO 2-4 NaOH===Na++OH- (NH4)2SO4===2NH++SO2-44 H2SH++HS- == H++AlO-+H2OAl(OH)3Al3++3OH - NaHSO4===Na++H++ SO2- 4 NaHSO4===Na++HSO- 4 2 离子 减小 沉淀 气体 弱电解质 转移 用实际参加反应的离子符号表示离子反 应的式子 一个具体的反应 同一类型的离子反应 原子 电荷 答案 C × × √ √ × × √ √ × × √ √ × × √ √ 答案 C 答案 D 答案 B 答案 C 例4 近年高考中10种常考易错离子组合的剖析 注:7、8、9中S2-与不同的金属阳离子反应,其反应原理不同。 答案 D 答案 B 答案 A 解析 离子方程式H++OH-===H2O表示的 是 强酸和强碱中和生成可溶性盐和水的反应。A项中 NH4Cl不是强碱而是盐;B项中Mg(OH)2是难溶于 水 的中强碱;C项中NaHCO3是酸式盐,因此只有D项 符合题意。 D△ 答案 B 答案 C 答案 C 答案 D 答案 C D 答案 C 答案 D 答案 B 褪色 黄色沉淀 还原 氧化 5SO2+2MnO +8H+ 2Mn2++5SO +4H2O 4 2 4 Al3++3OH- Al(OH)3 +2H2O 2 Al(OH)3+OH- AlO 2 2 2Al+2OH— 2AlO +H2 2 2 2Fe2++Cl2 2Fe3++2Cl- 2Fe2++2I-+2Cl2 2Fe3++4Cl-+I2 Ba2++SO BaSO4 NH +OH- NH3·H2O Fe3++3H2O Fe(OH)3 +3H+ 2 4 4查看更多