- 2021-05-28 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
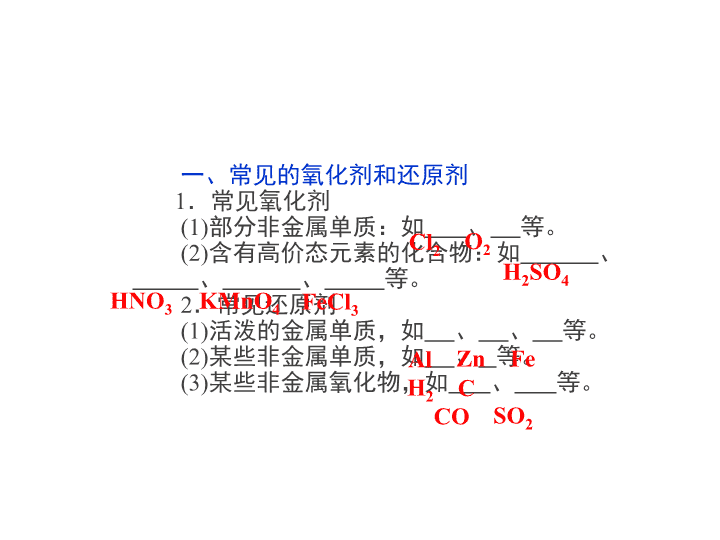
高中-化学:2氧化剂和还原剂
1.认识氧化剂、还原剂、氧化性、 还原性等基本概念。 2.了解常见的氧化剂、还原剂。 3.了解氧化还原反应的应用。 一、常见的氧化剂和还原剂 1.常见氧化剂 (1)部分非金属单质:如 、 等。 (2)含有高价态元素的化合物:如 、 、 、 等。 2.常见还原剂 (1)活泼的金属单质,如 、 、 等。 (2)某些非金属单质,如 、 等。 (3)某些非金属氧化物,如 、 等。 Cl2 O2 H2SO4 HNO3 KMnO4 FeCl3 Al Zn Fe H2 C CO SO2 一种物质若具有氧化性,则不具有还原性, 反之亦然,这种观点是否正确? 【思考·提示】 不正确。物质是否具有氧 化性或还原性,与物质的性质有关,有些物质 只具有氧化性,如F2,有些物质只具有还原性, 如K、Ca等,也有些物质既具有氧化性又具有还 原性,如SO2在反应SO2+2H2S===3S↓+2H2O中 表现氧化性,而在反应SO2+Cl2+ 2H2O===2HCl+H2SO4中表现还原性。 思考 二、氧化还原反应的存在 1.有利于人类生活和生产:金属的冶炼、电镀、 燃料的燃烧等。 2.对人类生活和生产不利: 、 、 等。 易燃物的自燃 食物的腐败 钢铁的锈蚀 1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还 原剂>还原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2 氧化性、还原性强弱的判断 2.根据物质活动性顺序比较判断 (1)根据金属活动性顺序进行判断 (2)根据非金属活动性顺序进行判断(常见元素): 3.根据产物的价态判断 氧化性:Cl2>I2 1.氧化性、还原性的强弱取决于物质得、 失电子的难易程度,而与得、失电子数目的多少 无关。 2.元素的化合价处于最高价态时,具有氧 化性,但不一定具有强氧化性,如Na+。处于最 低价态时具有还原性,但不一定具有强还原性, 如F-。 特别提醒 (2010年宜昌高一检测)已知I-、Fe2+、SO2、 Cl-和H2O2均有还原性,它们在酸性溶液中还原 性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反 应不可能发生的是( ) A.2Fe3++SO2+2H2O===2Fe2++SO42- +4H+ B.I2+SO2+2H2O===H2SO4+2HI C.2Fe2++I2===2Fe3++2I- D.H2O2+SO2===H2SO4 【解析】 解答本题可根据每个氧化还原反应中还原剂的还原性大于 还原产物的还原性。 对于A项SO2是还原剂,Fe2+是还原产物,故还原性为SO2>Fe2+,A 项能发生;B项中SO2是还原剂,HI是还原产物,故还原性为SO2>I-,B项正 确;C项中Fe2+是还原剂,I-是还原产物,故还原性为Fe2+>I-与已知信息矛 盾,故C项错。D项中SO2是还原剂,H2O2是氧化剂,故还原性为SO2>H2O2, D项正确。 【答案】 C 1.已知反应:①Cl2+2NaBr===2NaCl+ Br2;②2KI+Br2===2KBr+I2;③Na2S+ I2===2NaI+S↓,则下列离子还原性由强到弱 的排列中,正确的是( ) A.Cl->Br->I->S2- B.Br->Cl->I->S2- C.S2->Br->I->Cl- D.S2->I->Br->Cl- 解析:选D。根据化学反应①,氧化性:Cl2>Br2,还原性:Br->Cl-; 根据化学反应②,氧化性:Br2>I2,还原性:I->Br-;根据化学反应③,氧化 性:I2>S,还原性:S2->I-。综合①、②、③,离子的还原性强弱顺序为:S2 ->I->Br->Cl-。 1.守恒规律 化合价有升必有降,电子有得必有失,对于 一个完整的氧化还原反应,化合价升高总数与降 低总数相等,失去电子总数与得到电子总数相等。 此外反应前后质量相等,电荷总数相等(离子反 应)。 2.价态规律 元素处于最高价态,只有氧化性(如Fe3+、 KMnO4等);元素处于最低价态,只有还原性(如 S2-、I-等);元素处于中间价态,既有氧化性又 有还原性。 氧化还原反应的规律 3.先后规律:即在氧化还原反应中,遵 循强者为先,即谁的氧化性(或还原性)最强, 谁就先发生反应。 4.“只相叠,不相交”规律:即同种元素 不同价态之间,相邻价态不反应,发生反应 时化合价向中间靠拢,但不交叉。 ClO2是一种广谱型的消毒剂,根据世界环 保联盟的要求,ClO2将逐渐取代Cl2成为生产自 来水的消毒剂。工业上ClO2常用NaClO3和 Na2SO3溶液混合并加H2SO4酸化后反应制得(已 知反应中Na2SO3被氧化成Na2SO4),在以上反应 中NaClO3和Na2SO3的物质的量之比为( ) A.1∶ 1 B.2∶ 1 C.1∶ 2 D.2∶ 3 【思路点拨】 解决此类题目要注意以 下两点: (1)在反应中变价元素的化合价是怎样变 化的。 (2)根据化合价变化确定电子转移数目, 并使得失电子相等。 【答案】 B 如果上述物质反应时NaClO3生成NaCl,则氧 化剂和还原剂的物质的量之比是多少? 2.一定条件下,PbO2与Cr3+反应,产物 是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需 PbO2的物质的量为( ) A.3.0 mol B.1.5 mol C.1.0 mol D.0.75 mol 解析:选B。在过程1 mol Cr3+~0.5 mol Cr2O72-中铬元素失3 mol 电子, 所以在PbO2~Pb2+中铅得2 mol 电子,故需PbO2的物质的量为1.5 mol。查看更多