- 2021-05-28 发布 |
- 37.5 KB |
- 25页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一化学课件:2化学反应与能量 化学能与热能
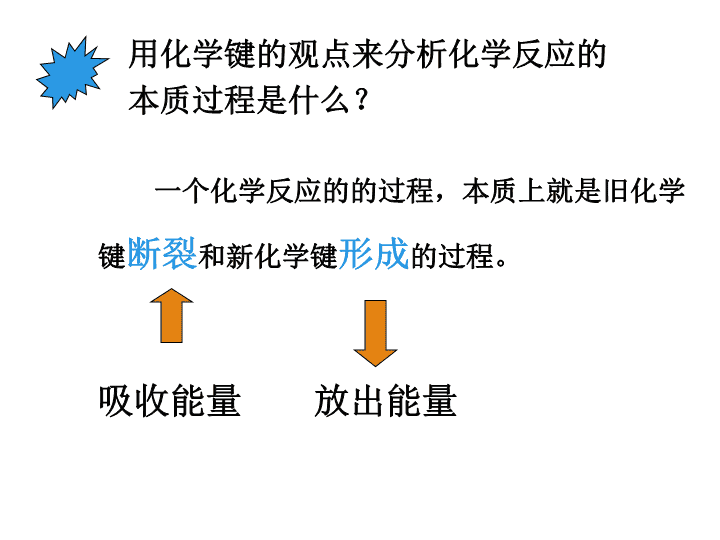
化学能与热能 化学变化的特征: 化学变化中除有新物质生成外, 常伴随着放热、发光、变色、放出 气体、生成沉淀等现象发生。 利用化学反应: 一是制取新物质; 二是利用反应中 的能量. 用化学键的观点来分析化学反应的 本质过程是什么? 一个化学反应的的过程,本质上就是旧化学 键断裂和新化学键形成的过程。 吸收能量 放出能量 一、化学键与化学反应中能量变化的关系 1、当物质发生化学反应时,断开反应物中 的化学键要吸收能量;而形成生成物中 的化学键要放出能量。 例如:断开H-H键要吸收能量。 形成H-H键要放出能量。 2、化学键的断裂和形成是化学反应中能量 变化的主要原因。 ?一个化学反应吸收能量还是放出能量是 由什么决定的呢? 从化学键的观点来分析能量的变化 一个化学反应的的过程,本质上就是旧化学 键断裂和新化学键形成的过程。 吸收能量 放出能量 所以:一个化学反应是否为放热还是吸热取决于什么呢? 取决于所有断键吸收的总能量与所有 形成新键放出的总能量的相对大小 反应物的总能量高 生成物的总能量低 放 出 能 量 生成物的总能量高 反应物的总能量低 决定于反应物的总能量 与生成物的总能量的相 对大小。 化 学 反 应 化 学 反 应 吸 收 能 量 一个化学反应吸收 能量还是放出能量 放 热 吸 热 从整体考虑的角度出发 小结: 能量公式化 E(反应物)=E(生成物)+Q (能量守恒定律) E(反应物)-E(生成物)=Q Q>0为放热反应 Q<0为吸热反应 1、当物质发生化学反应时,断开反应物中 的化学键要 ;而形成生成物中 的化学键要 。一个化学反应是 释放能量还是吸收能量取决于 。 吸收能量 放出能量 反应物总能量与生成物总能量的相对大小 练习: 2、若反应物的总能量>生成物的总能量, 化学反应 能量。 若反应物的总能量<生成物的总能量, 化学反应 能量。 放出 吸收 3、已知反应A+B=C+D为放热反应,对该反应 的下列说法中正确的是( ) A. A的能量一定高于C B. B的能量一定高于D C. A和B的总能量一定高于C和D的总能量 D. 该反应为放热反应,故不必加热就一定 能发生 C 化学能与热能 二、化学能与热能的相互转化 1、化学反应中的能量变化,通常表现为热量 的变化-吸热或放热。 实验2-1 现象 结论 铝与盐酸反应,放出大量气泡, 温度升高 该反应是放热 反应 实验2-2 现象:1、玻璃片(小木板)会与小烧杯粘结在一起 2、有少许刺激性气味气体产生 3、有水生成 Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 +10H2O 玻璃棒的作用:搅拌,使混合物充分接触 反应物成糊状的原因:结冰粘结 结论:该反应是吸热反应 【实验2-3】改为下列两组对比实验。 思考:为什么强酸与强碱发生反应时都会放出热量? 反应物 及用量 HNO3 2 mL 1 mol/L NaOH 2 mL 1 mol/L HCl 2 mL 1 mol/L NaOH 2 mL 1 mol/L 混合前温度 室温室温20。c 混合后温度 t1 t2 结 论 HNO3与NaOH发生 中和反应时放热 HCl与NaOH发生 中和反应时放热 对实验进行 归纳和概括 强酸与强碱发生中和反应时放出热量 酸 碱 思考与交流: 在设计实验装置和操作时应该注意哪些问题? (1)用隔热装置,尽量减少热量散失; (2)酸碱的量要准确:n=C×V a、浓度要越精确越好 b、量体积的容器越精确越好,最好用移液管 (3)温度计越精确越好 (4)注意控制反应时间 (5)多做几次,取平均值 中和热:酸与碱发生中和反应生成1molH2O时 所释放的热量称为中和热 思考: 从能量的角度考虑,你对化学反应有新的认识吗? 1、化学反应的过程,可以看成是能量的 “贮存”或“释放”的过程 2.化学反应实质:化学反应的特点是有新物质生成。 “新”是指物质组成、物质结构、物质所具有的 能量与原反应物不同。 3.化学反应中能量守恒 问题交流【学与问】 这里所列举的两类反应说明了化学反应与热能 之间的辩证关系以及它们之间的相互转化: 化学反应 热能 煤、石油、天然气的燃烧(产生) CaCO3经过高温煅烧分解成CaO(动力) 热能对化学反应的支持作用, 利用热能来完成常温下很难发 生的化学反应。 获取能量 常见的放热反应和吸热反应 放热反应 燃料的燃烧 中 和 反 应 金 属 与 酸 物质氧化 吸热反应 C+CO2 H2+CuO C+H2O Ba(OH)2.8H2O+NH4Cl CaCO3高温分解 练习: 1、下列说法正确的是( ) A.需要加热才能发生的反应一定是吸热反应 B.任何放热反应在常温条件下一定能发生反应 C.反应物和生成物所具有的总能量决定了反应 结果是放热还是吸热 D.吸热反应在一定条件下也能发生反应 CD (2)在反应H2 + Cl2 =2HCl中,已知H-H 键能为436kJ,Cl-Cl键能为247kJ, H-Cl键能为431kJ,判断该反应是( ) A. 吸热反应 B. 放热反应 C. 吸收179kJ热量 D.放出179kJ热量 BD 形成化学键 断开化学键 放出的能量 吸收的能量> 放出能量 形成化学键 断开化学键 放出的能量 吸收的能量 < 吸收能量 练习: 3、甲烷燃烧要放出热量,水的分解要吸收能量, 试从化学键变化的角度分析其原因? 解析: 形成4molH-O键和2molC=O键释放的能量 比断裂4molC-H键和2molO=O键所吸 收的能量高,因此放出热量。 断裂4molH-O键所吸收的能量比形成2mol H-H键和1molO=O键放出的能量高,因此 要吸收能量。 3、氢气在氧气中燃烧产生蓝色火焰,在反应中, 破坏1molH-H键消耗的能量为Q1kJ, 破坏1molO = O键消耗的能量为Q2kJ, 形成1molH-O键释放的能量为Q3kJ。 下列关系式中正确的是( ) A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3 C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3 B 4、 如右图所示,把试管放入盛有25℃时饱 和石灰水的烧杯中,试管中开始放入几小块 镁片,再用滴管滴入5mL盐酸于试管中.试回 答下列问题: (1)实验中观察到的现象是 (2)产生上述现象的原因是 (3)写出有关反应的离子方程式 (4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”)镁片和 盐酸的总能量. 16.6% 2.1% 5.1% 76.2% 我国化石燃料和水电能源消耗构成图查看更多