- 2021-05-28 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第2讲 原电池 化学电源-6原电池的工作原理及其应用
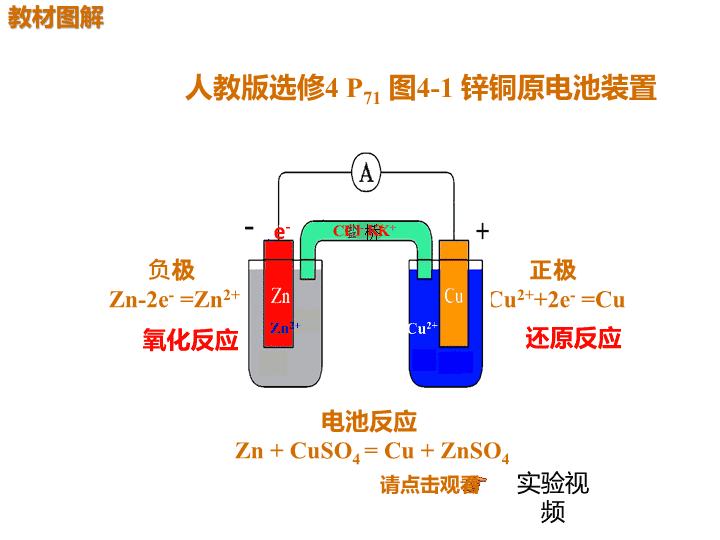
人教版选修4 P71 图4-1 锌铜原电池装置 负极 Zn-2e- =Zn2+ 正极 Cu2++2e- =Cu 电池反应 Zn + CuSO4 = Cu + ZnSO4 氧化反应 还原反应 请点击观看 实验视 频 e- e- Zn2+ Cu2+ K+Cl- 桥K+Cl- 2.(溯源题)(2016·上海化学,8)图1是铜锌原电 池示意图。图2中,x轴表示实验时流入正极的电子的 物质的量,y轴表示 。 ①铜棒的质量 ②c(Zn2+) ③c(H+) ③c (SO42-) ③ 不变 增加 减少 不变 3.用a、b、c、d四种金属按表中所示的装置进行实验, 下列叙述中正确的是( ) A .装置甲中的b金属是原电池的负极 B.装置乙中的c金属是原电池的阴极 C.装置丙中的d金属是原电池的正极 D.四种金属的活泼性顺序:d>a>b>c D 试 题 备 选 — + + 解析 甲中a溶解说明a是负极,活泼性a>b,A错误; 原电池用正极或负极命名电极,B错误,由乙中现 象知活泼性b>c;丙中d是负极,活泼性d>a,C错误; 综上可知D正确。 (2017·广东粤西四校联考)铜锌原电池(如图)工 作时,下列叙述正确的是( ) A.一段时间后,铜棒上有红色物质析出 B.正极反应为:Zn-2e-===Zn2+ C.在外电路中,电流从负极流向正极 D.盐桥中的K+移向ZnSO4溶液 A — + I K+ 解析 Cu为正极,电极反应为Cu2++2e-===Cu, 铜棒上有红色物质析出,A项正确,B项错误;在外 电路中,电流从正极流向负极,C项错误;CuSO4溶 液中c(Cu2+)降低,故盐桥中的K+移向CuSO4溶 液,D项错误。 【试题备选】 正、负极的判断方法 在设计原电池装置时,首先要书写出总氧 化还原反应的离子方程式,确定原电池的 正、负极,再把总反应的离子方程式拆写 成氧化反应(负极反应)和还原反应(正极反 应) 原电池设计程序查看更多