- 2021-05-27 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版化学九下第11单元测试卷
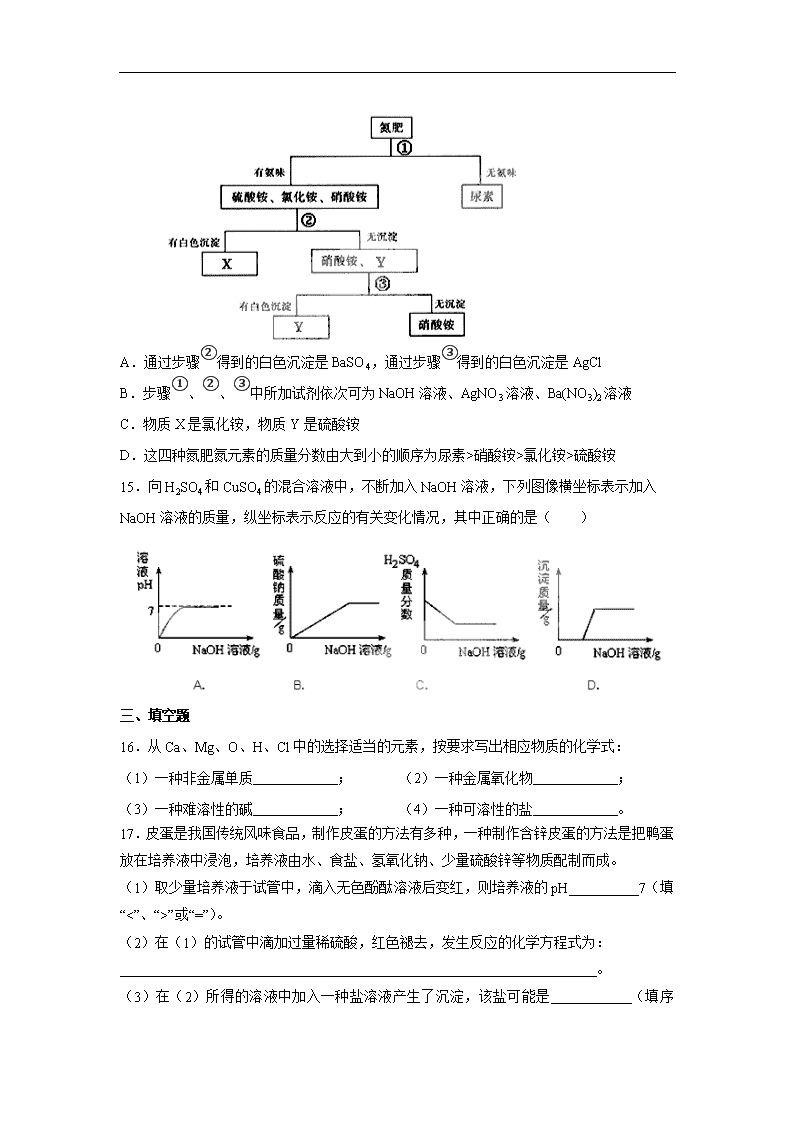
第十一单元测试卷 姓名 班级 学号 一、选择题(每小题只有 1 个选项符合题意。) 1.硫代硫酸钠晶体是一种恒温保温瓶的填充物,硫代硫酸钠(Na2S2O3)属于( ) A.氧化物 B.酸 C.碱 D.盐 2.生活中处处有化学。根据你所学过的化学知识,下列说法不正确...的是( ) A. “请往菜里加点盐”中的“盐”特指食盐——NaCl B.食品工业中,发酵粉的主要成份是小苏打——Na2CO3 C.体温表中的水银不是银,是金属汞 D.生活中常用的铁制品都是铁的合金 3.今年春节前,我省发生了特大冰雪灾害,为确保道路畅通,交通部门使用了大量的氯化 钠融雪剂。下列关于该融雪剂的说法中,不正确...的是( ) A.氯化钠能融雪是因为其溶液的凝固点比水低 B.氯化钠的大量使用会造成地下水污染 C.使用氯化钠融雪,会加快钢铁桥梁的锈蚀 D.使用大量氯化钠融雪,对公路周围农作物的生长无影响 4.下列物质的名称、俗名与化学式完全对应的是( ) A.氯化钠 食盐 NaCl2 B.碳酸氢钠 纯碱 NaHCO3 C.氢氧化钙 熟石灰 CaO D.氢氧化钠 火碱 NaOH 5.做馒头时要在发酵好的面团中加食用碱,以便产生气体使馒头疏松多孔,面团在发酵过 程中产生的物质的酸碱性是( ) A.酸性 B.碱性 C.中性 D.无法判断 6.初中化学教材中“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动。食 盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是( ) ①检验自来水中是否含氯离子 ②鉴别食盐和纯碱 ③检验鸡蛋壳能否溶于酸 ④除去热水 瓶中的水垢 A.①②③④ B.①③ C.②④ D.②③④ 7.只用一种试剂就能将 NaOH、NaCl、BaCl2三种溶液鉴别出来,该试剂是( ) A.CuSO4溶液 B.Na2SO4溶液 C.酚酞试液 D.Fe(NO3)3溶液 8.有 X、Y、Z三种金属,把 Y投入 X(NO3)2溶液中,Y表面有 X析出,把 X投入 Z(NO3)2 溶液中,X表面有 Z析出。X、Y、Z三种金属的活动性由强到弱的顺序是( ) A.Z>Y>X B.Y>X>Z C.X>Y>Z D.X>Z>Y 9.下列物质可用作复合肥料的是 ( ) A.NH4HCO3 B.KNO3 C.Ca3(PO4)2 D.K2SO4 10.在氯化铜溶液中加入一定量的锌和铁,充分反应后得到一些固体。过滤,向固体中加入 少量稀盐酸,有气体放出,则下列叙述中正确的有( ) ①固体中一定含有锌 ②固体中一定没有铜 ③固体中一定含有铁 ④溶质中一定含有氯化锌 ⑤溶质中一定没有氯化亚铁 ⑥溶质中肯定没有氯化铜 A.①③④⑤ B.②④⑥ C.③④⑥ D.③⑤⑥ 二、选择题(每小题有 1~2 个选项符合题意。) 11.下列有关铁及其化合物的转化关系中,不能..实现的是( ) A.Fe 2O Fe3O4 B.Fe2O3 HCl稀 FeCl3 C.Fe(NO3)3 溶液2MgCl FeCl3 D.Fe 42SOH稀 FeSO4 12.能在水中大量共存的一组离子是( ) A.NH4 +、Na+、C1-、SO42 - B.H+、Na+、NO3 -、CO32 - C.K+、Ba2+、OH-、SO42 - D.K+、Ag+、NO3 -、C1- 13.下列选用的除杂试剂和实验操作都正确的是( ) 选项 物质(括号内为杂质) 除杂试剂 操作方法 A. CO2(HCl) 氢氧化钠溶液 气体通过盛有足量氢氧化钠溶液的洗 气瓶 B. NaCl(Na2CO3) 盐酸 加入足量盐酸、蒸发、结晶 C. MnO2(NaCl) 水 加入足量水溶解、过滤、洗涤、干燥 D. Cu(CuO) 氧气 通入足量氧气并加热 14.有硫酸铵、硝酸铵、氯化铵、尿素[CO(NH2)2]四种氮肥,通过如下图所示步骤进行鉴别。 下列说法中正确的是( ) 点燃 A.通过步骤②得到的白色沉淀是 BaSO4,通过步骤③得到的白色沉淀是 AgCl B.步骤①、②、③中所加试剂依次可为 NaOH溶液、AgNO3溶液、Ba(NO3)2溶液 C.物质 X是氯化铵,物质 Y是硫酸铵 D.这四种氮肥氮元素的质量分数由大到小的顺序为尿素>硝酸铵>氯化铵>硫酸铵 15.向 H2SO4和 CuSO4的混合溶液中,不断加入 NaOH溶液,下列图像横坐标表示加入 NaOH 溶液的质量,纵坐标表示反应的有关变化情况,其中正确的是( ) 三、填空题 16.从 Ca、Mg、O、H、Cl中的选择适当的元素,按要求写出相应物质的化学式: (1)一种非金属单质 ; (2)一种金属氧化物 ; (3)一种难溶性的碱 ; (4)一种可溶性的盐 。 17.皮蛋是我国传统风味食品,制作皮蛋的方法有多种,一种制作含锌皮蛋的方法是把鸭蛋 放在培养液中浸泡,培养液由水、食盐、氢氧化钠、少量硫酸锌等物质配制而成。 (1)取少量培养液于试管中,滴入无色酚酞溶液后变红,则培养液的 pH 7(填“<”、 “>”或“=”)。 (2)在(1)的试管中滴加过量稀硫酸,红色褪去,发生反应的化学方程式为: 。 (3)在(2)所得的溶液中加入一种盐溶液产生了沉淀,该盐可能是 (填序号)。 A.BaCl2 B.CuSO4 C.AgNO3 D.KNO3 18.下图是对生成氯化钠反应关系的归纳与整理。 (1)物质 A是常见的碱,写出 A的化学式: 。 (2)写出反应①的化学方程式:_____________________________________。 (3)说出 NaHCO3在医疗上的一种用途:____________________________________。 (4)反应③、④、⑤、⑥能够进行的原因是___________________________________________。 (5)实验室配制 200g 8%的 NaCl 溶液,需要水的质量是___________g,配制过程中为了 加快 NaCl的溶解,可以采取的措施是_________________________________________。 19.食品腌制中会产生亚硝酸盐,因亚硝酸盐易诱发癌症而严重影响人们的健康,有人设想: 先向含有亚硝酸盐(NaNO2为例说明)的腌制食品中加入过量的氯化铵,共热后生成无毒、 无害的氨气、水、和氯化钠;然后再持续加热,使过量的氯化铵分解为氨气、氯化氢气体, 经过这样处理的腌制食品就可放心食用。请写出设想中两个反应的化学方程式: ( 1 ) ; (2) 。 20.已知 A~G七种物质都是初中化学课本中出现过的化合物,其中 F是常用的建筑材料, H为常见的单质,各物质之间存在如下转化关系(反应条件如下图所示)。 (1)写出物质的化学式:B ,E ,F ,D ,蓝 色溶液中的溶质包含 。 (2)写出化学方程式及其所属基本反应类型: ② ,属于 反应。 ③ ,属于 反应。 ④ ,属于 反应。 (3)反应①是分解反应,物质 A中包含的元素有 。 21.以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学 工业的重要支柱之一。由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要 求,因此必须经过精制。以粗盐为原料的“氯碱工业”流程如下: (1)氯气、氢氧化钠在工业上有广泛的用途。下列关于氢氧化钠的描述中,不正确...的 是 。 A.能去除油污,可做厨房清洁剂 B.易溶于水,溶解时放出大量的热 C.水溶液能使石蕊溶液变红 D.可用作某些气体的干燥剂 (2)操作②的名称是 ,该操作所需的玻璃仪器是 ; 操作④的名称是 ,该操作需玻棒不断搅拌,这是为了防止 。 (3)操作①②间除杂质时所加的三种试剂是 NaOH溶液、Na2CO3溶液、BaCl2溶液(均过 量),其顺序要求是:Na2CO3溶液必须在 BaCl2溶液之 (填“前”或“后”)加入。有 同学提出用 溶液代替 BaCl2溶液可达到同样的目的。 (4)电解饱和 NaCl溶液的化学方程式是 。 (5)该流程中可以循环利用的物质是 。 四、计算题 22.在一烧杯中盛有 22.3g Na2CO3和 NaCl组成的固体混合物,加足量水溶解,制成溶液。 向其中逐渐滴加溶质质量分数为 10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量 关系曲线如图所示: (1)当滴加了 73g稀盐酸时,放出气体的总质量为 g。 (2)当滴加稀盐酸至图中 B点时,烧杯中溶液里的溶质是(写化学式) 。 (3)当滴加了 73g稀盐酸时(即 A点时),烧杯中为不饱和溶液,试通过计算求出其中所 含溶质的质量。 五、附加题 23.2005年诺贝尔化学奖授予了三位科学家,以表彰他们在烯烃反应领域研究方面所取得 的成就。下面是他们研究烯烃反应的示意图: 该反应属于四种反应类型中的( ) A.化合反应 B.分解反应 C.置换反应 D.复分解反应 24.一包白色粉末,由 CuSO4、CaCO3、BaCl2、Na2SO4、NaOH 中的两种或两种以上的物 质混合而成。为探究其组成,进行如下实验: (1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液。 则原白色粉末中一定不含有 。 (2)取实验(1)滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气 体。则原白色粉末中一定含有 。 根据上述实验可推断:原白色粉末的组成有 种可能。 为进一步探究原白色粉末的组成,取实验(1)得到的滤液,向其中通入二氧化碳,产生白 色沉淀,则可推断原白色粉末中一定还含有 。 C=C HH R1H C=C HH R2H C=C HH HH C=C HH R2R1 + + 催化剂 参考答案及评分标准 一、选择题(若不完成附加题,每小题 2 分,共 20 分;若完成附加题,每小题 1 分,共 10 分。) 题号 1 2 3 4 5 6 7 8 9 10 答案 D B D D A D A B B C 二、选择题(每小题 2 分,共 10 分。) 题号 11 12 13 14 15 答案 C A BC AD BD 三、填空题(除特别说明外每空 1 分,共 40 分。) 16.(4分)(1)H2、O2或 Cl2 (2)CaO或MgO (3)Mg(OH)2 (4)CaCl2 或MgCl2 17.(3分)(1)> (2)2NaOH+H2SO4===Na2SO4+ 2H2O (3)AC 18.(6分)(1)NaOH (2)2Na+2HCl====2NaCl+H2↑ (3)治疗胃酸过多 (4)因为有水、气体或沉淀生成 (5)184 用玻璃棒不断搅拌 19.(4分)(1)NH4Cl+NaNO2 N2↑+2H2O+NaCl(此空 2 分) (2)NH4Cl NH3↑+2HCl↑ (此空 2 分) 20.(13分)(1)CuO Ca(OH)2 CaCO3 CO2 CuSO4、H2SO4 (2)H2SO4+ CuO=== CuSO4+ H2O 复分解 Fe+CuSO4=Cu+FeSO4,Fe+2HCl =FeCl2+H2↑(此空 2 分,每个方程式 1 分) 置换 CaCO3 高温 CaO+CO2↑ 分解 (3)Cu、C、H、O 21.(10分)(1) C (2) 过滤 普通漏斗、烧杯、玻璃棒 蒸发 局部过热,造 成溶液飞溅 (3)后 Ba(OH)2 (4)2NaCl+2H2O通电 2NaOH+H2↑+ Cl2↑(此空 2 分) (5) NaCl 四、计算题(共 10 分。) 五、附加题(每空 2 分,共 10 分。) 23.(2分)D 24.(8分)(1)CuSO4 (2)CaCO3 5 BaCl2、NaOH查看更多