- 2021-05-27 发布 |
- 37.5 KB |
- 31页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习学案课件(人教版):第6章 化学反应与能量第3节 电解池 金属的电化学腐蚀与防护
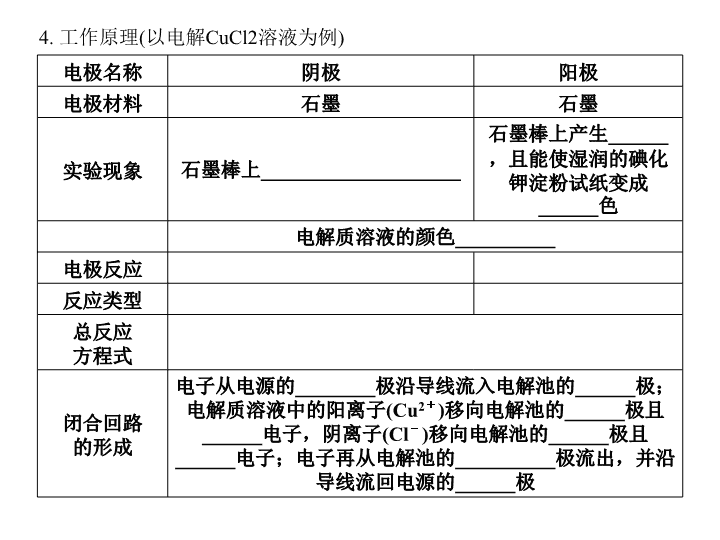
第三节 电解池 金属的电化学腐蚀与防护 一、电解原理 1. 电解:使______通过电解质溶液或熔融电解质而在__________引起 ____________的过程。 2. 电解池:把________转化为________的 装置叫电解池(也叫电解槽)。 3. 电解池的组成 (1)两个导体作电极,与电源正极相连的为 ____极,与电源负极相连的为____极; (2)电解质溶液或熔融电解质; (3)一个直流电源且形成闭合回路。 【想一想】 如何判断一个装置是原电池还是电解池? 【答案】①首先看有无外接电源,有外接电源的为电解池,无外接电源的可 能为原电池。②然后依据原电池的形成条件分析判断。 4. 工作原理(以电解CuCl2溶液为例) 电极名称 阴极 阳极 电极材料 石墨 石墨 实验现象 石墨棒上____________________ 石墨棒上产生______, 且能使湿润的碘化钾 淀粉试纸变成______ 色 电解质溶液的颜色__________ 电极反应 反应类型 总反应 方程式 闭合回路 的形成 电子从电源的________极沿导线流入电解池的______极; 电解质溶液中的阳离子(Cu2+)移向电解池的______极且 ______电子,阴离子(Cl-)移向电解池的______极且 ______电子;电子再从电解池的__________极流出,并 沿导线流回电源的______极 【温馨提示】电解质的电离是电解质溶液导电的前提条件。电解质溶液的 导电过程就是电解质溶液的电解过程。 二、电解原理的应用 1. 电解饱和食盐水 (1)电极反应 阳极:__________;阴极:______________。 (2)总反应方程式:______________________。 (3)应用:氯碱工业制________、______和______。 2. 电镀铜或电解精炼铜 (1)两极材料:待镀金属或纯铜作______,镀层金属或粗铜作____。 (2)电极反应 阳极:__________;阴极:__________。 3. 电解冶炼Na(如电解熔融NaCl获得Na) (1)电极反应 阳极:____________;阴极:____________。 (2)总反应方程式:__________________。 (3)应用:冶炼____________等活泼金属。 【想一想】 电镀铜和电解精炼铜的过程中,电解质溶液中Cu2+的浓度变化吗? 【答案】电镀铜的过程中,Cu2+的浓度基本不变;电解精炼铜的 过程中,Cu2+的浓度逐渐减小。 三、金属的电化学腐蚀与防护 1. 金属腐蚀:金属与周围的气体或液态物质发生________反应而引 起损耗的现象。金属腐蚀一般可分为化学腐蚀和电化学腐蚀。 2. 化学腐蚀和电化学腐蚀的比较 化学腐蚀 电化学腐蚀 条件 金属与______________直接 接触 ____________跟电解质 溶液接触 特点 无电流产生 有微弱电流产生 本质 金属失电子变成金属阳离子而被氧化 (M-ne-===Mn+) 金属被氧化的过程 ________的金属被氧 化的过程 相互 关系 两种腐蚀往往同时发生,但____________更普遍,危害 更严重 3. 电化学腐蚀分类(以钢铁的腐蚀为例) 吸氧腐蚀 析氢腐蚀 条件 水膜呈____________或 __________ 水膜呈 ______ 正极反应 负极反应 总反应 进一步生成 铁锈的反应 相互关系 ______腐蚀更普遍 【想一想】 把纯铁丝放入稀硫酸中放出H2,该过程属于析氢腐蚀吗? 【答案】不属于析氢腐蚀,属于化学腐蚀。 4. 金属的防护方法 (1)电化学防护法 ①牺牲阳极的阴极保护法 在被保护的钢铁设备上装上若干较活泼金属(Zn),让被保护的金属作原电池 的________。 ②外加电流的阴极保护法 用被保护的钢铁设备作______,惰性电极作______,外接直流电源。 (2)其他方法 ①改变金属内部结构,如把金属制成防腐的__________(如不锈钢); ②加涂防护层如__________、________、________、________或________等 方法。 【答案】一、1. 电流 阴、阳两极 氧化还原反应 2. 电能 化学能 3. (1)阳 阴 4. 逐渐覆盖一层红色物质 刺激性气味的气体 蓝 逐渐变浅 Cu2++2e-===Cu 2Cl--2e-===Cl2↑ 还原反应 氧化反应 CuCl2Cu+ Cl2↑ 负 阴 阴 得到 阳 失去 阳 正 二、1. (1)2Cl--2e-===Cl2↑ 2H++2e-===H2↑ (2)2NaCl+2H2O2NaOH+H2↑+Cl2↑ (3)Cl2 H2 NaOH 2. (1)阴极 阳极 (2)Cu-2e-===Cu2+ Cu2++2e-===Cu 3.(1)2Cl--2e-===Cl2↑ 2Na++2e-===2Na (2)2NaCl(熔融)2Na+ Cl2↑ (3)Na、Mg、Al 三、1. 氧化还原 2. 干燥气体或非电解质 不纯金属或合金 较活泼 电化学腐蚀 3. 很弱的酸性 中性 酸性 2H2O+O2+4e-===4OH- 2H++2e-===H2↑ Fe-2e-===Fe2+ 2Fe+O2 +2H2O===2Fe(OH)2 Fe+2H+===Fe2++H2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O 吸 氧 4. (1)①正极 ②阴极 阳极 (2)①合金 ②喷油漆 涂油脂 电镀 喷镀 表面钝 化 电极名称、电极产物的判断及有关反应式的书写 【例1】 (2010高考·海南卷,9)利用电解法可将含有Fe、Zn、Ag、Pt等杂质 的粗铜提纯,下列叙述正确的是( ) A. 电解时以精铜作阳极 B. 电解时阴极发生还原反应 C. 粗铜连接电源负极,其电极反应是Cu===Cu2++2e- D. 电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 【解析】电解精炼铜就是利用电解法将粗铜中的铜提取出来,因此粗铜作阳 极,连接电源正极,电极反应是Cu -2e-===Cu2+ ;精铜作阴极,连接电 源负极,电极反应是Cu2++2e-===Cu。粗铜含有金属活动性比铜弱的少量 Ag、Pt等金属,故Ag、Pt等金属随着粗铜中铜的溶解而沉积在阳极底部,形 成阳极泥。 【答案】BD 1. 电解池电极的判断 2. 2. 电解时电解产物的判断 3. (1)阳极产物的判断:①若阳极是活性电极(除C、Pt、Au以外的金属), 则阳极金属材料失去电子而被氧化成阳离子; 4. ②若阳极是惰性电极(C、Pt、Au),则是电解液中阴离子在阳极失去电 子被氧化。阴离子放电顺序为:S2->I->Br->Cl->OH->含氧酸根。 5. (2)阴极产物的判断:阴极反应一般是溶液中的阳离子得电子的还原反应。 阳离子放电顺序为:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+> Al3+ >Mg2+>Na+>Ca2+>K+。 Fe3+得电子能力大于Cu2+,第一阶段只能被还原为Fe2+。 3. 电解时电极反应式的书写 (1)首先判断电极名称(阴极、阳极)。 (2)其次分析电极材料。判断是电极材料放电还是溶液中的离子放电。 (3)再次分析溶液中的离子种类,根据离子放电顺序,分析电极反应、判断 电极产物,写出电极反应式。 【温馨提示】电解水溶液时,应注意位于放电顺序中H+和OH-之后的离 子一般不放电。 4. 电解总反应方程式的书写 (1)必须注明反应条件:通电或电解。 (2)当电解过程中电解的是水和电解质时,电极反应式中出现的是H+或OH -放电,但在书写电解总反应方程式时要将反应物中的H+或OH-均换成 水,在生成物中出现的是碱或酸。 【知识关联】与氧化还原反应、原电池等知识联系。 1. 右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极 a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( ) A. 逸出气体的体积:a电极的小于b电极的 B. 一电极逸出无味气体,另一电极逸出刺激性气味气体 C. a电极的电极反应式为4OH--4e-===2H2O+O2↑ D. a电极附近呈蓝色,b电极附近呈红色 【解析】用惰性石墨电极通直流电电解稀Na2SO4水溶液实际是电解 水。根据电解原理,a极:2H++2e-===H2↑,该电极附近的溶液 中剩余OH-,显碱性,故该极附近石蕊试液呈蓝色;b极:4OH- -4e-===2H2O+O2↑,该电极附近的溶液中剩余H+,显酸性,该 极附近呈红色。 【答案】D 惰性电极电解电解质溶液的规律 【例2】 (2011·山东济宁一中期末)如下图所示的装置,C、D、E、F都是惰 性电极。将电源接通后,向乙装置的溶液中滴入酚酞溶液,在E极附近显红 色。则以下说法不正确的是( ) A. 电源B极是正极 B. 甲、乙装置的C、D、E、F电极 均有单质生成,其物质的量比为 1∶ 2∶ 2∶ 2 C. 欲用丙装置给铜镀银,H应该是Ag, 电镀液选择AgNO3溶液 D. 甲装置中D电极附近溶液的pH变小 【解析】乙装置E极附近的溶液遇酚酞显红色,说明E极是电解池的阴极,C、 G也为电解池的阴极;A是电源的负极,B是电源的正极;D、F、H是电解池 的阳极。C、D、E、F电极生成的单质分别为Cu、O2、H2、Cl2,其物质的 量比为2∶ 1∶ 2∶ 2 。用丙装置给铜镀银,则G电极反应式为:Ag++e- ===Ag ,H电极反应式为:Ag-e-===Ag+。 【答案】B 【温馨提示】①若阴极为H+放电,则阴极区c(OH-)增大;若阳极 为OH-放电,则阳极区c(H+)增大。②用惰性电极电解电解质溶液 时,若要使电解后的溶液恢复到原状态,应遵循“缺什么加什么,缺 多少加多少”的原则。一般加入阴极产物与阳极产物(按方程式对应 系数确定的比例)的化合物。 2. (2010·福建泉州一中期中)用铂电极(惰性)电解下列溶液时,阴极和阳极 上的主要产物分别是H2和O2的是( ) A. 稀NaOH溶液 B. HCl溶液 C. NaCl溶液 D. 酸性AgNO3溶液 【解析】根据用惰性电极电解电解质溶液的类型可知,电解稀NaOH溶液 属于电解水型,阴极和阳极的产物分别是H2和O2,A正确。B中生成的气 体是H2和Cl2,C中生成的气体是H2和Cl2,D中生成的气体只有O2。 【答案】A 电解池的有关计算 【例3】 用两支惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液 的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积 变化可以忽略),电极上应析出银的质量是( ) A. 27 mg B. 54 mg C. 108 mg D. 216 mg 【解析】首先写出电极反应方程式,阳极:4OH--4e-===2H2O+O2↑ 阴 极:4Ag++4e-===4Ag。根据电子守恒建立关系式:4H+~4OH-~4e -~4Ag,物质的量关系为:n(e-)=n(H+)=n(Ag);所以,m(Ag)= n(Ag)×108 g/ mol=0.5 L×10-3 mol/L×108 g/mol×103mg·g-1=54 mg 【答案】B 1. 电解池有关计算的类型 主要包括:根据直流电源提供的电量求产物的量(析出固体的质量、 产生气体的体积等)、溶液的pH、相对原子质量或元素的化合价、 化学式等。 2. 解题方法:电子守恒法、总离子方程式法、关系式法、差量法等。 3. 电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( ) A. 0.10 mol/L Ag+ B. 0.02 mol/L Zn2+ C. 0.20 mol/L Cu2+ D. 0.20 mol/L Pb2+ 【解析】根据离子的放电顺序可知,当电路中通过0.04 mol的电子时, 能析出金属的只有选项A和C,根据Ag++e-===Ag和Cu2++2e- ===Cu可知分别析出0.01 mol的Ag和0.02 mol的Cu,其质量分别为1.08 g和1.28 g。 【答案】C 金属的电化学腐蚀与防护 【例4】 (2010高考·北京卷,6)下列有关钢铁腐蚀与防护的说法正确 的是( ) A. 钢管与电源正极连接,钢管可被保护 B. 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 C. 钢管与铜管露天堆放在一起,钢管不易被腐蚀 D. 钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+ 【解析】根据外加电流的阴极保护法,钢管必须接在电源的负极上才 能被保护,A错。钢管是铁与碳的合金,而铁与铜构成原电池时,铁做 负极被腐蚀,C错。钢铁发生析氢腐蚀时,负极反应是Fe-2e- ===Fe2+,D错。 【答案】B 影响金属腐蚀快慢的因素 1. 与构成原电池的电极材料有关。两电极材料的活动性差距越大, 氧化还原反应的速率就越快,活泼金属被腐蚀的速度就越快。一般地, 金属腐蚀的快慢顺序为:电解池的阳极>原电池的负极>化学腐蚀>有 防护措施的腐蚀。 2. 与金属所接触的电解质的强弱有关。同一种金属在相同浓度的不 同电解质中的腐蚀快慢顺序为:强电解质>弱电解质>非电解质。 4. 如图所示烧杯中试管内有一枚铁钉,放置数天观察: (1)铁钉逐渐生锈,则铁钉的腐蚀属于________腐蚀。 (2)若试管内液面上升,则原溶液呈________性,发生 ________腐蚀,负极电极反应:____________, 正极电极反应:_________________。 (3)若试管内液面下降,则原溶液呈________性,发生______腐蚀,负极 电极反应:________________,正极电极反应:________________。 【解析】根据金属腐蚀的条件、原理及实验结果可知:试管内液面上升, 说明试管内压强减小,气体被吸收所致,则铁钉发生了吸氧腐蚀;试管 内液面下降,说明试管内气体压强变大,试管内产生了新气体所致,即 铁钉发生了析氢腐蚀。 【答案】(1)电化学 (2)弱酸性或中 吸氧 2Fe-4e-===2Fe2+ O2+4e-+2H2O===4OH- (3)较强的酸 析氢 Fe-2e-===Fe2+ 2H++2e-===H2↑ 1. (2009高考·广东理科基础卷,25)钢铁生锈过程发生如下反应: 2. ① 2 F e + O 2 + 2 H 2 O = = = 2 F e ( O H ) 2 ;② 4 F e ( O H ) 2 + O 2 + 2H2O===4Fe(OH)3;③2Fe(OH)3===Fe2O3+3H2O。下列说法正确的是 ( ) 3. A. 反应①、②中电子转移数目相等 4. B. 反应①中氧化剂是氧气和水 5. C. 与铜质水龙头连接处的钢质水管不易发生腐蚀 6. D. 钢铁在潮湿的空气中不能发生电化学腐蚀 7. 【解析】本题考查钢铁的腐蚀。①②反应中消耗O2的量相等,两个反应 也仅有O2作为氧化剂,故转移电子数是相等的,A项正确。①中H2O的 H、O两元素的化合价没有变,故不作氧化剂,B项错;铜和钢构成原电 池,腐蚀速度加快,C项错;钢铁是铁和碳的混合物,在潮湿的空气中 易发生吸氧腐蚀,属于电化学腐蚀,故D项错。 8. 【答案】A 3. 用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3mol的 OH-放电时,溶液显浅蓝色,则下列叙述正确的是( ) A. 阳极上析出3.6 mL O2(标准状况) B. 阴极上析出32 mg Cu C. 阴极上析出11.2 mL H2(标准状况) D. 阳极和阴极质量都无变化 【解析】本题考查电解的有关计算。用惰性电极电解CuSO4溶液时,阴 极的电极反应为:2Cu2++4e-===2Cu,阳极的电极反应为:4OH-- 4e-===O2↑+2H2O。当有1×10-3 mol的OH-放电时,生成标准状况 下的O2为5.6 mL,此时转移电子数为1×10-3 mol,则在阴极上析出32 mg Cu。 【答案】B 4. (2010高考·新课标卷,26(2)) 利用电解可提纯Cu,在该电解反应 中阳极物质是________,阴极物质是________,电解质溶液是 ________。 【解析】电解提纯Cu的方法是将粗铜作为电解池的阳极,精铜作 为电解池的阴极,一般用CuSO4溶液作电解质溶液。 【答案】粗铜 精铜 CuSO4溶液 5. (2010高考·全国卷Ⅱ,29)下图是一个用铂丝作电极,电解稀的MgSO4溶 液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变 色范围:6.8~8.0,酸色:红色,碱色:黄色)回答下列问题: (1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是________(填 编号); ①A管溶液由红变黄 ②B管溶液由红变黄 ③A管溶液不变色 ④B管溶液不变色 (2)写出A管中发生反应的反应式:______________________________; (3)写出B管中发生反应的反应式:_________________ ____________; (4)检验a管中气体的方法是_____________________________________; (5)检验b管中气体的方法是 _________________________________; (6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是 __________________________________________________________________ _______________________________。 【解析】本题考查电解原理、电极反应式的书写和H2、O2的检验方法。 (1)由于MgSO4是强酸弱碱盐,在水溶液中存在Mg2++2H2O Mg(OH)2+2H+水解平衡,因此水溶液呈酸性,电解前A、B管均显红 色。在A管溶液中,铂丝做阴极,电解池中阴离子在阳极发生氧化反应, 阳离子在阴极发生还原反应,由于H+的氧化性大于Mg2+的氧化性, H+先得电子被还原为H2,Mg2+与剩余的OH-生成Mg(OH)2沉淀, 酸性减弱,随着水的电解,OH-浓度增大,颜色由红变黄。而在B管 溶液中铂丝作阳极,OH-的还原性大于SO,OH-失电子,随着电解 的进行,酸性增大,溶液不变色(始终为红色)。 (2)由(1)可知,在A管中发生: 2H++2e-===H2↑(或2H2O+2e-===2OH-+H2↑) Mg2++ 2OH-===Mg(OH)2↓ (3)由(1)可知在B管中发生: 4OH--4e-===2H2O+O2↑(或2H2O-4e-===4H++O2↑) (4)H2的常用检验方法是“爆鸣”法,即用拇指按住试管口,取出 试管a,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰。 (5)O2的常用检验方法是木条复燃法,用拇指按住试管口,取出试 管b,放开拇指,将带有火星的木条伸入试管内,木条复燃。 (6)电解一段时间后,将电解液倒入烧杯内,由于两极产生的H+和 OH-[后生成Mg(OH)2]恰好中和,故溶液基本恢复电解前状态 (MgSO4浓度增大),故溶液仍显红色,同时白色的Mg(OH)2沉淀溶 解。 【答案】(1)①④ (2)2H++2e-===H2↑(或2H2O+2e-===2OH-+H2 ↑)、Mg2++ 2OH -===Mg(OH)2↓ (3)4OH--4e-===2H2O+O2↑(或2H2O-4e-===4H++O2↑) (4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有 蓝色火焰 (5)用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内 会复燃 (6)溶液呈红色,白色沉淀溶解查看更多