- 2021-05-27 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习鲁科版3-专项突破(八)氨气的实验室制法及性质探究教案
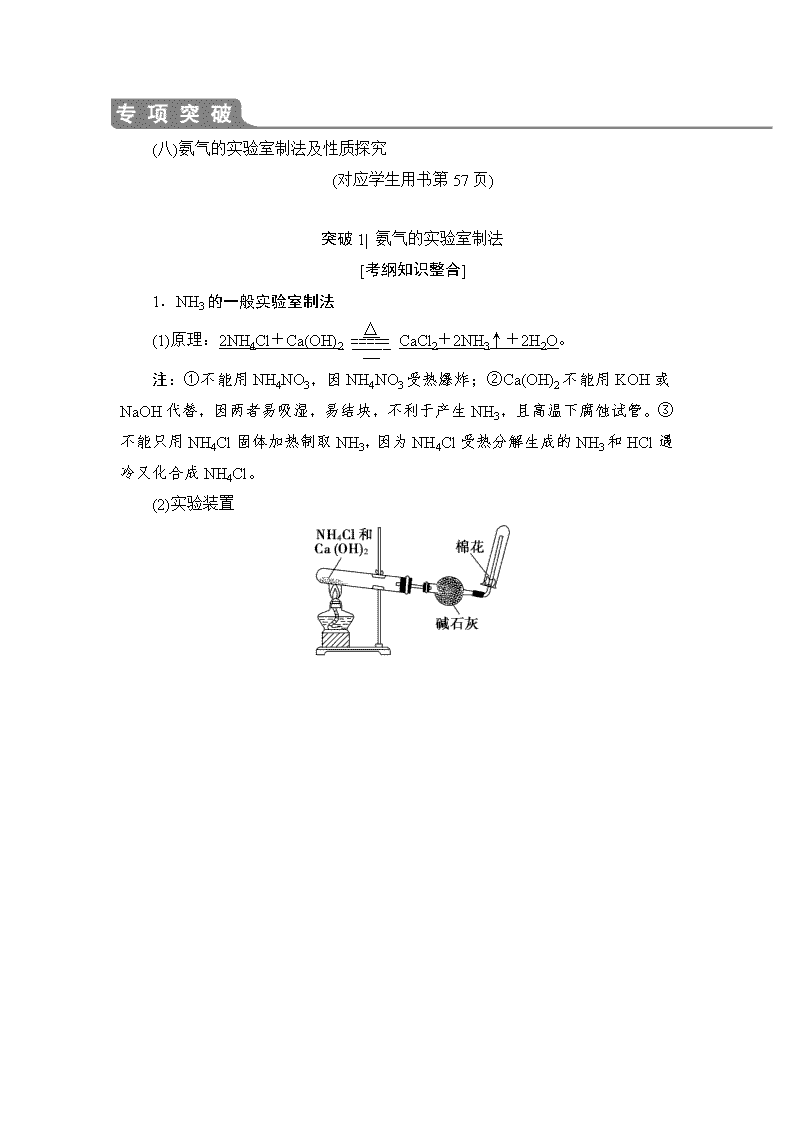
(八)氨气的实验室制法及性质探究 (对应学生用书第57页) 突破1| 氨气的实验室制法 [考纲知识整合] 1.NH3的一般实验室制法 (1)原理:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。 注:①不能用NH4NO3,因NH4NO3受热爆炸;②Ca(OH)2不能用KOH或NaOH代替,因两者易吸湿,易结块,不利于产生NH3,且高温下腐蚀试管。③不能只用NH4Cl固体加热制取NH3,因为NH4Cl受热分解生成的NH3和HCl遇冷又化合成NH4Cl。 (2)实验装置 2.两种简易方法 (1)加热浓氨水:(见图1) 反应原理:NH3·H2ONH3↑+H2O。 图1 图2 (2)浓氨水中加入固态碱性物质:(见图2) 反应原理:浓氨水中存在以下平衡:NH3+H2ONH3·H2ONH +OH-,加入固态碱性物质(如CaO、NaOH、碱石灰等),使平衡逆向移动,同时反应放热,促进NH3·H2O的分解。加CaO的化学方程式为NH3·H2O+CaO===NH3↑+Ca(OH)2。 [高考命题点突破] 命题点 NH3的制取、除杂、收集和尾气处理 1.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( ) A.①② B.②③ C.③④ D.①③ D [NH4Cl受热可产生NH3和HCl,但两者遇冷会重新凝结产生NH4Cl,且可能出现堵塞导管的情况,③中试管口未向下倾斜会导致水倒流入试管底部而使试管破裂,故①③符合题意。] 2.下列装置用于实验室中制取干燥氨气的实验,能达到实验目的的是( ) 【导学号:95160057】 A.用装置甲收集,检验氨气 B.用装置乙除去氨气中少量水蒸气 C.用装置丙收集氨气 D.用装置丁吸收多余的氨气 D [检验氨气用湿润红色石蕊试纸变蓝,A项错误;氨气和浓硫酸反应生成硫酸铵,不能用浓硫酸干燥氨气,B项错误;收集氨气的烧瓶不应密闭,C项错误;氨气极易溶于水,用水吸收氨气时要注意防倒吸,可用丁装置,D项正确。] 突破2| 以氨气的制备为载体的性质探究 [考纲知识整合] 常见的几种NH3的性质探究 1.NH3溶于水形成溶液的碱性探究。 2.NH3的催化氧化产物的探究。 3.NH3与CuO、NO2、NO的反应原理及产物探究。 ①2NH3+3CuO3Cu+N2+3H2O ②8NH3+6NO27N2+12H2O ③4NH3+6NO5N2+6H2O 4.NH3与酸反应的现象探究。 NH3与挥发性酸反应会产生白烟。 5.NH3与Cl2的反应原理及产物探究。 8NH3+3Cl2===N2+6NH4Cl。 [高考命题点突破] 命题点 以NH3制备为载体的性质探究 1.(2018·南通调研)下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是( ) A.用装置甲制取氨气 B.用装置乙除去氨气中的水蒸气 C.用装置丙验证氨气具有还原性 D.用装置丁吸收尾气 C [A项,用装置甲制取氨气需要加热,错误。B项,氨气与浓硫酸反应生成硫酸铵,错误。C项,氨气与氧化铜在加热条件下反应生成N2、水和铜,可以验证氨气具有还原性,正确。D项,用装置丁吸收尾气容易引起倒吸,错误。] 2.硅单质及其化合物应用范围很广。请回答下列问题: (1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: ①写出由纯SiHCl3制备高纯硅的化学反应方程式:_______________ _____________________________________________________________。 ②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:______________________ _____________________________________________________________; H2还原SiHCl3过程中若混有O2,可能引起的后果是________________ _____________________________________________________________。 (2)化学研究性学习小组在探究硅的制取方法时,从资料查阅到下列信息: Ⅰ.Mg在高温条件下可与SiO2反应; Ⅱ.金属硅化物与稀H2SO4反应生成硫酸盐和SiH4; Ⅲ.SiH4在空气中自燃 他们根据信息进行实验,当用足量稀H2SO4溶解第Ⅰ步实验获得的固体产物时,发现有爆鸣声和火花;然后过滤、洗涤、干燥;最后称量、计算,测得其产率只有预期值的63%左右。 ①第Ⅰ步实验发生反应的化学方程式是_______________________ _____________________________________________________________。 ②用稀H2SO4溶解第Ⅰ步实验获得固体产物时,产生爆鸣声和火花的原因是_____________________________________________________________ _____________________________________________________________。 【解析】 在SiHCl3中,把硅考虑为+4价,则氢为-1价,氯为-1价,SiHCl3水解时,-1价氢还原水中+1价的氢,生成氢气。 【答案】 (1)①SiHCl3+H2Si+3HCl ②SiHCl3+3H2O===H2SiO3↓+H2↑+3HCl 高温下,H2遇O2发生爆炸 (2)①2Mg+SiO22MgO+Si、2Mg+SiMg2Si ②硅化镁与稀硫酸反应生成的SiH4可自燃,即发生反应Mg2Si+2H2SO4===2MgSO4+SiH4↑,SiH4+2O2===SiO2+2H2O查看更多