- 2021-05-26 发布 |
- 37.5 KB |
- 20页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高中化学非金属及其化合物 课后提分训练
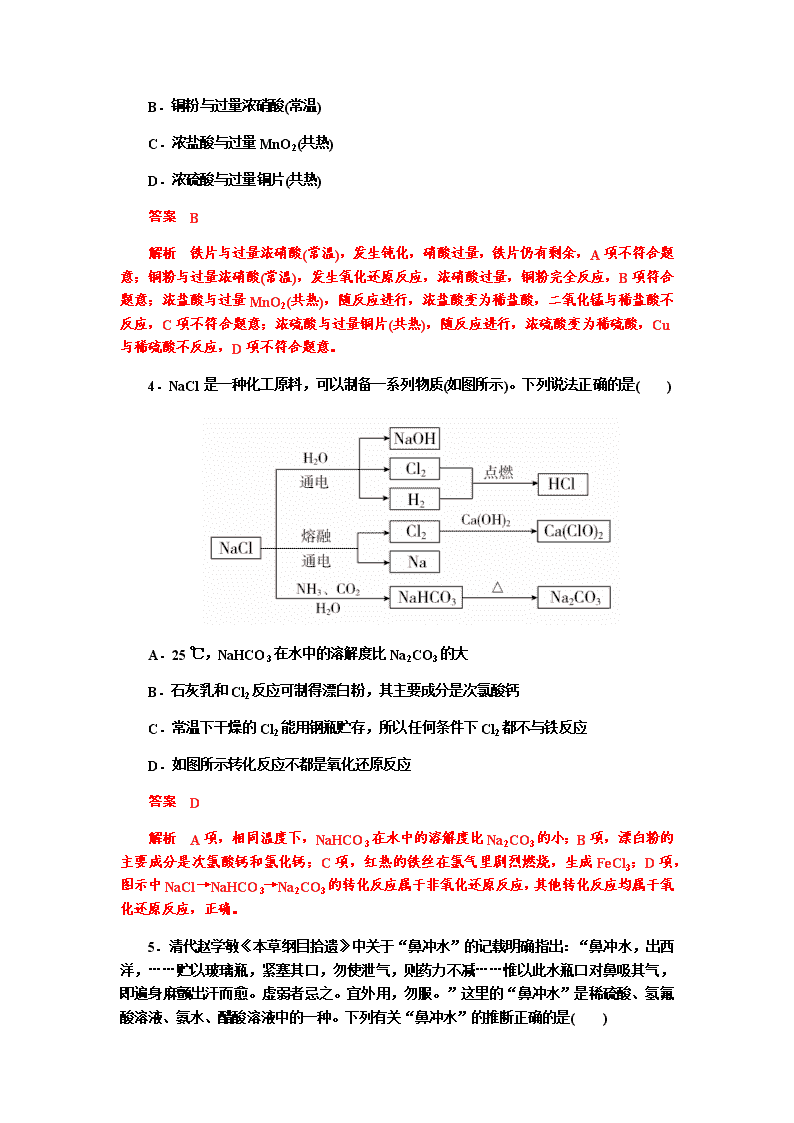
非金属及其化合物 课后提分训练 测试时间:90 分钟 满分:100 分 第Ⅰ卷(选择题,共 50 分) 一、选择题(本大题共 25 小题,每小题 2 分,共 50 分。每小题只有一个选项符合要求) 1.化学与生产和生活密切相关。下列过程中没有发生化学变化的是( ) A.氯气作水的杀菌消毒剂 B.硅胶作袋装食品的干燥剂 C.二氧化硫作纸浆的漂白剂 D.肥皂水作蚊虫叮咬处的清洗剂 答案 B 解析 氯气作水的杀菌消毒剂是利用氯气与水反应生成的次氯酸的强氧化性,发生了 化学变化;硅胶作袋装食品的干燥剂,是因为硅胶疏松多孔,具有吸收水分的作用,没有 发生化学变化;二氧化硫作纸浆的漂白剂是因为二氧化硫可与某些有色物质发生化学反应 生成不稳定的无色物质;肥皂的主要成分为高级脂肪酸钠,肥皂水作蚊虫叮咬处的清洗剂 是利用高级脂肪酸钠在水中发生水解反应使溶液呈碱性的性质,发生了化学变化。 2.下列有关物质性质、用途说法正确的是( ) A.晶体 SiO2 可以导电,可用作光导纤维 B.Na2CO3 能与盐酸反应,可用于治疗胃酸过多 C.氧化铝熔点高,可用作耐火坩埚熔融 Na2CO3 固体 D.液氨汽化时吸收大量的热,可用作制冷剂 答案 D 解析 晶体 SiO2 可用作光导纤维,但 SiO2 不导电,A 项错误;Na2CO3 能与盐酸反应, 但碱性较强,不能用于治疗胃酸过多,B 项错误;氧化铝熔点高,可用作耐火坩埚,但不 能熔融 Na2CO3 固体,Al2O3 与 Na2CO3 在高温时反应,C 项错误。 3.化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不 存在此类情况的是( ) A.铁片与过量浓硝酸(常温) B.铜粉与过量浓硝酸(常温) C.浓盐酸与过量 MnO2(共热) D.浓硫酸与过量铜片(共热) 答案 B 解析 铁片与过量浓硝酸(常温),发生钝化,硝酸过量,铁片仍有剩余,A 项不符合题 意;铜粉与过量浓硝酸(常温),发生氧化还原反应,浓硝酸过量,铜粉完全反应,B 项符合 题意;浓盐酸与过量 MnO2(共热),随反应进行,浓盐酸变为稀盐酸,二氧化锰与稀盐酸不 反应,C 项不符合题意;浓硫酸与过量铜片(共热),随反应进行,浓硫酸变为稀硫酸,Cu 与稀硫酸不反应,D 项不符合题意。 4.NaCl 是一种化工原料,可以制备一系列物质(如图所示)。下列说法正确的是( ) A.25 ℃,NaHCO3 在水中的溶解度比 Na2CO3 的大 B.石灰乳和 Cl2 反应可制得漂白粉,其主要成分是次氯酸钙 C.常温下干燥的 Cl2 能用钢瓶贮存,所以任何条件下 Cl2 都不与铁反应 D.如图所示转化反应不都是氧化还原反应 答案 D 解析 A 项,相同温度下,NaHCO3 在水中的溶解度比 Na2CO3 的小;B 项,漂白粉的 主要成分是次氯酸钙和氯化钙;C 项,红热的铁丝在氯气里剧烈燃烧,生成 FeCl3;D 项, 图示中 NaCl→NaHCO3→Na2CO3 的转化反应属于非氧化还原反应,其他转化反应均属于氧 化还原反应,正确。 5.清代赵学敏《本草纲目拾遗》中关于“鼻冲水”的记载明确指出:“鼻冲水,出西 洋,……贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减……惟以此水瓶口对鼻吸其气, 即遍身麻颤出汗而愈。虚弱者忌之。宜外用,勿服。”这里的“鼻冲水”是稀硫酸、氢氟 酸溶液、氨水、醋酸溶液中的一种。下列有关“鼻冲水”的推断正确的是( ) A.“鼻冲水”滴入酚酞溶液中,溶液不变色 B.“鼻冲水”中含有 5 种粒子 C.“鼻冲水”是弱电解质 D.“鼻冲水”不能使二氧化硅溶解 答案 D 解析 “鼻冲水”易挥发、不可服用、可贮存在玻璃瓶中,故“鼻冲水”为氨水,氨 水中存在平衡:NH3+H2O⇌ NH3·H2O⇌ NH+ 4 +OH-,H2O⇌ H++OH-,溶液呈碱性,能 使酚酞溶液变红色,A 项错误;氨水中存在粒子:NH3、H2O、NH3·H2O、H+、NH+ 4 、OH -,B 项错误;氨水是混合物,NH3·H2O 是弱电解质,C 项错误;氨水不能使二氧化硅溶解, D 项正确。 6.下列处理不当的是( ) A.氯气泄漏时,用湿毛巾捂住嘴鼻往高处跑 B.NH3 泄漏时,向空中喷洒水雾 C.钾、钠着火时,用大量水灭火 D.湖水被酸雨污染,向湖水中喷撒石灰石粉末 答案 C 解析 氯气的密度比空气大,氯气泄漏时,应该用湿毛巾捂住嘴鼻往高处跑,A 项正 确;氨气极易溶于水,氨气泄漏时,应该向空中喷洒水雾,B 项正确;钾、钠均能与水反 应,着火时,应该用沙土盖灭,C 项错误;湖水被酸雨污染,向湖水中喷撒石灰石粉末, 可以减弱湖水的酸性,D 项正确。 7.汉紫是出土文物兵马俑所使用的一种颜料,其成分为硅酸铜钡(BaCuSi2O6)。下列有 关汉紫的说法中正确的是( ) A.硅酸铜钡是硅酸铜和硅酸钡的混合物 B.汉紫中 Cu 的化合价为+1 C.可以写作 BaO·CuO·SiO2 的形式 D.性质稳定,不易褪色 答案 D 解析 BaCuSi2O6 是纯净物,A 项错误;由化合物中各元素化合价代数和为 0 知, BaCuSi2O6 中 Cu 的化合价为+2,B 项错误;BaCuSi2O6 可以写作 BaO·CuO·2SiO2 的形式, C 项错误;汉紫是出土文物兵马俑所使用的一种颜料,可见其性质稳定,不易褪色,D 项 正确。 8.甲、乙、丙三种物质有如图转化关系: 甲 ――→ NaOH 溶液 乙――→ 盐酸 丙――→ △ 甲,则甲不可能是( ) A.Al2O3 B.NH4Cl C.CO2 D.SiO2 答案 B 解析 A 项,若甲为氧化铝,则氧化铝与氢氧化钠溶液反应生成偏铝酸钠(乙),偏铝酸 钠与适量盐酸反应生成氢氧化铝(丙),灼烧氢氧化铝可得氧化铝;B 项,若甲为氯化铵,则 氯化铵与氢氧化钠溶液反应后生成一水合氨(乙),一水合氨与盐酸反应又生成氯化铵(甲), 不符合题图转化关系;C 项,若甲为二氧化碳,则二氧化碳与足量氢氧化钠溶液反应生成 碳酸钠(乙),碳酸钠中加入少量盐酸,可生成碳酸氢钠(丙),加热碳酸氢钠可得到二氧化碳; D 项,若甲为二氧化硅,则二氧化硅与氢氧化钠溶液反应生成硅酸钠(乙),硅酸钠中加入盐 酸可得硅酸(丙),加热硅酸可得二氧化硅。综上分析,本题选 B。 9.下列关于氮及其化合物的说法错误的是( ) A.所有的铵盐都能与烧碱共热生成氨气 B.浓硝酸不论与铜反应还是与碳反应,均体现其酸性和强氧化性 C.一氧化氮结合血红蛋白的能力比一氧化碳还强,更容易造成人体缺氧 D.把带火星的木条伸入充满 NO2 和 O2 混合气体(NO2 和 O2 的物质的量之比为 4∶1) 的集气瓶中,木条复燃,说明 NO2 支持燃烧 答案 B 解析 铵盐与烧碱共热时均能生成氨气,A 项正确;浓硝酸与碳的反应中,浓硝酸只 体现强氧化性,B 项错误;NO 结合血红蛋白的能力比 CO 强,更容易造成人体缺氧,C 项 正确;带火星的木条在空气中不能复燃,但伸入 NO2 和 O2 的混合气体中复燃,说明 NO2 支持燃烧,D 项正确。 10.化学与生产、生活、社会密切相关。下列说法正确的是( ) A.漂白粉长期放置在空气中会被空气中的氧气氧化而变质 B.二氧化硫可用作葡萄酒的食品添加剂 C.通讯领域中的光导纤维可长期浸泡在强碱性溶液中 D.汽车尾气中含有的氮氧化物是汽油不完全燃烧生成的 答案 B 解析 漂白粉与空气中的 CO2 和 H2O 反应生成 CaCO3 和 HClO,不是被空气中的氧气 氧化而变质,A 项错误;二氧化硫可用作葡萄酒的食品添加剂,B 项正确;光导纤维的主要 成分是 SiO2,其会与强碱性溶液反应,C 项错误;汽油是烃的混合物,不含氮元素,D 项 错误。 11.根据下列实验操作和现象得出的结论正确的是( ) 选项 实验操作 现象 结论 A 将某溶液与稀盐酸反应产生的气体 通入澄清石灰水 石灰水变浑 浊 该溶液中一定含有 CO2- 3 B 常温下,将铁片浸入足量浓硫酸中 铁片不溶解 常温下,铁与浓硫酸一定没有发 生化学反应 C 向某食盐溶液中滴加淀粉溶液 溶液颜色不 变 该食盐中一定没有添加 KIO3 D 向苯酚钠溶液中滴加乙酸溶液 溶液变浑浊 相同条件下,乙酸的酸性一定比 苯酚强 答案 D 解析 A 项忽视了 HCO- 3 、HSO - 3 和 SO 2- 3 的干扰,错误;常温下铁遇浓硫酸发生钝化, 其实质是铁表面部分被氧化为致密的氧化膜,阻止了反应的进一步进行,不能说明铁与浓 硫酸没有发生化学反应,B 项错误;KIO3 遇淀粉不变蓝色,只有单质碘遇淀粉才变蓝色, C 项错误;向苯酚钠溶液中滴加乙酸,溶液变浑浊,是因为生成了苯酚,常温下苯酚在水 中溶解度较小,说明乙酸的酸性强于苯酚,D 项正确。 12.实验室中一瓶固体 M 的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图 所示)。已知固体 M 只可能是 Na2S、Na2SO3、Na2SiO3、Na2SO4 中的一种。若取少量固体 M 配成稀溶液进行有关实验,下列说法不正确的是( ) A.只用盐酸一种试剂就可以确定该固体 M 的成分 B.往溶液中通入二氧化碳,若有白色沉淀生成,则固体 M 为 Na2SiO3 C.常温时用 pH 试纸检验,若 pH=7,则固体 M 一定是 Na2SO4 D.往溶液中加入稀硝酸酸化的 BaCl2 溶液,若有白色沉淀生成,则固体 M 为 Na2SO4 答案 D 解析 盐酸与 Na2S 反应生成具有臭鸡蛋气味的 H2S,盐酸与 Na2SO3 反应生成有刺激 性气味的 SO2 气体,盐酸与 Na2SiO3 反应生成白色沉淀 H2SiO3,盐酸与 Na2SO4 不反应,A 项正确;往溶液中通入 CO2,由于 Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,且 CO2 与 另外三种物质不反应,故 B 项正确;Na2S、Na2SO3、Na2SiO3 都属于强碱弱酸盐,水溶液 呈碱性,Na2SO4 为强碱强酸盐,水溶液呈中性,C 项正确;加入硝酸酸化的 BaCl2 溶液, 硝酸能把 Na2SO3 氧化为 Na2SO4,Na2SO4 与 BaCl2 反应得到白色沉淀,固体 M 也可能是 Na2SO3,D 项错误。 13.在给定条件下,下列选项所示的物质间转化均能实现的是( ) A.SiO2 ――→ HClaq SiCl4――→ H2 高温 Si B.FeS2――→ O2 煅烧 SO2――→ H2O H2SO4 C.N2 ――→ H2 高温、高压、催化剂NH3 ――→ HClaq NH4Cl(aq) D.MgCO3 ――→ HClaq MgCl2(aq)――→ 电解 Mg 答案 C 解析 A 项,SiO2 不与 HCl 反应,错误;B 项,SO2 与 H2O 反应生成 H2SO3,错误; D 项,制备 Mg,应电解熔融的 MgCl2,而电解 MgCl2 溶液得不到 Mg,错误。 14.甲、乙是两种常见的化合物,X、Y、Z 是三种常见的单质。下表所列各组物质之 间通过一步反应不能实现如图所示转化的是( ) 选项 X Y Z 甲 乙 A C H2 O2 H2O CO B Zn Fe Cl2 FeCl2 ZnCl2 C Mg C O2 CO2 MgO D H2 Si Cl2 SiCl4 HCl 答案 B 解析 C+H2O===== 高温 CO+H2、2C+O2===== 点燃 2CO、2H2+O2===== 点燃 2H2O,A 项可以; Zn + FeCl2===ZnCl2 + Fe 、 Zn + Cl2 ===== 点燃 ZnCl2 , 但 Fe 与 Cl2 发 生 反 应 : 2Fe + 3Cl2===== 点燃 2FeCl3,B 项不可以;2Mg+CO2===== △ 2MgO+C、2Mg+O2===== △ 2MgO、C+ O2===== 点燃 CO2,C 项可以;2H2+SiCl4===== △ Si+4HCl、H2+Cl2===== 点燃 2HCl、Si+2Cl2===== 点燃 SiCl4, D 项可以。 15.海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过 程。 下列有关说法正确的是( ) A.用澄清的石灰水可鉴别 NaHCO3 和 Na2CO3 B.制取 NaHCO3 的反应是利用其溶解度小于 NaCl 的溶解度 C.在第③、④、⑤步骤中,溴元素均被氧化 D.工业上通过电解饱和 MgCl2 溶液制取金属镁 答案 B 解析 A 项,NaHCO3、Na2CO3 均和 Ca(OH)2 反应生成沉淀;C 项,第④步溴元素被 还原;D 项,制取 Mg 应电解熔融 MgCl2。 16.为落实“五水共治”,某工厂拟综合处理含 NH + 4 废水和工业废气(主要含 N2、CO2、 SO2、NO、CO,不考虑其他成分),设计了如下流程: 下列说法不正确的是( ) A.固体 1 中主要含有 Ca(OH)2、CaCO3、CaSO3 B.X 可以是空气,且需过量 C.捕获剂所捕获的气体主要是 CO D.处理含 NH + 4 废水时,发生反应的离子方程式为:NH+ 4 +NO- 2 ===N2↑+2H2O 答案 B 解析 A 项,根据题中的流程,可以得出固体 1 为 CaCO3、CaSO3 和过量的 Ca(OH)2 的混合物,正确;B 项,气体 1 为 N2、NO、CO 的混合物,通入 X,然后再与 NaOH 溶液 反应生成的产物为 NaNO2,若 X 为空气且过量,则反应后的产物中没有 NaNO2,这与题图 流程不符,错误;C 项,气体 2 为 N2、CO,因“无污染气体”为 N2,故捕获的气体主要 是 CO,正确;D 项,NH + 4 与 NO - 2 能够发生归中反应生成氮气,离子方程式为 NH+ 4 + NO- 2 ===N2↑+2H2O,正确。 17.如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中, 两装置中的气球(干瘪)b 都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间 热量的传递影响),则所用试剂不可能是( ) A.甲:H2O 和 CaO(固体);乙:H2O 和 NH4NO3(固体) B.甲:盐酸和 Na2O2(固体);乙:亚硫酸钠溶液和氯气 C.甲:NaOH 溶液和 CO2;乙:盐酸和 NaHCO3 溶液 D.甲:浓 H2SO4 和蔗糖(固体);乙:H2O 和 NO2 答案 C 解析 甲中气球胀大,说明广口瓶中产生气体或者温度升高导致气体膨胀;乙中气球 胀大,说明广口瓶中压强减小,气体减少或者温度降低导致气体体积缩小。A 项,CaO 和 H2O 反应放热,NH4NO3 溶于水吸热,符合题意,故不选 A;B 项,Na2O2 与盐酸反应生成 氧气,气体体积增大;氯气和亚硫酸钠溶液发生反应:Cl2+Na2SO3+H2O===Na2SO4+2HCl, 气体体积减小,符合题意,故不选 B;C 项,CO2 被 NaOH 溶液吸收,气体体积减小,盐 酸与 NaHCO3 反应,产生 CO2,气体体积增大,不符合题意,故选 C;D 项,浓 H2SO4 和 蔗糖可以发生氧化还原反应,产生大量的气体,H2O 和 NO2 可以发生反应生成硝酸和 NO, 气体的体积减小,符合题意,故不选 D。 18.某稀硫酸和稀硝酸的混合溶液 200 mL,平均分成两份。向其中一份中逐渐加入铜 粉,最多能溶解 9.6 g,向另一份逐渐加入铁粉,产生气体的量随铁粉的质量增加的变化如 下图所示(已知硝酸只被还原为 NO 气体),下列分析结果错误的是( ) A.原混合酸中 NO - 3 的物质的量为 0.1 mol B.OA 段产生的是 NO,AB 段的反应为 Fe+2Fe3+===3Fe2+,BC 段产生氢气 C.第二份溶液中最终溶质为 FeSO4 D.H2SO4 的浓度为 2.5 mol·L-1 答案 A 解析 由图示可知,OA 段发生反应: Fe + NO- 3 +4H+===Fe3++NO↑+2H2O 56 g 1 mol 5.6 g 0.1 mol 故一份混合酸中 NO - 3 的物质的量为 0.1 mol,原混合酸中的 NO - 3 的物质的量为 0.2 mol, A 项错误;AB 段不产生气体,发生反应:Fe+2Fe3+===3Fe2+,BC 段又产生气体,发生反 应:Fe+2H+===Fe2++H2↑,B 项正确;第二份溶液中,在 OA 段,NO - 3 已经消耗完毕, AB 段,溶液中的 Fe3+已完全变为 Fe2+,BC 段是铁粉与稀硫酸的反应,故最终溶质为 FeSO4, C 项正确;在 C 点,溶质只有 FeSO4,根据原子或原子团守恒可知,n(H2SO4)=n(FeSO4) =n(Fe)= 14.0 g 56 g·mol-1 =0.25 mol,c(H2SO4)=0.25 mol 0.1 L =2.5 mol·L-1,D 项正确。 19.如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中 时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱 继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的不可能是( ) A.N2 与 NO2 的混和气体 B.O2 与 NO2 的混和气体 C.NO 与 NO2 的混和气体 D.NO2 一种气体 答案 A 解析 A 项,N2 和水不反应且不溶于水,试管内不能完全被水充满,故选 A;B 项, O2 与 NO2 的混和气体可在溶液中发生反应 4NO2+O2+2H2O===4HNO3,试管内能完全被 水充满,故不选 B;C 项,NO 与 NO2 的混和气体,当向试管内鼓入氧气后,可在溶液中发 生反应 4NO+3O2+2H2O===4HNO3,4NO2+O2+2H2O===4HNO3,试管内能完全被水充满, 故不选 C;D 项,O2 与 NO2 可在溶液中发生反应 4NO2+O2+2H2O===4HNO3,试管内能 完全被水充满,故不选 D。 20.硫化氢的转化是资源利用和环境保护的重要研究课题。下列关于硫化氢的说法错误 的是( ) A.H2S 是一种弱电解质 B.可用石灰乳吸收 H2S 气体 C.根据上图可知 FeCl3、CuCl2 均能氧化 H2S D.H2S 在空气中燃烧可以生成 SO2 答案 C 解析 A 项,H2S 是弱酸,在水溶液中只能部分电离,是一种弱电解质,不符合题意; B 项,H2S 与 Ca(OH)2 反应生成 CaS 和 H2O,可用石灰乳吸收 H2S 气体,不符合题意;C 项,由图可知 CuCl2 与 H2S 发生复分解反应生成 CuS 沉淀,符合题意;D 项,H2S 在空气 中燃烧可生成 SO2 和水,不符合题意。 21.在标准状况下,15 L 由 NO2、N2 和 NH3 三种气体组成的混合气体,通过稀 HNO3 后,酸液质量增加 15.9 g,气体体积缩小为 3.80 L,则混合气中 NO2、N2 和 NH3 三种气体 的体积(单位:L)分别为( ) A.6.72、1.56、6.72 B.4.62、5.6、3.78 C.6、8、1 D.6.72、6.72、1.56 答案 A 解析 由 NO2、N2 和 NH3 三种气体组成的混合气体通过稀硝酸时,发生的反应有 NH3 +HNO3===NH4NO3 和 3NO2+H2O===2HNO3+NO,据此可知,题给四个选项中,第一个 数据除以 3 加上第二个数据应等于 3.80。故选 A。 22.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原 产物只有 NO)。向反应后的溶液中加入 3 mol·L-1 NaOH 溶液至沉淀完全,测得生成沉淀的 质量比原合金的质量增加 5.1 g。下列叙述不正确的是 ( ) A.当生成的沉淀量达到最大时,消耗 NaOH 溶液的体积 V≥100 mL B.当金属全部溶解时收集到 NO 气体的体积一定为 2.24 L C.参加反应的金属的总质量 3.6 g查看更多