- 2021-05-26 发布 |
- 37.5 KB |
- 64页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解2盐类的水解课件鲁科版选择性必修1
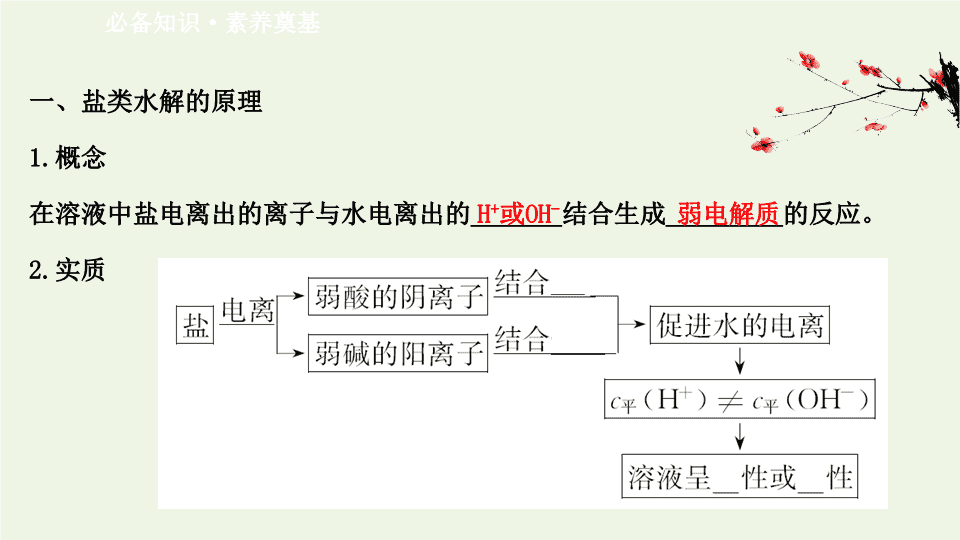
第 2 课时 盐类的水解 一、盐类水解的原理 1. 概念 在溶液中盐电离出的离子与水电离出的 _______ 结合生成 _________ 的反应。 2. 实质 必备知识 · 素养奠基 H + 或 OH - 弱电解质 3. 特点 4. 盐类的水解规律及溶液酸碱性 (1) 在可溶性盐溶液中 : 有弱才水解 , 无弱不水解 , 越弱越水解 , 都弱都水解 , 谁强显谁性。 (2) 盐类水解的类型 盐的类型 实例 是否水解 水解的离子 溶液的 酸碱性 强酸强碱盐 NaCl 、 KNO 3 否 无 _____ 强酸弱碱盐 NH 4 Cl 、 Cu(NO 3 ) 2 是 、 Cu 2+ _____ 弱酸强碱盐 CH 3 COONa 、 Na 2 CO 3 是 CH 3 COO - 、 _____ 弱酸弱碱盐 CH 3 COONH 4 、 NH 4 HCO 3 是 CH 3 COO - 、 、 谁强显 谁性 中性 酸性 碱性 【 情境 · 思考 】 判断盐类是否发生水解以及水解后溶液的酸碱性 , 要看盐的离子所对应的酸和碱的相对强弱。已知常温下有下列溶液 :①Na 2 S 溶液 ② AlCl 3 溶液 ③ Na 2 CO 3 溶液 ④ NaNO 3 溶液。据此思考 : (1) 溶液①中哪种离子发生了水解反应 , 水溶液呈什么性 ? 溶液④能否发生水解反应 ? 提示 : 溶液①中 S 2- 发生了水解反应 ,Na 2 S 溶液呈碱性 ; 溶液④不能发生水解反应。 (2) 溶液③和 NaOH 溶液都呈碱性 , 它们对水的电离影响是否相同 ? 提示 : Na 2 CO 3 溶液由于 的水解呈碱性 , 促进了水的电离 ;NaOH 电离出的 OH - 抑 制了水的电离。 (3) 已知相同温度下 ,CH 3 COOH 的电离常数与 NH 3 ·H 2 O 的电离常数相等 , 请判断 CH 3 COONH 4 溶液的酸碱性。 提示 : CH 3 COONH 4 溶液呈中性。 5. 表示方法 (1) 用化学方程式表示 : 盐 + 水 酸 + 碱。 如 NH 4 Cl 的水解 :__________________________ 。 (2) 用离子方程式表示 : 盐的离子 + 水 酸 ( 或碱 )+OH - ( 或 H + ) 。 如 NH 4 Cl 的水解 :_________________________ 。 NH 4 Cl+H 2 O NH 3 ·H 2 O+HCl +H 2 O NH 3 ·H 2 O+H + (3) 多元弱酸酸根离子的水解应分步书写 : 如 Na 2 CO 3 的水解 :________________________,_______________________, 多元 弱碱阳离子的水解实际是分步进行的 , 习惯只写一步 , 如 Fe 3+ 的水解 : _________________________ 。 +H 2 O +OH - +H 2 O H 2 CO 3 +OH - Fe 3+ +3H 2 O Fe(OH) 3 +3H + 【 巧判断 】 判断下列盐类水解离子方程式的正误 , 正确的打“√” , 错误的打“ ×” 。 (1)FeCl 3 溶液 :Fe 3+ +3H 2 O Fe(OH) 3 ↓+3H + ( ) 提示 : × 。水解反应不加↓或↑。 (2)NaHS 溶液 :HS - +H 2 O H 2 S+OH - ( ) 提示 : √ 。 NaHS 溶液中 HS - 发生水解反应 , 水解反应离子方程式正确。 (3)K 2 CO 3 溶液 : +2H 2 O H 2 CO 3 +2OH - ( ) 提示 : × 。水解反应是分步进行的 , 正确的水解反应离子方程式为 +H 2 O +OH - 。 (4)NH 4 NO 3 溶液 : +H 2 O NH 3 ·H 2 O+H + ( ) 提示 : √ 。 NH 4 NO 3 是强酸弱碱盐 , 发生水解。 (5)NaHCO 3 溶液 : +H 2 O CO 2 ↑+H 2 O ( ) 提示 : × 。 HCO 3 的水解离子方程式为 +H 2 O H 2 CO 3 +OH - 。 二、影响盐类水解平衡的因素 1. 盐类水解的特征 (1) 盐类的水解是 _____ 反应。 (2) 加水稀释能 _____ 盐类的水解。 吸热 促进 2. 影响因素 因素 对盐类水解程度的影响 内因 组成盐的弱酸根离子或弱碱阳离子越弱 , 水解程度越 ___ 外因 温度 升高温度能够 _____ 水解 浓度 盐溶液的浓度越小 , 水解程度越 ___ 外加 酸碱 水解显酸性的盐溶液 , 加碱会 _____ 水解 , 加酸会 _____ 水解 , 反之亦然 外加 盐 加入与盐的水解性质相反的盐会 _____ 盐的水解 大 促进 大 促进 抑制 促进 3. 相互促进的水解反应 (1) 相互促进能进行彻底的水解反应 ①如 与 Al 3+ 水解反应的离子方程式 : ______________________________ 。 ②如 S 2- 与 Al 3+ 水解反应的离子方程式 : __________________________________ 。 3 +Al 3+ ====3CO 2 ↑+Al(OH) 3 ↓ 3S 2- +2Al 3+ +6H 2 O====3H 2 S↑+2Al(OH) 3 ↓ (2) 相互促进不能进行彻底的水解反应 如铵盐与醋酸盐水解反应的离子方程式 : _______________________________________ 。 CH 3 COO - + +H 2 O CH 3 COOH+NH 3 ·H 2 O 【 做一做 】 有下列盐溶液 :①KNO 3 ② AgNO 3 ③ K 2 CO 3 ④ FeCl 3 ⑤ K 2 SO 4 ⑥ NaClO ⑦ NH 4 Cl 提示 : AgNO 3 、 FeCl 3 、 NH 4 Cl 属于强酸弱碱盐 , 溶液呈酸性 ;K 2 CO 3 、 NaClO 属于强碱弱酸盐 , 溶液呈碱性 ;KNO 3 、 K 2 SO 4 属于强酸强碱盐 , 溶液呈中性。 答案 : ②④⑦ ③⑥ ①⑤ 类型 呈酸性 呈碱性 呈中性 序号 关键能力 · 素养形成 知识点一 外界条件对盐类水解平衡的影响 【 重点释疑 】 1. 外界条件对盐类水解平衡的影响 以 Fe 3+ +3H 2 O Fe(OH) 3 +3H + ΔH>0 为例 体系 变化 条件 平衡 移动 方向 n(H + ) pH 水解 程度 现象 升温 向右 增多 减小 增大 颜色变深 通 HCl 向左 增多 减小 减小 颜色变浅 加 H 2 O 向右 增多 增大 增大 颜色变浅 加 FeCl 3 固体 向右 增多 减小 减小 颜色变深 加 NaHCO 3 向右 减小 增大 增大 生成红褐色 沉淀 , 放出 气体 2. 溶液中其他离子对盐类水解的影响 (1) 水解相互抑制。 如溶液 (NH 4 ) 2 Fe(SO 4 ) 2 中的 Fe 2+ 与 水解时都显酸性 , 所以两者的水解相互抑 制。同浓度的 (NH 4 ) 2 Fe(SO 4 ) 2 溶液与 FeSO 4 溶液相比 ,FeSO 4 溶液中的 Fe 2+ 的水解 程度更大。 (2) 水解相互促进。 ① 与 S 2- 、 、 、 CH 3 COO - 等组成的盐虽然水解相互促进 , 但水解程 度较小 , 仍是部分水解 , 书写时仍用“ ”表示。如 +CH 3 COO - +H 2 O CH 3 COOH+NH 3 ·H 2 O 。 ② Al 3+ 和 、 、 S 2- 、 HS - 、 [Al(OH) 4 ] - 等组成的盐水解相互促进非常彻 底 , 生成气体和沉淀 , 书写时用“ ====” 表示。如 Al 3+ +3 ====Al(OH) 3 ↓ +3CO 2 ↑ 。 【 思考 · 讨论 】 (1)pH=4 的醋酸和氯化铵溶液中 , 水的电离程度前者与后者比较是什么关系 ? 提示 : 小于。醋酸电离出的 H + 抑制水的电离 , 使水的电离程度减小 ;NH 4 Cl 电离出 的 结合水电离出的 OH - , 生成弱电解质 NH 3 ·H 2 O, 促进水的电离 , 使水的电 离程度增大。 (2) 室温下 , 将碳酸钠溶液加热至 70 ℃, 溶液中 c 平 ( ) 、水的电离程度、 K w 以及溶液的碱性将如何变化 ? 提示 : 对于水解平衡 +H 2 O +OH - , 升温 , 平衡右移 ,c 平 ( ) 减小 , 水的电离程度增大 ,K w 变大 , 溶液的碱性增强。 【 拓展深化 】 (1) 盐类水解易受温度、浓度、溶液的酸碱性等因素的影响 , 以氯化铁水解为例 , 当改变条件如升温、通入 HCl 气体、加水、加铁粉、加碳酸氢钠等时 , 应从平衡移动方向、 pH 的变化、水解程度、现象等方面归纳总结 , 分析掌握。 (2) 多元弱酸的酸式盐问题。酸式盐一般既存在水解 , 又存在电离。如果酸式盐的电离程度大于其水解程度 , 溶液显酸性 , 如 NaHSO 3 溶液 ; 如果酸式盐的水解程度大于其电离程度 , 则溶液显碱性 , 如 NaHCO 3 溶液。 【 案例示范 】 【 典例 】 (2018· 北京高考 ) 测定 0.1 mol·L -1 Na 2 SO 3 溶液先升温再降温过程中的 pH , 数据如下 : 时刻 ① ② ③ ④ 温度 /℃ 25 30 40 25 pH 9.66 9.52 9.37 9.25 实验过程中 , 取①④时刻的溶液 , 加入盐酸酸化的 BaCl 2 溶液做对比实验 ,④ 产生 白色沉淀多。下列说法不正确的是 ( ) A.Na 2 SO 3 溶液中存在水解平衡 : + H 2 O + OH - B.④ 的 pH 与①不同 , 是由于 浓度减小造成的 C.①→③ 的过程中 , 温度和浓度对水解平衡移动方向的影响一致 D.① 与④的 K w 相等 【 解题指南 】 解答本题时要注意以下两点 : (1) 注意亚硫酸钠这种盐的类型。 (2) 注意外界条件对盐类水解平衡的影响。 【 解析 】 选 C 。 Na 2 SO 3 属于弱酸强碱盐 , 溶液中存在水解平衡 + H 2 O + OH - ,A 正确 ;④ 的 pH 与①不同 , 是由于 被 O 2 氧化生成 , 浓度减 小 , 水解平衡左移 ,OH - 浓度减小 ,B 正确 ; 水解反应为吸热反应 , 升高温度 , 水解平 衡右移 ,pH 应当升高 , 而①→③的过程中 pH 下降 , 说明温度和浓度对水解平衡移 动方向的影响不一致 ,C 错误 ; 离子积常数 K w 只受温度影响 ,① 与④的温度相同 , 故 K w 相等 ,D 正确。 【 母题追问 】 (1) 上题将 0.1 mol·L -1 Na 2 SO 3 溶液改为同浓度 Na 2 CO 3 溶液先升温再降温过程中的 pH 如何变化 ? 提示 : 水解反应为吸热反应 , 升高温度 , 水解平衡右移 ,pH 升高 ; 降低温度 , 水解平衡左移 ,pH 降低。 (2)D 项①与④的水解平衡常数相等吗 ? 提示 : 水解平衡常数只受温度影响 ,① 与④的温度相同 , 水解平衡常数相等。 【 迁移 · 应用 】 1.(2020· 杭州高二检测 ) 向三份 0.1 mol·L -1 CH 3 COONa 溶液中分别加入少量 NH 4 NO 3 、 Na 2 SO 3 、 FeCl 3 固体 ( 忽略溶液体积变化 ), 则 CH 3 COO - 浓度的变化依次为 ( ) A. 减小、增大、减小 B. 增大、减小、减小 C. 减小、增大、增大 D. 增大、减小、增大 【 解析 】 选 A 。 CH 3 COO - 水解显碱性 , 水解也呈碱性 , 会抑制 CH 3 COO - 的水解 , CH 3 COO - 浓度增大。 和 Fe 3+ 水解呈酸性 , 会促进 CH 3 COO - 水解 ,CH 3 COO - 浓度会 减小。 2.0.1 mol·L -1 K 2 CO 3 溶液中 , 由于 的水解 , 使得 c 平 ( )<0.1 mol·L -1 。 如果要使 c 平 ( ) 更接近 0.1 mol·L -1 , 可以采取的措施是 ( ) A. 加入适量水 B. 加入少量盐酸 C. 加入适量 KOH 固体 D. 加热 【 解析 】 选 C 。要使 c 平 ( ) 更接近于 0.1 mol·L -1 , 需要抑制碳酸根离子的水 解。 A 项 , 加入水稀释会导致溶液中离子浓度减小 , 错误 ;B 项 , 加入盐酸会和碳酸 根反应生成水和二氧化碳 , 碳酸根离子浓度减小 , 错误 ;C 项 , 加入氢氧化钾固体 , 会抑制碳酸根水解 , 使得碳酸根浓度接近 0.1 mol·L -1 , 正确 ;D 项 , 加热会促进碳 酸根离子水解 , 导致离子浓度减小 , 错误。 知识点二 溶液中离子浓度大小的比较 【 重点释疑 】 1. 理解两大平衡 , 树立“微弱”意识 (1) 电离平衡→建立电离过程是“微弱”的意识。 弱电解质 ( 弱酸、弱碱、水 ) 的电离是微弱的 , 且水的电离能力远远小于弱酸和 弱碱的电离能力。如在稀醋酸溶液中 :CH 3 COOH CH 3 COO - +H + ,H 2 O OH - +H + , 在溶液中微粒浓度由大到小的顺序 :c 平 (CH 3 COOH)>c 平 (H + )>c 平 (CH 3 COO - ) > c 平 (OH - ) 。 (2) 水解平衡→建立水解过程是“微弱”的意识。 弱酸阴离子或弱碱阳离子的水解是微弱的 , 但水的电离程度远远小于盐的水解 程度。如稀的 CH 3 COONa 溶液中 , CH 3 COONa====CH 3 COO - +Na + ,CH 3 COO - +H 2 O CH 3 COOH+OH - ,H 2 O H + +OH - , 所以 CH 3 COONa 溶液中 ,c 平 (Na + )>c 平 (CH 3 COO - )>c 平 (OH - )>c 平 (CH 3 COOH)>c 平 (H + ) 。 2. 明确“三个”守恒原理 (1) 电荷守恒 : 即电解质溶液中阴离子所带电荷总数等于阳离子所带电荷总 数。如 Na 2 CO 3 溶液中的电荷守恒为 c 平 (Na + )+c 平 (H + )=c 平 (OH - )+2c 平 ( )+ c 平 ( ) 。 (2) 物料守恒 : 是指物质发生变化前后 , 有关元素的存在形式不同 , 但元素的种 类和原子数目在变化前后保持不变。如 Na 2 CO 3 溶液中 n(Na)=2n(C): 故物料守恒 式为 c 平 (Na + )=2c 平 ( )+2c 平 ( )+2c 平 (H 2 CO 3 ) 。 (3) 质子守恒 : 是指在电离或水解过程中 , 会发生质子 (H + ) 转移 , 但在质子转移过程中其数量保持不变。 3. 正确理解质子守恒 以 Na 2 CO 3 和 NaHCO 3 溶液为例 , 可用下图所示帮助理解质子守恒 : (1)Na 2 CO 3 溶液 所以 c 平 (OH - )=c 平 ( )+2c 平 (H 2 CO 3 )+c 平 (H 3 O + ), 即 c 平 (OH - )=c 平 ( )+2c 平 (H 2 CO 3 )+c 平 (H + ) 。 (2)NaHCO 3 溶液 所以 c 平 (OH - )+c 平 ( )=c 平 (H 2 CO 3 )+c 平 (H + ) 。 另外 , 将混合溶液中的电荷守恒式和物料守恒式相联立 , 通过代数运算消去其中某离子 ( 如 Na + 、 Cl - 等 ), 即可推出该溶液中的质子守恒。 【 思考 · 讨论 】 (1) 相同物质的量浓度的 a:NH 4 Cl 溶液、 b:CH 3 COONH 4 溶液、 c:NH 4 HSO 4 溶液 , 三 种溶液中 c 平 ( ) 由大到小的顺序是什么 ? 提示 : c 中 H + 对 水解有抑制作用 ,b 中 CH 3 COO - 的水解对 水解有促进作用 , 所以三种溶液中 c 平 ( ) 由大到小的顺序是 c>a>b 。 (2) 已知 , 在 HClO 溶液中存在的平衡有 HClO H + +ClO - ,H 2 O H + +OH - , 则溶 液中存在哪些微粒 ? 各微粒之间的大小关系是什么 ? 提示 : 溶液中微粒有 H 2 O 、 HClO 、 H + 、 OH - 、 ClO - , 由于 HClO 电离程度小 , 且 H 2 O 的 电离程度更小 , 所以溶液中微粒浓度由大到小的顺序 (H 2 O 除外 ) 是 c 平 (HClO)> c 平 (H + )>c 平 (ClO - )>c 平 (OH - ) 。 【 案例示范 】 【 典例 】 (2020· 沈阳高二检测 ) 常温时 , 体积均为 50 mL 物质的量浓度均为 0.10 mol·L -1 的 HX 、 HY 、 HZ 三种弱酸 , 分别用 0.10 mol·L -1 的 NaOH 溶液滴定 , 滴定曲线如图所示。下列有关说法错误的是 ( ) A. 浓度均为 0.10 mol·L -1 时 , 酸的电离度 :HX查看更多