- 2021-05-26 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第1讲 弱电解质的电离-8强酸(碱)与弱酸(碱)的比较
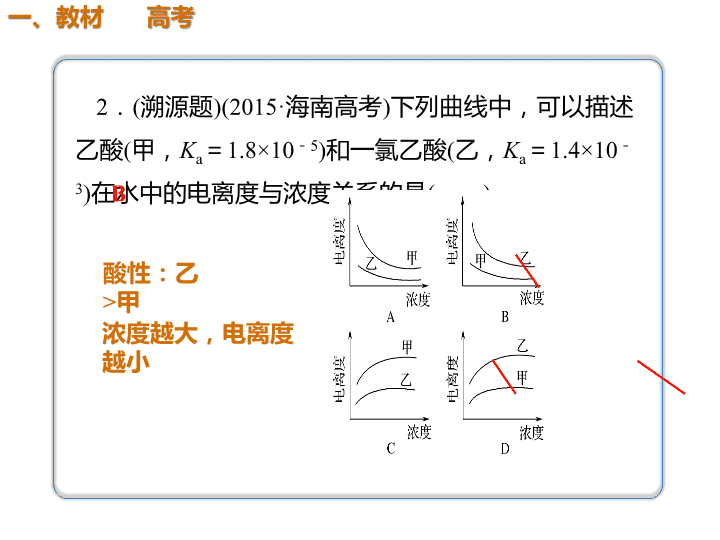
2.(溯源题)(2015·海南高考)下列曲线中,可以描述 乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10 -3)在水中的电离度与浓度关系的是( )B 酸性:乙 >甲 浓度越大,电离度 越小 2.在体积都为1 L,pH都等于2的盐酸和醋酸溶液中, 投入0.65 g锌粒,则如图所示符合客观事实的是( )C 试 题 备 选 解题提示: 1、醋酸浓度大于盐 酸 2、醋酸在反应过程 中存在电离平衡, H+浓度较大 解析 因盐酸为强酸、醋酸为弱酸,故pH都等于 2的盐酸和醋酸溶液中,c(HCl)=0.01 mol·L-1,而 c(CH3COOH)>0.01 mol·L-1,1 L溶液中n(HCl)= 0.01 mol,n(CH3COOH)>0.01 mol。A项,相同时 间内pH变化较大的应为HCl,错误;B项,产生H2 的速率大的应为CH3COOH,错误;D项,相同时间 内c(H+)变化较大的为HCl,错误。 (2016·厦门模拟)25 ℃时,相同pH的两种一元弱 酸HA与HB溶液分别加水稀释,溶液pH随溶液体积 变化的曲线如图所示。下列说法正确的是( ) A.同浓度的NaA与NaB溶液中,c(A-)小于c (B-) B.a点溶液的导电性大于b点溶液 C.a点的c(HA)大于b点的c(HB) D.HA的酸性强于HB D HA的酸性强于HB 【试题备选】 解析 由于稀释过程中HA的pH变化较大,故 HA的酸性强于HB,D项正确;酸的酸性越强, 对应的盐的水解程度越小,故NaB的水解程度 大,同浓度的NaA与NaB溶液中c(B-)小于c (A-),A项错误;b点溶液的pH小于a点溶液 的pH,说明b点溶液中c(H+)较大、c(B-) 较大,故溶液导电性较强,B项错误;HA酸性 强 于 H B , 则 相 同 p H 的 溶 液 , c ( H A ) < c (HB),稀释相同倍数时,a点的c(HA)小 于b点的c(HB),C项错误。 强酸弱酸比较 以一元强酸(HCl)与一元弱酸(CH3COOH)的 比较为例。 (1)相同物质的量浓度、相同体积的盐酸与 醋酸溶液的比较 比较 项目 酸 c (H +) p H 中 和 碱 的 能 力 与活 泼金 属反 应产 生H2 的量 开始 与金 属反 应的 速率 盐酸 大 小 相 同 大 (2)相同pH、相同体积的盐酸与醋酸 溶液的比较 比 较 项目 酸 c(H +) c (酸) 中 和 碱 的 能 力 与足量 活泼金 属反应 产生H2 的量 开始 与金 属反 应的 速率 盐酸 相 同 小 小 少 相同醋酸 溶液 大 大 多查看更多