- 2021-05-26 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习原子结构 核外电子排布学案
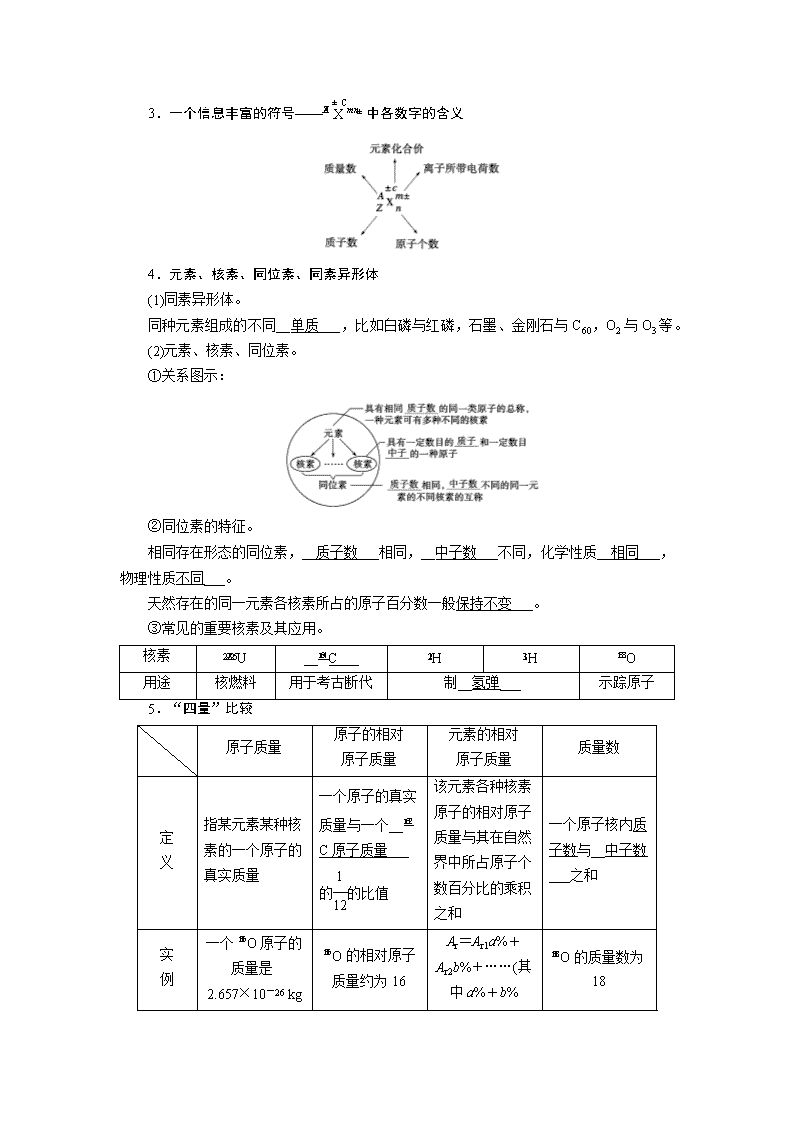
第14讲 原子结构 核外电子排布 考纲要求 名师点拨 1.了解元素、核素和同位素的含义。 2.了解原子的构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 3.了解原子核外电子排布规律。 在探究元素及其化合物知识告一段落之后,本讲内容将是中学化学重要的基本理论之一,是学习元素周期表、元素周期律知识的重要基础,这一部分需要记忆的东西很多。预计今后高考考查的重点仍会以元素及其化合物知识为载体,用物质结构理论来解释现象、定性推断、定量计算,向多方位、多角度、多层次方向延伸,主要表现在以下几个方面:一是元素、核素和同位素的概念及性质;二是原子结构及各粒子“量”之间的关系;三是8e-结构判断及等电子微粒的判断及应用,如10e-、18e-微粒。考查方式有选择题和填空题,选择题测试角度主要考查学生对原子结构,核外电子排布规律的认识和理解能力。在填空题中常常和元素推断的内容结合起来,借以考查学生对元素或物质微观结构的认识。 考点一 原子构成 同位素 1.原子的构成 (1)决定元素种类的是__质子数(核电荷数)___。 (2)决定元素化学性质的是__最外层电子数___。 (3)决定原子种类的是__质子数和中子数___。 (4)决定原子相对质量的是__质子数和中子数___。 2.原子结构中微粒之间的关系 (1)X中,质子数(Z)=__核电荷数___=__核外电子数___ (2)质量数(A)=__质子数___(Z)+__中子数___(N) (3)阳离子Xn+的核外电子数=质子数-__阳离子所带的电荷数___=__Z-n___ (4)阴离子Xm-的核外电子数=质子数+__阴离子所带的电荷数___=__Z+m___ 3.一个信息丰富的符号——中各数字的含义 4.元素、核素、同位素、同素异形体 (1)同素异形体。 同种元素组成的不同__单质___,比如白磷与红磷,石墨、金刚石与C60,O2与O3等。 (2)元素、核素、同位素。 ①关系图示: ②同位素的特征。 相同存在形态的同位素,__质子数___相同,__中子数___不同,化学性质__相同___,物理性质不同___。 天然存在的同一元素各核素所占的原子百分数一般保持不变___。 ③常见的重要核素及其应用。 核素 U __C___ H H O 用途 核燃料 用于考古断代 制__氢弹___ 示踪原子 5.“四量”比较 原子质量 原子的相对 原子质量 元素的相对 原子质量 质量数 定 义 指某元素某种核素的一个原子的真实质量 一个原子的真实质量与一个__C原子质量___的的比值 该元素各种核素原子的相对原子质量与其在自然界中所占原子个数百分比的乘积之和 一个原子核内质子数与__中子数___之和 实 例 一个O原子的质量是2.657×10-26 kg O的相对原子质量约为16 Ar=Ar1a%+Ar2b%+……(其中a%+b% O的质量数为18 +……=1) 备注 某核素的质量数可视为该核素的近似相对原子质量 1.判断正误,正确的画“√”,错误的画“×”。 (1)质子数相同的微粒一定属于同一种元素( × ) (2)35Cl2与37Cl2互为同位素( × ) (3)U和U是同位素,核反应属于化学变化( × ) (4)18O2和16O2是两种不同的原子( × ) (5)13C与C60互为同素异形体( × ) (6)一种单质中可能含有多种核素,如O2中含16O、17O、18O三种核素( √ ) (7)Cl与Cl得电子能力相同( √ ) (8)质子数为35、中子数为45的溴原子:Br( √ ) (9)所有的原子中都含有质子和中子( × ) (10)2H+核外电子数为2( × ) (11)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子( √ ) (12)H3O+和OH-中具有相同的质子数和电子数( × ) (13)质子数就是元素的相对原子质量( × ) (14)核聚变如H+H―→He+n,因为有新微粒生成,所以该变化是化学变化( × ) 2.问题思考: (1)H、H、H与16O、17O、18O能组成__18___种不同的水分子? (2)有5种单核粒子,它们分别是、、+、2+、(“”内元素符号未写出),则它们所属元素的种类有__3___种。 (3)1H、2H、3H三种微粒都属于__氢元素___,因为它们是具有相同__质子数___的同一类原子。 (4)在H、H、H、C、、C、、C、、N、、N中,核素、元素的种数分别为__8___种、__3___种。 (5)C、C、C的关系为__同位素___,因为它们是具有__相同的质子数和不同的中子数___的同一元素的不同原子,它们的化学性质几乎完全相同。 (6)所有的原子中都含有质子和中子吗?符号C表示的含义是什么? 提示:H中不含有中子,所有原子均含有质子;C表示质子数为6,中子数为6的碳原子。 (7)质子数相同的微粒一定属于同一种元素吗? 提示:不一定。质子数相同的粒子不一定属于同种元素,如Ne和H2O。 1.(2019·新题预选)有以下六种原子:Li、Li、Na、Mg、C、N,下列相关说法不正确的是( B ) A.Li和Li在元素周期表中所处的位置相同 B.C和N质量数相等,二者互为同位素 C.Na和Mg的中子数相同但不属于同种元素 D.Li的质量数和N的中子数相等 2.(2019·新题预选)科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定该物质易溶于水,在水中以SO和N4H两种离子形式存在,植物的根系极易吸收N4H,但它遇到碱时,会生成一种形似白磷的N4分子。N4分子不能被植物吸收。下列有关说法不正确的是( B ) A.N4和N2互为同素异形体 B.14N与14C互为同位素 C.N4H4(SO4)2不能与草木灰混合使用 D.N4和N2是不同的两种分子,化学性质不同 [解析] N4与N2都是N的单质互为同素异形体,A正确;14N与14C是不同元素的原子,B错误;草木灰水解显碱性,N4H4(SO4)2中的N4H在碱性条件下生成N4分子不能被植物吸收,C正确;N4和N2是不同的两种分子,化学性质不同,D正确。 [易错警示] ①元素的种类由原子核内的质子数决定,因此划分元素种类的唯一标准是质子数(即核电荷数)。 ②元素概念中的原子是泛指,即各种状况下的原子或离子(包括游离态和化合态),所以H、D、T、H+、H-都属于氢元素。 ③元素是个宏观概念,元素只讲种类,不讲个数,元素组成物质。 3.(2019·陕西西安期末)YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于Y的说法中正确的是( B ) A.Y的质子数与中子数之差为50 B.Y和Y互为同位素 C.Y和Y的核外电子数不相等 D.Y和Y是钇元素的两种不同的核素,具有不同的化学性质 [解析] 中子数=89-39=50,中子数与质子数之差=50-39=11,故A错误;Y和Y是质子数相同、中子数不同的同种元素的不同核素,互为同位素,故B正确;Y和Y 质子数相同,核外电子数相同,故C错误;Y和Y具有相同的化学性质,故D错误。 4.(2019·山东潍坊检测)某元素的一种核素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是( A ) A.(A-N+m) mol B.(A-N) mol C.(A-N) mol D.(A-N+m) mol [解析] X原子的质子数为(A-N),一个HmX分子中所含的质子数为(A-N+m),HmX的摩尔质量为(A+m) g·mol-1,所以a g HmX中所含质子的物质的量为(A-N+m) mol。 5.(2019·安徽合肥期末)最近医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS)。下列有关14C的叙述正确的是( D ) A.14C与C60中普通碳原子的化学性质不同 B.14C与14N含的中子数相同 C.14C是C60的同素异形体 D.14C与12C互为同位素 [解析] 14C与C60中普通碳原子,为同种元素的原子,其化学性质相同,A错误;14C的中子数为14-6=8,14N的中子数为14-7=7,B错误;14C是原子,不是单质,与C60不是同素异形体,C错误;14C与12C的质子数均为6,中子数分别为8、6,二者互为同位素,D正确。 6.(2019·经典习题选萃)下列说法正确的是( C ) ①1H、2H、3H为三种不同的核素 ②1H、2H、3H互为同位素 ③1H、2H、3H互为同素异形体 ④114号元素位于周期表第七周期ⅤA族 ⑤氢元素质量数为1 ⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置 ⑦互为同位素的原子性质相同 A.①②④⑥⑦ B.①②③⑤⑥ C.①②⑥ D.①②③⑥⑦ [解析] 1H、2H、3H,质子数均为1,中子数分别为0、1、2,是氢元素的三种不同的核素,故①正确;1H、2H、3H是氢元素的三种不同的核素,互为同位素,故②正确;1H、2H、3H是三种不同的核素,不是单质,因此不是同素异形体,故③错误;114号元素位于周期表第七周期ⅣA族,故④错误;质量数是指某种原子的质子数与中子数之和,对元素无意义,⑤错误;同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置,故⑥正确;互为同位素的原子化学性质相同,物质性质不同,故⑦错误。 萃取精华: 1.理解有关概念的易错点 (1)一种元素可以有若干种不同的核素,也可以只有一种核素,有多少种核素就有多少种原子。因此,原子的种类大于元素的种类。 (2)同位素的研究对象是原子,“同位”是指同一种元素的几种核素在元素周期表中的位置相同,即质子数相同,中子数不同;同素异形体的研究对象为单质,“同素”是指元素种类相同。 (3)2H2和3H2既不是同位素,也不是同素异形体,是同种物质。 (4)核聚变、核裂变属于核反应,既不是物理变化,也不是化学变化。 (5)同位素之间的转化,既不是物理变化也不是化学变化,是核反应。 (6)同位素之间可形成不同的同位素单质。如氢分子有六种:H2、D2、T2、HD、HT、DT。同位素可形成不同的同位素化合物。如水分子有:H2O(普通的水)、D2O(重水)、T2O(超重水)等。H、D、T与16O、17O、18O可形成6×3=18种水分子。它们的物理性质(如密度)有所不同,化学性质相同。 2.同位素的“六同三不同” 7.现有下列9种微粒:H、H、C、C、N、Fe2+、Fe3+、O2、O3。按要求完成以下各题: (1)H、H分别是氢元素的一种__核素___,它们互称为__同位素___。 (2)互为同素异形体的微粒是__O2和O3___。 (3)对于X,按下列要求各举一例(每小题分别写出符合题意的两种微粒,且从以上所给微粒中选择): ①Z、n、b相同而A不同:__H、H(或C、C)___; ②A、n、b相同而Z不同:__C、N___; ③A、Z、b相同而n不同:__Fe2+、Fe3+___; ④Z、n、A相同而b不同:__O2、O3___。 反思归纳: 抓住描述的对象突破“四同”判断:①同位素——原子,如H、H、H;②同素异形体——单质,如O2、O3;③同系物——化合物,如CH3CH3、CH3CH2CH3;④同分异构体——化合物,如正戊烷、异戊烷和新戊烷。 考点二 原子核外电子排布的规律 1.电子的运动特征 运动速度__很快__,与宏观物体的运动有极大不同:不能同时确定__速度__和__位置__,不能描绘__运动轨迹__。 2.电子层的表示方法及能量变化 3.核外电子排布规律 4.核外电子排布的表示方法(原子或离子结构示意图) 5.核外电子排布与元素性质的关系 (1)金属元素原子的最外层电子数一般小于4,较易__失去__电子,形成阳离子,表现出__还原__性,在化合物中显正化合价。 (2)非金属元素原子的最外层电子数一般大于或等于4,较易__得到__电子,活泼非金属原子易形成阴离子。在化合物中主要显负化合价。 (3)稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。 6.1~20号元素原子核外电子排布的特点与规律 (1)原子核中无中子的原子:H。 (2)最外层只有一个电子的原子:H、Li、Na、K; 最外层有两个电子的原子:He、Be、Mg、Ca。 (3)最外层电子数等于次外层电子数的原子:Be、Ar; 最外层电子数是次外层电子数2倍的原子:C; 最外层电子数是次外层电子数3倍的原子:O。 (4)电子层数与最外层电子数相等的原子:H、Be、Al; 最外层电子数是电子层数2倍的原子:He、C、S; 最外层电子数是电子层数3倍的原子:O。 (5)次外层电子数是最外层电子数2倍的原子:Li、Si。 (6)内层电子总数是最外层电子数2倍的原子:Li、P。 7.核外等电子微粒 (1)10电子微粒。 10电子微粒间的转化。 若A、B、C、D均为10电子微粒,且它们之间存在如图转化: 图中的常见转化一定是NH+OH-NH3↑+H2O,即A为NH、B为OH-、C为NH3、D为H2O。 (4)18电子微粒。 ①Ar HClH2SPH3SiH4HS-S2-Cl-K+Ca2+ ②“双九”微粒。 —F、—OH、—NH2、—CH3的相互组合,如: F2、H2O2、N2H4、C2H6、CH3F、CH3OH、CH3NH2 1.判断正误,正确的画“√”,错误的画“×”。 (1)M层是最外层时,最多能容纳18个电子( × ) 提示:最外层最多只能容纳8个电子。 (2)原子最外层电子数相同的元素,其化学性质一定相似( × ) 提示:由H、Na可知错误。 (3)地壳中含量最多的金属元素为O( × ) 提示:“金属元素”,O不属于金属元素。 (4)LiCl中各原子均满足8电子的稳定结构( × ) 提示:1~5号元素原子H、He、Li、Be、B与其他原子结合后,一定达不到8电子稳定结构,所在判断最外层是否达到8电子结构时,一定要注意这几种原子。 (5)最外层有5个电子的原子都是非金属原子( × ) (6)核外电子排布相同的微粒化学性质也相同( × ) (7)NH与PH3均是10电子微粒( × ) (8)Cl-和S2-的核外电子数均为18,故离子结构示意图均为( × ) (9)NH与Na+的质子数与电子数均相同( √ ) (10)16O和18O是氧元素的两种核素,16O与18O核外电子排布不同( × ) 2.下图为几种粒子结构示意图,完成以下填空。 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ (1)属于阳离子结构的粒子是__③⑤⑧__(填编号,下同)。 (2)具有稳定性结构的原子是__②__。 (3)只能得电子的粒子是__③⑤__;只能失电子的粒子是__①④⑥__;既能得电子,又能失电子的粒子是__⑦⑧__。 3.按要求填空(均为短周期元素)。 (1)最外层电子数为1的元素有__H、Li、Na__(填元素符号,下同)。 (2)最外层电子数为2的元素有__He、Be、Mg__。 (3)最外层电子数与次外层电子数相等的元素有__Be、Ar__。 (4)最外层电子数是次外层电子数2倍的元素是__C__。 (5)最外层电子数是次外层电子数3倍的元素是__O__。 (6)次外层电子数是最外层电子数2倍的元素有__Li、Si__。 (7)内层电子总数是最外层电子数2倍的元素有__Li、P__。 (8)电子层数与最外层电子数相等的元素有__H、Be、Al__。 (9)最外层电子数是电子层数2倍的元素有__He、C、S__。 (10)最外层电子数是电子层数3倍的元素有__O__。 4.已知某粒子的结构示意图为。试回答: (1)当x-y=10时,该粒子为__原子__(填“原子”“阳离子”或“阴离子”)。 (2)当y=8时,粒子可能为(填粒子符号)__Ar__、__Cl-__、__S2-__、__K+__、__Ca2+__。(合理即可) (3)写出y=3与y=7的元素最高价氧化物对应水化物间发生反应的离子方程式: Al(OH)3+3H+===Al3++3H2O 。 1.(2019·新题预选)下列叙述中正确的是( C ) A.两种粒子,若核外电子排布完全相同,则其化学性质一定相同 B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 C.两原子如果核外电子排布相同,则一定属于同种元素 D.稀有气体元素原子的最外层都排有8个电子 2.(2019·试题调研)在第n电子层中,当它作为原子的最外层时,容纳电子数最多与(n-1)层相同;当它作为原子的次外层时,其电子数比(n-1)层多10个,则此电子层是( C ) A.K层 B.L层 C.M层 D.N层 [解析] 原子最外层(第n电子层)最多容纳电子数是8个,即第(n-1)层容纳8个电子,那么第(n-1)层为L层,第n电子层为M层;再对照M层作为次外层时最多可容纳18个电子,比L层多10个电子。 3.(2019·赣州模拟)R、Q为短周期中的两种元素,R元素原子的最外层电子数与次外层电子数之差的绝对值等于电子层数;Q元素的原子比R元素的原子多2个核外电子,则下列叙述中肯定不正确的是( B ) A.原子半径:R>Q B.R和Q可形成离子化合物RQ C.R和Q可形成共价化合物RQ2 D.R和Q可形成共价化合物RQ3 [解析] R可能是碳或磷元素,则对应的Q是氧或氯元素,碳和氧或磷和氯均不可能形成离子化合物。 4.(2016·课标全国甲,9) a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是( A ) A.a与其他三种元素形成的二元化合物中其化合价均为+1 B.b与其他三种元素均可形成至少两种二元化合物 C.c的原子半径是这些元素中最大的 D.d和a形成的化合物的溶液呈弱酸性 [解析] 根据a原子中只有1个电子可确定a为H,由b2-和c+电子层结构相同,可知b和c分别位于第二、三周期,则b、c分别为O和Na,d与b同族,则d为S。二元化合物H2O、H2S中H均为+1价,而NaH中H为-1价,A项错误;O与其他三种元素可分别形成H2O和H2O2、Na2O和Na2O2、SO2和SO3,B项正确;根据四种元素在周期表中的位置可确定原子半径:Na>S>O>H,C项正确;H2S在溶液中部分电离而使溶液呈弱酸性,D项正确。 5.(2019·东北三省四市联合体一模)现有部分元素的原子结构特点如表: X L层电子数是K层电子数的3倍 Y 核外电子层数等于原子序数 Z L层电子数是K层和M层电子数之和 W 最外层电子数是次外层电子数的2.5倍 (1)画出W原子结构示意图 。 (2)元素X与元素Z相比,非金属性较强的是__氧__(填元素名称),写出一个能表示X、Z非金属性强弱关系的化学反应方程式 2H2S+O2===2H2O+2S↓(其他合理答案亦可) 。 (3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为__NH4HSO4__。 (4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式N2H4+2H2O2N2+4H2O 。 [解析] X元素原子的L层电子数是K层电子数的3倍,根据核外电子排布规律,可知L层为6个电子,所以X为氧元素。Y元素原子的核外电子层数等于原子序数,Y只能是氢元素。Z元素原子的L层电子数是K层和M层电子数之和,L层有8个电子,则其M层电子数为6,所以Z是硫元素。W元素原子的最外层电子数是次外层电子数的2.5倍,其次外层只能是K层有2个电子,所以W为氮元素。(2)能说明氧元素比硫元素非金属性强的事实很多,但是单质之间的置换反应生成S比较直观。(3)H、N、O、S四种非金属元素形成离子化合物只能是铵盐,其水溶液显强酸性应是强酸的酸式盐,因为铵盐水解酸性不如其酸式盐溶液酸性强,故应为NH4HSO4。(4)H和O按原子个数比1∶1化合形成的化合物为H2O2共有18个电子,则H和N形成的18电子微粒只能是N2H4,根据信息写出方程式即可。 6.(2019·山东潍坊高三检测)A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知: ①A++C-===D+E↑;②B++C-===2D。 请回答: (1)C-离子的电子式是 [H]- 。 (2)分别写出A+和D反应、B+和E反应的离子方程式 NH+H2ONH3·H2O+H+ 、 H3O++NH3===NH+H2O 。 (3)除D、E外,请再写出两种含10个电子的分子的分子式__CH4、Ne__。 (4)除A+、B+外,请再写出两种含10个电子的阳离子__Na+、Mg2+__。 [解析] 本题中五种粒子均有10个电子是解题的突破口。依据已有的元素与化合物知识可知,10电子的粒子中,原子有Ne;阴离子有N3-、O2-、F-、OH-、NH,阳离子有Na+、Mg2+、Al3+、NH、H3O+;分子有CH4、 NH3、H2O、HF。根据题意有:①A++C-===D+E↑,推知A+应为NH、C-为OH-、D为H2O、E为NH3,将其结果代入②B++C-===2D,推知B+应为H3O+。 7.(2019·山东潍坊高三检测)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): (1)如果A、B、C、D均是10电子的粒子,请写出A、D的电子式:A ;D HH 。 (2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出: ①A与B在溶液中反应的离子方程式为 HS-+OH-===S2-+H2O 。 ②根据上述离子方程式,可以判断C与B结合质子的能力大小是__OH->S2-__(用化学式或离子符号表示)。 要点速记: 1.牢记的一个符号:。A表示质量数,Z表示质子数,X表示元素符号,m表示化合价数,a表示电荷数,b表示粒子中所含原子数。 2.熟记“两素”“三同”:元素、核素;同位素、同素异形体、同分异构体。 3.理解三条原子核外电子排布的规律 (1)能量最低原则。 (2)每层最多容纳2n2个电子。 (3)最外层电子数不超过8(K层为最外层不超过2),次外层电子数不超过18,倒数第三 层电子数不超过32。 4.掌握原子中的两个关系 (1)质子数=核电荷数=核外电子数=原子序数 (2)质量数(A)=质子数(Z)+中子数(N)查看更多