- 2021-05-26 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习原子结构 化学键学案
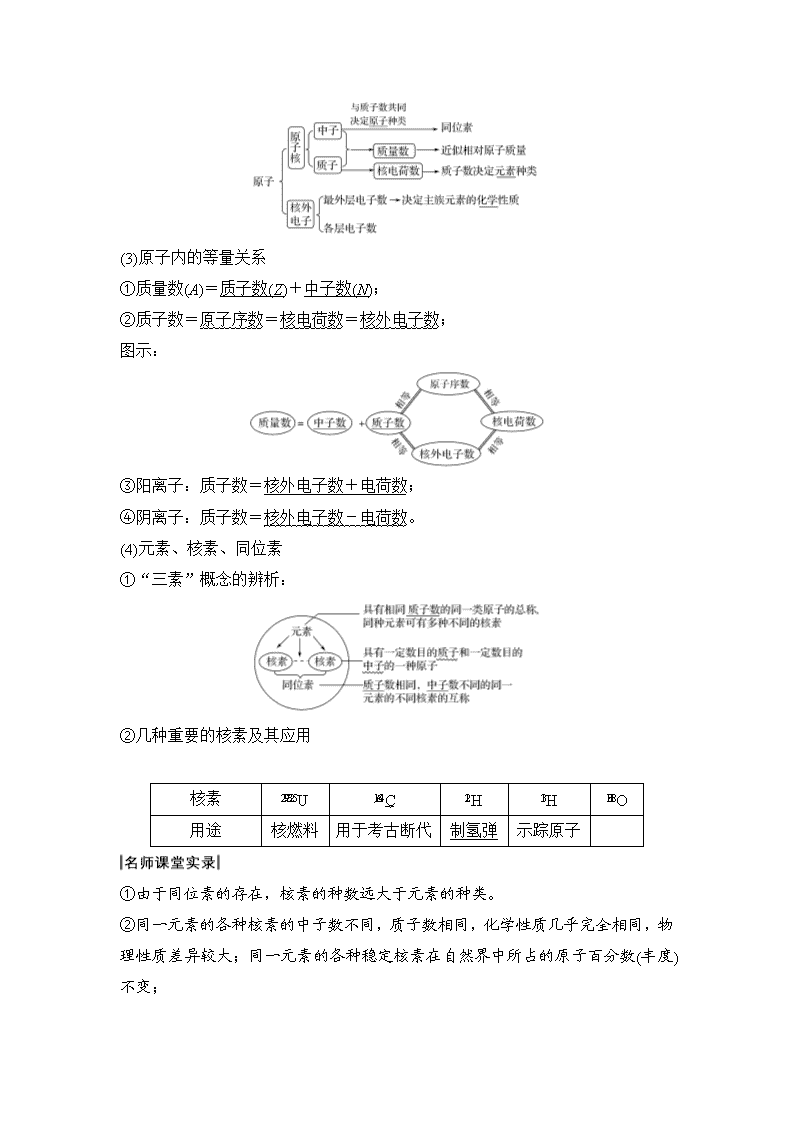
第1讲 原子结构 化学键 【2020·备考】 最新考纲:1.了解元素、核素和同位素的含义。2.了解原子的构成;了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。3.了解原子核外电子排布。4.掌握原子结构示意图。5.了解化学键的定义。6.了解离子键、共价键的形成。7.掌握电子式的表示方法。 核心素养:1.变化观念与平衡思想:认识化学键的本质是原子间的静电作用,能多角度、动态的分析化学键。2.证据推理与模型认知:能运用原子结构模型解释化学现象,揭示现象的本质与规律。3.科学探究与创新意识:能发现和提出有探究价值的原子结构与化学键的问题,确定探究目的,设计研究方案。 考点一 原子构成 (频数:★☆☆ 难度:★☆☆) 名师课堂导语 原子结构高考考查力度不是很大,注意有关概念辨析,重点掌握常见原子核外电子排布特点,根据排布特点推断元素种类,熟知常见的等电子微粒。 1.原子的构成 (1)原子的定义:原子是化学变化中的最小微粒。 ①破坏原子结构的核变不属于化学变化。 ②化学反应前后原子守恒。 (2)原子的构成 (3)原子内的等量关系 ①质量数(A)=质子数(Z)+中子数(N); ②质子数=原子序数=核电荷数=核外电子数; 图示: ③阳离子:质子数=核外电子数+电荷数; ④阴离子:质子数=核外电子数-电荷数。 (4)元素、核素、同位素 ①“三素”概念的辨析: ②几种重要的核素及其应用 核素 U C H H O 用途 核燃料 用于考古断代 制氢弹 示踪原子 ①由于同位素的存在,核素的种数远大于元素的种类。 ②同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大;同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变; ③不同核素可能具有相同的质子数,如H和H;也可能具有相同的中子数,如1C和1O;也可能具有相同的质量数,如1C和1N。 2.核外电子排布规律 (1)核外电子排布规律 (2)原子结构示意图 元素推断是本章重点,而特殊的电子层结构是常用的推断方式,对于常考元素如H、Na、C、O、S的核外电子排布特点要熟练掌握。 附录:元素的特殊的电子层结构(晨背5分钟) (1)最外层有1个电子的元素:H、Li、Na、K; (2)最外层电子数等于次外层电子数的元素:Be、Ar; (3)最外层电子数是次外层电子数2倍的元素:C; (4)最外层电子数是次外层电子数3倍的元素:O; (5)最外层电子数是内层电子数总数一半的元素:Li、P; (6)最外层电子数是次外层电子数4倍的元素:Ne; (7)次外层电子数是最外层电子数2倍的元素:Li、Si; (8)次外层电子数是其他各层电子总数2倍的元素:Li、Mg; (9)次外层电子数与其他各层电子总数相等的元素S; (10)电子层数与最外层电子数相等的元素:H、Be、Al。 [速查速测] 1.(易混点排查)正确的打“√”,错误的打“×” (1)元素原子的多样性是由构成原子的质子和中子数目引起的(√) (2)元素的化学性质主要取决于元素原子的最外层电子数(√) (3)U和U是同位素,核反应属于化学变化(×) (4)2H+核外电子数为2(×) (5)两种粒子,若核外电子排布完全相同,则其化学性质一定相同(×) 2.(教材改编题)(RJ必修2·P115改编)有以下六种原子:Li、Li、Na、Mg、6C、7N,下列相关说法不正确的是( ) A.Li和Li在元素周期表中所处的位置相同 B.6C和7N质量数相等,二者互为同位素 C.Na和Mg的中子数相同但不属于同种元素 D.Li的质量数和7N的中子数相等 答案 B 3.(思维探究题)等质量的H2O和D2O: 物质的量之比:________________ 。 中子数之比:________________ 。 质子数之比:________________ 。 电子数之比:________________ 。 答案 10∶9 8∶9 10∶9 10∶9 [A组 基础知识巩固] 1.(2019·福建厦门一中期中)在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法中正确的是( ) A.34S原子核内中子数为16 B.2H+的酸性比1H+的酸性更强 C.13C和15N原子核内的质子数相差2 D.1HO在相同条件下比1HO更易蒸发 解析 34S原子核内的中子数为34-16=18,A项错误;2H+与1H+都是氢离子,化学性质相同,即2H+的酸性与1H+的酸性相同,B项错误;13C原子的质子数为6,15N原子的质子数为7,则13C和15N原子核内的质子数相差1,C项错误;因1HO的相对分子质量为1×2+16=18,1HO的相对分子质量为1×2+18=20,则1HO的沸点低,1HO在相同条件下比1HO更易蒸发,D项正确。 答案 D 2.(2019·上海同济中学月考)月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是( ) A.He比He多一个中子 B.氦元素的近似相对原子质量为3.5 C.He的相对原子质量为 D.He的摩尔质量为bNA 解析 He比He少一个中子,A错误;不能确定核素的原子百分含量,因此不能计算氦元素的近似相对原子质量,B错误;一个原子的真实质量与一个1C原子质量的的比值是该核素的相对原子质量,因此He的相对原子质量为,C正确;He的摩尔质量为bNAg·mol-1,D错误。 答案 C 3.X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下发生如图所示变化,其中乙和丙均为10电子分子。下列说法不正确的是( ) A.元素X位于第ⅥA族 B.甲不能溶解于乙中 C.甲和丙在一定条件下能发生氧化还原反应 D.乙的沸点低于丙的沸点 解析 由题给信息和框图可以推出,X为O,Y为N,Z为H,甲为NO,乙为H2O,丙为NH3。O位于第ⅥA族,A正确;NO不溶于水,B正确;NO和NH3在一定条件下能发生氧化还原反应,C正确;H2O的沸点高于NH3的沸点,D错误。 答案 D 【练后归纳】 等电子微粒 (1)“10电子”微粒 (2)“14电子”微粒:Si、N2、CO、C2H2、C。 (3)“16电子”微粒:S、O2、C2H4、HCHO。 (4)“18电子”微粒 CH3—CH3、H2N—NH2、HO—OH、F—F、F—CH3、CH3—OH…… [B组 考试能力过关] 4.(2017·北京卷)2016年IUPAC命名117号元素为Ts(中文名“”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( ) A.Ts是第七周期第ⅦA族元素 B.Ts的同位素原子具有相同的电子数 C.Ts在同族元素中非金属性最弱 D.中子数为176的Ts核素符号是 Ts 解析 A.117号元素Ts的原子核外最外层电子数是7,可知Ts是第七周期第ⅦA族元素,正确;B.同位素是同种元素不同原子之间的互称,因此Ts的同位素原子具有相同的电子数,正确;C.根据元素周期律可知,同一主族元素从上往下非金属性依次减弱,所以Ts在同族元素中非金属性最弱,正确;D.中子数为176的Ts核素符号是Ts,错误。 答案 D 5.(海南化学)重水(D2O)是重要的核工业原料,下列说法错误的是( ) A.氘(D)原子核外有1个电子 B.1H与D互称同位素 C.H2O与D2O互称同素异形体 D.1HO与DO的相对分子质量相同 解析 A项,氘表示为H,核外有1个电子;D项,1HO的相对分子质量为20,DO的相对分子质量也为20;C项,H2O、D2O均为化合物。 答案 C 6.(新课标全国卷)短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( ) A.W2-、X+ B.X+、Y3+ C.Y3+、Z2- D.X+、Z2- 解析 结合原子序数依次增大和简单离子的电荷数,确定W、X、Y、Z分别为O、Na、Al、S四种元素,能发生水解的离子为Al3+、S2-,故C项正确。 答案 C 考点二 化学键 (频数:★★☆ 难度:★☆☆) 名师课堂导语 本考点主要考查对两种常见化学键类型的理解与判断;以及对离子化合物和共价化合物两种物质类别的判断;另外电子式的书写在二卷中也是一个重要的考查角度,特别是在理解结构的基础上对陌生物质的电子式的书写方法,要重点掌握。 1.化学键 (1)定义:相邻原子间强烈的相互作用。 (2)分类 (1)分子间作用力、氢键不属于化学键。 (2)物质中并不一定都存在化学键,如He等稀有气体分子。 2.离子键与共价键 (1)概念 ①离子键:阴、阳离子通过静电作用形成的化学键。 ②共价键:原子间通过共用电子对所形成的化学键。 (2)对比 离子键 共价键 成键粒子 阴、阳离子 原子 成键方式 得失电子形成阴、阳离子 形成共用电子对 成键条件 活泼金属元素与活泼非金属元素 一般在非金属原子之间 作用力实质 静电作用 存在举例 (1)非金属单质,如H2、O2 存在于离子化合物中,如NaCl、KCl、MgCl2、CaCl2、ZnSO4、NaOH等 等; (2)共价化合物,如HCl、CO2、CH4等; (3)某些离子化合物,如NaOH、Na2O2等 (1)离子键中的“静电作用”既包括静电吸引力又包括静电排斥力。 (2)由活泼金属与活泼非金属形成的化学键不一定都是离子键,如AlCl3中Al—Cl键为共价键。 (3)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键,如NH4Cl等。 3.化学键的表示方法——电子式 (1)概念:在元素符号周围用“·”或“×”来代表原子的最外层电子(价电子)的式子。 (2)书写 4.化学键与物质类别的关系 (1)化学键与物质类别的关系 (2)离子化合物与共价化合物 化合物类型 定 义 与物质分 类的关系 举例 离子化合物 含有离子键的化合物 包括强碱、绝大多数盐及活泼金属的氧化物 NaCl、Na2O2、 NaOH、Na2O、 NH4Cl等 共价化合物 只含有共价键的化合物 包括酸、弱碱、极少数盐、气态氢化物、非金属氧化物、大多数有机物等 H2S、SO2、 CH3COOH、 H2SO4、 NH3·H2O等 (1)不同元素的两个非金属原子构成的物质一定是共价化合物,如HCl;两种非金属元素多个原子可构成离子化合物,如NH4H。 (2)离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏;共价化合物在液态下不电离,所以熔化时导电的化合物一定是离子化合物。 [速查速测] 1.(易混点排查)正确的打“√”,错误的打“×” (1)所有物质中都存在化学键(×) (2)由活泼金属元素与活泼非金属元素形成的化学键都是离子键(×) (3)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键(×) (4)共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏(×) (5)共价化合物熔点都低于离子化合物(×) 2.(教材改编题)(RJ必修2·P259改编)有以下9种物质: ①Ne ②NH4Cl ③KNO3 ④NaOH ⑤Cl2 ⑥SO2 ⑦H2S ⑧Na2O2 ⑨MgCl2 (1)既存在离子键又存在共价键的是________。 (2)不存在化学键的是________。 (3)属于共价化合物的是________。 (4)属于离子化合物的是________。 答案 (1)②③④⑧ (2)① (3)⑥⑦ (4)②③④⑧⑨ 3.(思维探究题)对于反应:2Na2O2+2CO2===2Na2CO3+O2 断裂的化学键为:__________________________________________________。 形成的化学键为:____________________________________________________。 答案 离子键、极性和非极性共价键 离子键、极性和非极性共价键 [A组 基础知识巩固] 1.(2018·陕西西安模拟)在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( ) A.将SO2通入水中 B.烧碱溶于水 C.将HCl通入水中 D.硫酸氢钠溶于水 解析 SO2、HCl不含有离子键,所以不会有离子键的破坏过程,A、C错误;烧碱在水溶液中电离产生了钠离子和氢氧根离子,没有共价键的破坏过程,B错误;硫酸氢钠既含有离子键又含有共价键,溶于水时钠离子与硫酸氢根离子之间的离子键被破坏,同时硫酸氢根离子中的共价键也被破坏。 答案 D 2.(2018·浙江温州模拟)下列说法正确的是( ) A.碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力 B.硫酸钾和硫酸溶于水都电离出硫酸根离子,所以它们在熔融状态下都能导电 C.N2、CO2和SiO2中都存在共价键,它们都是由分子构成 D.H2和Cl2在光照条件下反应生成HCl,反应中一定有共价键的断裂和形成 解析 A项,碘晶体受热转变为碘蒸气,吸收的热量用于克服分子间作用力,碘原子间是共价键,错误;B项,硫酸是共价化合物,在熔融状态下不能导电,错误;C项,N2、CO2和SiO2中都存在共价键,N2、CO2都是由分子构成,SiO2是由原子构成,错误;D项,氢气、氯气和氯化氢中均含有共价键,因此反应中一定有共价键的断裂和形成,正确。 答案 D 3.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( ) A.d元素的非金属性最强 B.它们均存在两种或两种以上的氧化物 C.只有a与其他元素生成的化合物都是离子化合物 D.b、c、d分别与氢形成的化合物中化学键均为极性共价键 解析 根据题意,短周期元素中,a的M层电子数为1个,则a为钠元素,b的最外层电子数为内层电子数的2倍,则b为碳元素,c的最高化合价为最低化合价绝对值的3倍,则c为硫元素,结合c与d同周期,d的原子半径小于c,故d为氯元素。A项,上述元素中非金属性最强的元素是氯元素,正确;B项,钠可以形成Na2O、Na2O2两种氧化物,碳元素可以形成CO、CO2两种氧化物,S元素可以形成SO2、SO3两种氧化物,氯元素可以形成Cl2O、ClO2、Cl2O7等多种价态的氧化物,B项正确;C项,钠为活泼金属元素,可以与非金属元素C、S、Cl等形成离子化合物,正确;D项,碳元素可以与氢元素形成只含有极性键的化合物,如CH4,也可形成含有极性键和非极性键的化合物,如CH3CH3等,硫元素形成的H2S只含极性键,氯元素与氢元素形成的HCl也只含极性键,错误。 答案 D 4.已知: 化合物 MgO Al2O3 MgCl2 AlCl3 类型 离子化合物 离子化合物 离子化合物 共价化合物 熔点/℃ 2 800 2 050 714 191 工业制镁时,电解MgCl2而不电解MgO的原因是_____________________________________________________________________; 制铝时,电解Al2O3而不电解AlCl3的原因是____________________________________________________________________。 答案 MgO的熔点高,熔融时耗费更多资源,增加生产成本 AlCl3为共价化合物,熔融态难导电 【归纳总结】 化学键对物质性质的影响 1.对物理性质的影响 (1)金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为其中的共价键很强,破坏时需消耗很多的能量。 (2)NaCl等部分离子化合物,也有很强的离子键,故熔点也较高。 2.对化学性质的影响 (1)N2分子中有很强的共价键,故在通常状况下,N2性质很稳定。 (2)H2S、HI等分子中的共价键较弱,故它们受热时易分解。 [B组 考试能力过关] 5.(全国卷)下列有关化学键的叙述,正确的是( ) A.离子化合物中一定含有离子键 B.单质分子中均不存在化学键 C.含有极性键的分子一定是极性分子 D.含有共价键的化合物一定是共价化合物 解析 特别注意:离子化合物中一定含有离子键,共价化合物中一定含有共价键;含有离子键的化合物一定是离子化合物,但含有共价键的化合物不一定为共价化合物,如NaOH、NH4Cl等,故A项正确,D项错误;化学键既可以存在于化合物中,也可以存在于双原子或多原子的单质分子中,如O2、O3,故B项错误;C项中,含有极性键的分子不一定是极性分子,若分子结构对称,则为非极性分子,如CO2、CH4等为非极性分子。 答案 A 6.(2015·全国卷Ⅱ,9)原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( ) A.元素的非金属性次序为c>b>a B.a和其他3种元素均能形成共价化合物 C.d和其他3种元素均能形成离子化合物 D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 解析 a-的电子层结构与氦相同,则a为氢元素;b和c的次外层有8个电子,且最外层电子数分别为6、7,则b为硫元素,c为氯元素;d的最外层电子数为1,且c-和d+的电子层结构相同,则d为钾元素。A项,元素的非金属性次序为Cl>S>H,正确;H2S和HCl是共价化合物,KH、K2S和KCl是离子化合物,B项错误,C项正确;D项,氢、硫、氯三种元素的最高和最低化合价分别为+1和-1、+6和-2、+7和-1,因此它们各自最高和最低化合价的代数和分别为0、4、6,正确。 答案 B查看更多