- 2021-05-26 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习通用版11-5高考重难晶体结构的分析与计算学案
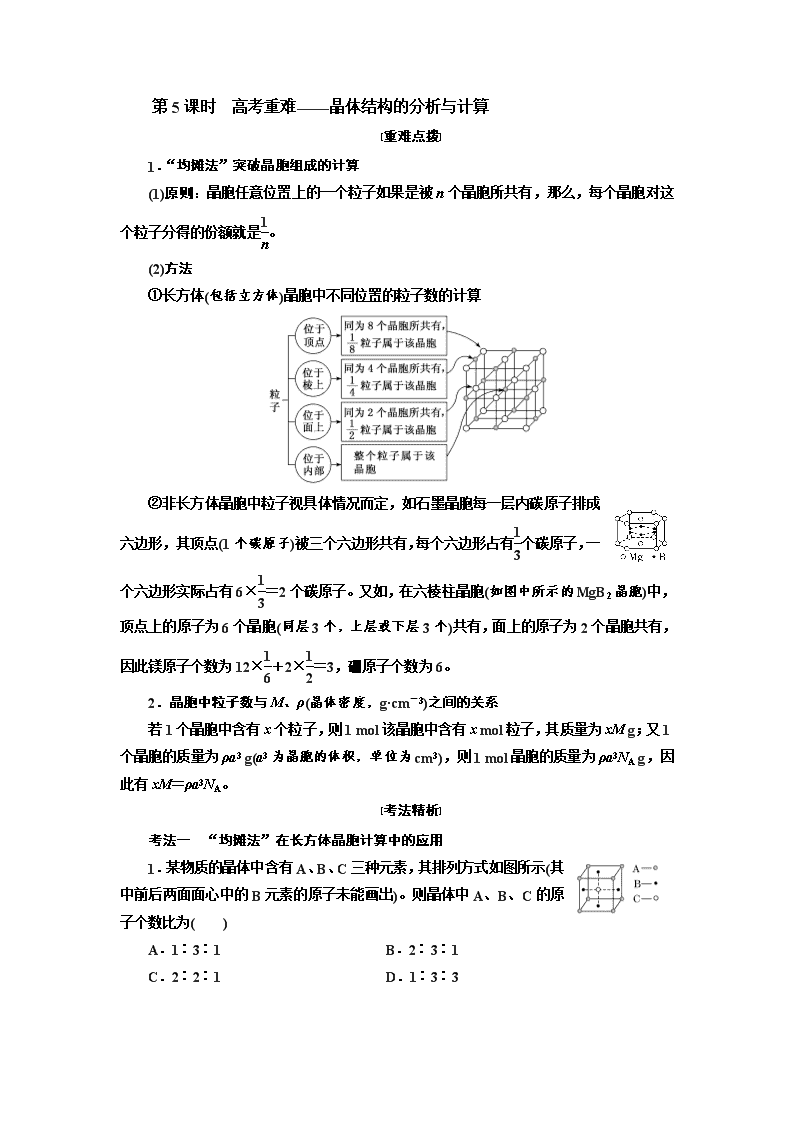
第5课时 高考重难——晶体结构的分析与计算 [重难点拨] 1.“均摊法”突破晶胞组成的计算 (1)原则:晶胞任意位置上的一个粒子如果是被n个晶胞所共有,那么,每个晶胞对这个粒子分得的份额就是。 (2)方法 ①长方体(包括立方体)晶胞中不同位置的粒子数的计算 ②非长方体晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占有个碳原子,一个六边形实际占有6×=2个碳原子。又如,在六棱柱晶胞(如图中所示的MgB2晶胞)中,顶点上的原子为6个晶胞(同层3个,上层或下层3个)共有,面上的原子为2个晶胞共有,因此镁原子个数为12×+2×=3,硼原子个数为6。 2.晶胞中粒子数与M、ρ(晶体密度,g·cm-3)之间的关系 若1个晶胞中含有x个粒子,则1 mol该晶胞中含有x mol粒子,其质量为xM g;又1个晶胞的质量为ρa3 g(a3为晶胞的体积,单位为cm3),则1 mol晶胞的质量为ρa3NA g,因此有xM=ρa3NA。 [考法精析] 考法一 “均摊法”在长方体晶胞计算中的应用 1.某物质的晶体中含有A、B、C三种元素,其排列方式如图所示(其中前后两面面心中的B元素的原子未能画出)。则晶体中A、B、C的原子个数比为( ) A.1∶3∶1 B.2∶3∶1 C.2∶2∶1 D.1∶3∶3 解析:选A 据题图知,该晶胞中A原子个数=8×=1,B原子个数=6×=3,C 原子个数=1,所以晶体中A、B、C的原子个数比为1∶3∶1。 2.某晶体结构最小的重复单元如图。A为阴离子,在立方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( ) A.B2A B.BA2 C.B7A4 D.B4A7 解析:选B 根据均摊法,该结构单元中含A的个数为8,含B的个数为8×+6×=4,B与A的个数之比为4∶8=1∶2,即该晶体的化学式为BA2。 考法二 “均摊法”在非长方体晶胞计算中的应用 3.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( ) A.3∶9∶4 B.1∶4∶2 C.2∶9∶4 D.3∶8∶4 解析:选B 图示晶胞中,含A粒子个数为6×=,含B粒子个数为6×+3×=2,含C粒子个数为1,N(A)∶N(B)∶N(C)=∶2∶1=1∶4∶2。 4.石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合。据图分析,石墨晶体中碳原子数与共价键数之比为( ) A.2∶3 B.2∶1 C.1∶3 D.3∶2 解析:选A 每个碳原子被3个六边形共用,每个共价键被2个六边形共用,则石墨晶体中碳原子数与共价键数之比为∶=2∶3。 5.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的。如图是Mn和Bi形成的某种晶体的结构示意图(白球均在六棱柱内),则该晶体物质的化学式可表示为( ) A.Mn2Bi B.MnBi C.MnBi3 D.Mn4Bi3 解析:选B 由晶体的结构示意图可知:白球代表Bi原子,且均在六棱柱内,所以Bi为6个。黑球代表Mn原子,个数为12×+2×+1+6×=6(个),则二者的原子个数比为1∶1。 考法三 晶胞中粒子数与M、ρ之间的关系计算 6.(2019·信阳模拟)已知CsCl晶体的密度为ρ g·cm-3,NA 为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( ) A.NA·a3·ρ B. C. D. 解析:选A 该立方体中含1个Cl-,Cs+个数=8×=1,根据ρV=知,M=ρVNA=ρa3NA,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量是ρa3NA。 7.食盐晶体的结构示意图如图所示。已知食盐的密度为ρ g·cm-3,摩尔质量为M g·mol-1,阿伏加德罗常数为NA,则在食盐晶体中Na+和Cl-的间距大约是( ) A. cm B. cm C. cm D. cm 解析:选B 食盐晶胞中含有4个Na+和4个Cl-,每个晶胞的体积为 cm3,设食盐晶体里Na+和Cl-的间距为x cm,所以可得(2x)3=,解得x= ,即在食盐晶体中Na+和Cl-的间距大约是 cm。 8.用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,棱长为361 pm。又知铜的密度为9.00 g·cm-3,则铜晶胞的体积是________cm3、晶胞的质量是____________g,阿伏加德罗常数为____________。[列式计算,已知Ar(Cu)=63.6]。 解析:体积=(3.61×10-8)3 cm3=4.70×10-23 cm3(a为棱长);质量=体积×密度=4.70×10-23 cm3×9.00 g·cm-3=4.23×10-22 g;一个铜晶胞含4个铜原子,则4×Ar(Cu)=NA·m(晶胞),NA==≈6.014×1023 mol-1。 答案:4.70×10-23 4.23×10-22 NA==≈6.014×1023 mol-1 9.O和Na能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为________;晶胞中O原子的配位数为____________;列式计算晶体F的密度(g·cm-3):________________。 解析:O2-半径大于Na+半径,由F的晶胞结构可知,大球代表O2 -,小球代表Na+,每个晶胞中含有O2-个数为8×+6×=4,含有Na+个数为8,故O2-、Na+离子个数之比为4∶8=1∶2,从而推知F的化学式为Na2O。由晶胞结构可知,每个O原子周围有8个Na原子,故O原子的配位数为8。晶胞参数a=0.566 nm=0.566×10-7 cm,则晶胞的体积为(0.566×10-7 cm)3,从而可知晶体F的密度为≈2.27 g·cm-3。 答案:Na2O 8 ≈2.27 g·cm-3查看更多