- 2021-05-26 发布 |
- 37.5 KB |
- 21页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版化学反应速率学案(2)
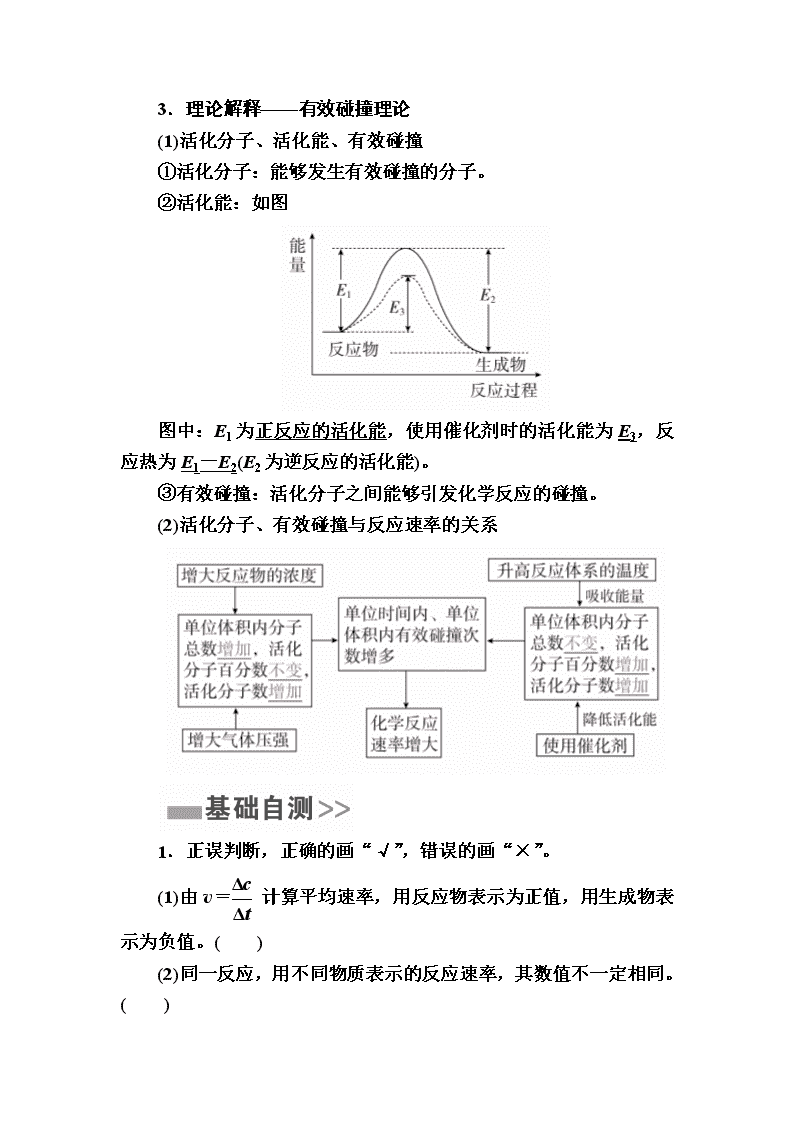
第七章 化学反应速率 化学平衡 第23讲 化学反应速率 1.化学反应速率 2.化学反应速率的影响因素 (1)内因(根本因素) 反应物本身的性质。 (2)外因(其他条件不变,只改变一个条件) 3.理论解释——有效碰撞理论 (1)活化分子、活化能、有效碰撞 ①活化分子:能够发生有效碰撞的分子。 ②活化能:如图 图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2(E2为逆反应的活化能)。 ③有效碰撞:活化分子之间能够引发化学反应的碰撞。 (2)活化分子、有效碰撞与反应速率的关系 1.正误判断,正确的画“√”,错误的画“×”。 (1)由v= 计算平均速率,用反应物表示为正值,用生成物表示为负值。( ) (2)同一反应,用不同物质表示的反应速率,其数值不一定相同。( ) (3)化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1。( ) (4)固体和纯液体的浓度是固定的,增加固体或纯液体的用量,反应速率保持不变。( ) (5)对于反应:2H2O2===2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率。( ) (6)已知反应①N2+3H2??2NH3 ΔH<0,反应②C+CO2===2CO ΔH>0,升温时,反应①速率增大,反应②速率减小。( ) (7)增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率。( ) (8)反应C(s)+H2O(g)===CO(g)+H2(g)在固定容积的容器中进行,充入N2后,体系压强增大,反应速率加快。( ) (9)FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同。( ) 答案 (1)× (2)√ (3)× (4)√ (5)√ (6)× (7)× (8)× (9)× 2.下列说法正确的是( ) ①活化分子间的碰撞一定能发生化学反应 ②普通分子有时也能发生有效碰撞 ③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数 ④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多 ⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大 ⑥化学反应实质是活化分子有合适取向时的有效碰撞 A.①②⑤ B.③④⑥ C.③④⑤⑥ D.②③④ 答案 B 解析 ①活化分子间的碰撞不一定为有效碰撞,则不一定发生化学反应,错误;②普通分子间的碰撞,达不到反应所需的能量,则不能发生化学反应,错误;③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数,正确;④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多,正确;⑤使用催化剂能提高反应速率,原因是降低了活化能,使有效碰撞频率增大,错误;⑥活化分子有合适取向时发生的碰撞一定发生化学反应,正确。 考点1 化学反应速率 题型一 反应速率的基本计算 典例1 NH3和纯净的O2在一定条件下发生反应: 4NH3(g)+3O2(g)??2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min 后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( ) A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1 C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.250 mol·L-1·min-1 解析 设4 min时,生成6x mol H2O(g) 据题意,有=0.4解得:x=0.5, 则4 min内H2O的变化浓度为:Δc(H2O)==1.5 mol·L-1,v (H2O)==0.375 mol·L-1·min-1,再由各物质表示的速率之比等于各物质的化学计量数之比,可得各物质表示的反应速率分别为v(N2)=0.125 mol·L-1·min-1,v(NH3)=0.250 mol·L-1·min-1,v(O2)=0.1875 mol·L-1·min-1。 答案 C 名师精讲 1.有关化学反应速率的注意事项 (1)化学反应速率一般指平均速率而不是某一时刻的瞬时速率,且无论用反应物还是用生成物表示均取正值。 (2)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同,其数值之比等于反应方程式的化学计量数之比。 (3)不能用固体或纯液体物质表示化学反应速率,因为固体或纯液体物质的浓度视为常数。 2.化学反应速率计算的三个方法 (1)定义式法:v(B)==。 (2)比例关系法:化学反应速率之比等于化学计量数之比,如mA(g)+nB(g)===pC(g)中,v(A)∶v(B)∶v(C)=m∶n∶p。 (3)三段式法:列起始量、转化量、最终量,再根据定义式或比例关系计算。 1.在一定条件下发生反应2A(g)===2B(g)+C(g),将2 mol A通入2 L容积恒定的密闭容器甲中,若维持容器内温度不变,5 min末测得A的物质的量为0.8 mol。用B的浓度变化来表示该反应的速率为 ( ) A.0.24 mol/(L·min) B.0.08 mol/(L·min) C.0.06 mol/(L·min) D.0.12 mol/(L·min) 答案 D 解析 v(A)===0.12 mol/(L·min),v(B)=v(A)=0.12 mol/(L·min)。 2.一定温度下,向一个容积为2 L的真空密闭容器中(事先装入催化剂)通入1 mol N2和3 mol H2,3 min后测得密闭容器内的压强是起始时的0.9倍,在此时间内v(H2)是 ( ) A.0.2 mol/(L·min) B.0.6 mol/(L·min) C.0.1 mol/(L·min) D.0.3 mol/(L·min) 答案 C 解析 由: N2 + 3H22NH3 初始/mol 1 3 0 变化/mol x 3x 2x 3 min末/mol 1-x 3-3x 2x 又由同温同体积下压强之比等于物质的量之比,所以 =0.9,解得x=0.2, 所以v(H2)==0.1 mol/(L·min)。 题型二 反应速率的大小比较 典例2 (2017·长沙模拟)反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1。 下列有关反应速率的比较中正确的是( ) A.④>③=②>① B.①>④>②=③ C.①>②>③>④ D.④>③>②>① 解析 用比值法进行反应速率大小的比较,v(A)=0.45 mol·L-1·s-1;v(B)=×0.6=0.2 mol·L-1·s-1;v(C)=×0.4=0.2 mol·L-1·s-1;v(D)=×0.45=0.225 mol·L-1·s-1,故①>④>②=③,B项正确。 答案 B 名师精讲 化学反应速率大小的比较方法 (1)同一物质比较法。换算成同一物质表示的速率,再比较数值的大小。 (2)归一法。当化学反应速率单位一致时,可用各物质的速率除以该物质前面的化学计量数,即全部“归一”,然后比较,数值大的反应速率最大。 注意 无论采用何种方法,都要确保所比较物质的单位统一。 3.在四个不同的容器中,在不同的条件下进行合成氨反应:N2+3H2??2NH3。根据在相同时间内测定的结果判断,生成氨的速率最快的是( ) A.v(H2)=0.01 mol·L-1·s-1 B.v(N2)=0.3 mol·L-1·min-1 C.v(NH3)=0.15 mol·L-1·min-1 D.v(H2)=0.3 mol·L-1·min-1 答案 B 解析 在速率单位相同时,把速率除以其相应物质的化学计量数,数值大者,反应速率快。A项,v(H2)=0.01 mol·L-1·s-1=0.6 mol·L-1·min-1,v(H2)=0.2 mol·L-1·min-1;B项,v(N2)=0.3 mol·L-1·min-1;C项,v(NH3)=0.075 mol·L-1·min-1,D项,v(H2)=0.1 mol·L-1·min-1。由此可知,B项中表示的反应速率最快。 4.已知:4NH3(g)+5O2(g)??4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(mol·L-1·min-1)表示,则正确的关系式是( ) A.v(NH3)=v(O2) B.v(O2)=v(H2O) C.v(NH3)=v(H2O) D.v(O2)=v(NO) 答案 D 解析 根据化学反应速率之比等于化学计量数之比可知,v(O2)=v(NH3)、v(H2O)=v(O2)、v(H2O)=v(NH3)、v(NO)=v(O2),D项正确。 考点2 化学反应速率的影响因素 典例3 (全国卷Ⅰ)已知分解1 mol H2O2放出热量98 kJ在含少量I-的溶液中,H2O2分解的机理为: H2O2+I-―→H2O+IO- 慢 H2O2+IO-―→H2O+O2+I- 快 下列有关该反应的说法正确的是( ) A.反应速率与I-浓度有关 B.IO-也是该反应的催化剂 C.反应活化能等于98 kJ·mol-1 D.v(H2O2)=v(H2O)=v(O2) 解析 H2O2的分解速率主要是由第一个反应决定的,I-浓度越大,反应速率越快,A项正确;根据总反应可确定该反应的催化剂为I-,而IO-为中间产物,B项错误;根据所给信息无法确定反应活化能,C项错误;反应速率关系为v(H2O2)=2v(O2),D项错误。 答案 A 名师精讲 1.压强对于有气体参与的化学反应速率的影响 (1)恒温时,压缩体积压强增大反应物浓度增大 反应速率增大。 (2)恒温时,对于恒容密闭容器。 ①充入气体反应物气体反应物浓度增大(压强也增 大)反应速率增大。 ②充入“惰性”气体总压强增大―→反应物浓度未改 变―→反应速率不变。 (3)恒温恒压时,充入“惰性”气体体积增大气体反 应物浓度减小反应速率减小。 2.温度对反应速率影响的两点说明 (1)升高温度,不管是放热反应还是吸热反应,反应速率都增大,但吸热反应速率增大的幅度更大; (2) 降低温度,不管是放热反应还是吸热反应,反应速率都减小,但吸热反应速率减小的幅度更大。 5.一定温度下,在某密闭容器中发生反应:2HI(g)??H2(g)+I2(s) ΔH>0,若在15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( ) A.0~15 s内用I2表示的平均反应速率为v(I2)=0.002 mol·L-1·s-1 B.c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s C.升高温度正反应速率加快,逆反应速率减慢 D.减小反应体系的体积,化学反应速率加快 答案 D 解析 该温度下,I2为固体,不能用来表示化学反应速率,A项错误;0~15 s内,v(HI)==0.002 mol·L-1·s-1,若反应速率不变,c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需反应时间应为10 s,但随着反应的进行,c(HI)减小,v(HI)也减小,故所需时间应大于10 s,B项错误;升高温度,正逆反应速率都增大,C项错误;减小反应体系的体积压强增大,反应速率加快,D项正确。 6.反应C(s)+H2O(g)??CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是 ( ) ①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大 A.①④ B.②③ C.①③ D.②④ 答案 C 解析 ①固体用量的改变对速率没有影响,正确;②容器的体积缩小一半,压强增大,速率增大,错误;③保持体积不变,充入N2 使体系压强增大,但各物质的浓度保持不变,速率不变,正确;④保持压强不变,充入N2使容器体积变大,各物质的浓度减小,速率减小,错误。 微专题 “控制变量法”探究影响化学反应速率的因素 利用“控制变量法”的解题策略 典例 草酸与高锰酸钾在酸性条件下能够发生如下反应: MnO+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平) 用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如表所示: (1)该反应中氧化剂和还原剂的物质的量之比为__________。 (2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同):如果研究温度对化学反应速率的影响,使用实验______和______。 (3)对比实验Ⅰ和Ⅳ,可以研究____________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是____________。 解析 (1)MnOMn2+,H2C2O42CO2。 根据氧化还原反应中氧化剂得电子数目等于还原剂失电子数目可确定MnO与H2C2O4的物质的量之比为 2∶5。 (2)实验Ⅰ与实验Ⅱ中反应物浓度相同,温度相同,实验Ⅱ中加入MnSO4溶液,应是研究催化剂对化学反应速率的影响,实验Ⅰ与实验Ⅲ中温度不同,其他条件相同,应是对比考查温度对化学反应速率的影响。 (3)实验Ⅰ与实验Ⅳ相比,实验Ⅳ中H2SO4的浓度不同,是研究c(H+)对反应速率的影响。 答案 (1)2∶5 (2)Ⅰ Ⅱ Ⅰ Ⅲ (3)c(H+)(或硫酸溶液的浓度) 确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变 (建议用时:40分钟) 一、选择题(每题7分,共63分) 1.下列有关化学反应速率的认识正确的是( ) A.对于任何化学反应来说,化学反应速率越大,反应现象就越明显 B.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加 C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故化学反应速率增大 D.H+和OH-的反应活化能接近于零,反应几乎在瞬间完成 答案 D 解析 反应速率的大小与反应现象是否明显没有直接关系,如H+和OH-的反应几乎在瞬间完成,没有明显现象,A项错误,D项正确;固体或纯液体的浓度是常数,即Δc=0,所以一般不用固体或纯液体表示化学反应速率,B项错误;催化剂不改变分子的能量,分子运动没有加快,C项错误。 2.(2017·哈尔滨师大附中高三测试)一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2,发生反应N2+3H2??2NH3,2 min时测得剩余N2为1 mol,下列化学反应速率表示不正确的是( ) A.v(N2)=0.25 mol/(L·min) B.v(H2)=0.75 mol/(L·min) C.v(NH3)=1 mol/(L·min) D.v(NH3)=0.5 mol/(L·min) 答案 C 解析 一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2,2 min时测得剩余N2为1 mol,故2 min 内,以N2表示的反应速率v(N2)==0.25 mol/(L·min),A项正确;由于反应速率之比等于化学计量数之比,故v(H2)=3v(N2)=3×0.25 mol/(L·min)=0.75 mol/(L·min),B正确;v(NH3)=2v(N2)=2×0.25 mol/(L·min)=0.5 mol/(L·min),C错误,D正确。 3.对于反应A(g)+3B(s)===2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( ) A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1 C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·s-1 答案 D 解析 本题可以通过方程式的计量数将不同物质表示的反应速率折算成同一物质表示的反应速率进行比较,B项中的B物质是固体,不能表示反应速率;C项中对应的v(A)=0.2 mol·L-1·min-1;D 项中对应的v(A)=3 mol·L-1·min-1。 4.下列说法正确的是( ) A.增大压强,活化分子百分数增加,化学反应速率一定增大 B.升高温度,单位体积内分子总数不变,但活化分子数增加了 C.分子间所有的碰撞均为有效碰撞 D.加入反应物,会使活化分子百分数增加,导致反应速率增大 答案 B 解析 压强对反应速率的影响只能适用于气体体系,且增大压强,活化分子百分数不变,A错误;升高温度,活化分子百分数增加,B正确;只有能发生化学反应的碰撞才是有效碰撞,C错误;加入反应物,活化分子百分数不一定变,D错误。 5.在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)??2HI(g) ΔH<0,下列说法正确的是 ( ) A.保持容器容积不变,向其中加入1 mol H2(g),反应速率一定加快 B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快 C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快 D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率一定加快 答案 A 解析 A项,增大氢气的物质的量且保持容器容积不变,氢气的浓度增大,反应速率加快,正确;B项,保持容器容积不变,向其中加入1 mol N2(N2不参加反应) ,反应混合物各组分的浓度不变,反应速率不变,错误;C项,保持容器气体压强不变,向其中充入1 mol N2(N2不参加反应),容器体积增大,各组分浓度减小,反应速率减小,错误;D项,保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),因体积增大为2倍,物质的量增大为2倍,则浓度不变,反应速率不变,错误。故选A。 6.下列措施对增大反应速率明显有效的是( ) ①Al在氧气中燃烧生成Al2O3,将Al片改成Al粉 ②Fe与稀硫酸反应制取H2时,改用98%浓硫酸 ③Zn与稀硫酸反应制取H2时,滴加几滴CuSO4溶液 ④在K2SO4与BaCl2两溶液反应时,增大压强 ⑤2SO2+O22SO3 ΔH<0,升高温度 ⑥Na与水反应时,增大水的用量 ⑦2H2O2===2H2O+O2↑反应中,加入少量MnO2 ⑧H2与Cl2混合后,光照 A.①②③④⑤ B.①③④⑤⑥ C.①③⑤⑦⑧ D.①③④⑦⑧ 答案 C 解析 ①将Al片改成Al粉,增大了固体反应物的接触面积,反应速率加快,正确;②铁遇浓H2SO4钝化,错误;③Zn置换出Cu,两者形成原电池,反应速率加快,正确;④没有气体参与的反应,压强不影响反应速率,错误;⑤升高温度,反应速率加快,正确;⑥固体与纯液体用量的增加,不会影响反应速率,错误;⑦催化剂加快反应速率,正确;⑧H2与Cl2混合后光照发生爆炸,反应速率加快,正确。 7. 一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( ) A.该反应的化学方程式为3B+4D??6A+2C B.反应进行到1 s时,v(A)=v(D) C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1 D.反应进行到6 s时,各物质的反应速率相等 答案 C 解析 由图可知,B、C为反应物,A、D为生成物,由于各物质的物质的量变化之比等于化学方程式中化学计量数之比,Δn(A)∶Δn(B)∶Δn(C)∶Δn(D)=6∶3∶4∶2,所以化学方程式为3B+4C??6A+2D,A项错误;在任何时刻,用各物质表示的速率之比都等于化学计量数之比,故B、D选项错误。 8.下列表格中的各种情况,可以用下面对应选项中的图像曲线表示的是( ) 答案 C 解析 由于K比Na活泼,故相同大小的金属K和Na与水反应,K的反应速率快,又由于Na、K与H2O反应均为放热反应,随反应进行,放出大量热,反应速率逐渐加快,故A图像不正确;由于起始时乙中H2C2O4浓度大,故其反应速率比甲中快,B图像错误;由于甲反应是在热水中反应,温度高,故甲的反应速率高于乙的,随反应进行,反应物浓度逐渐减小,故甲、乙中反应速率逐渐减小,C图像正确;MnO2在H2O2分解过程中起催化作用,故乙的反应速率大于甲的,D图像错误。 9. 把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图坐标曲线来表示。下列推论错误的是( ) A.O~a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 B.b~c段产生氢气的速率增加较快的主要原因之一是温度升高 C.t>c时产生氢气的速率降低主要是因为溶液中c(H+)降低 D.t=c时反应处于平衡状态 答案 D 解析 铝与硫酸的反应不是可逆反应,不存在平衡状态。 二、非选择题(共37分) 10.(18分)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)??N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1 ℃时,不同时间测得各物质的浓度如下表所示: (1)10~20 min内,N2的平均反应速率v(N2)=___________。 (2)30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(填字母序号)。 A.通入一定量的NO B.加入一定量的活性炭 C.加入合适的催化剂 D.适当缩小容器的体积 (3)40 min后的反应速率________(填“一定”或“不一定”)比20~30 min内的反应速率快。 答案 (1)0.009 mol·L-1·min-1 (2)AD (3)一定 解析 (1)10~20 min时,N2的平均反应速率为 =0.009 mol·L-1· min-1; (2)各物质的浓度均增大到原来的1.2倍,所以采取的措施可以是缩小体积增大压强,也可以是加入NO增大NO的浓度,因此AD正确。 11.(19分)某课外兴趣小组用实验的方法对影响化学反应速率的因素进行探究。实验Ⅰ:利用Ag、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。 甲同学研究的实验报告如下表: (1)该同学的实验目的是_____________________________;要得出正确的实验结论,还需控制的实验条件是________________。 (2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置进行定量实验。完成该实验应选用的实验药品可以是 __________________________________________________________ (从题中所给药品中挑选)。 实验Ⅱ: 已知:2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现在开始的一段时间,反应速率较慢,溶液褪色不明显;但不久后溶液突然褪色,反应速率明显加快。 (3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,还可能是___________________________________的影响。 (4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是________(填序号)。 A.硫酸钾 B.硫酸锰 C.氯化锰 D.水 答案 (1)探究反应物本身的性质对反应速率的影响 温度相同 (2)Mg(或Fe)、0.5 mol·L-1硫酸和2 mol·L-1硫酸 (3)催化剂(或硫酸锰或Mn2+的催化作用) (4)B 解析 (1)Ag、Fe、Mg和等体积的2 mol·L-1硫酸反应,是探究反应物本身的性质对反应速率的影响;要得出正确的实验结论,还需控制的实验条件是在相同温度下进行。 (2)为了更精确地研究浓度对反应速率的影响,可在分液漏斗中加入不同浓度的硫酸,即0.5 mol·L-1硫酸和2 mol·L-1硫酸,而锥形瓶中加入能与酸反应的金属Mg或Fe,然后进行定量实验。 (3)实验猜想,可以从比较生成物Mn2+(过渡金属)与K+( 主族金属)的区别中找到答案,通常是过渡金属或其离子具有催化作用。 (4)要想验证Mn2+的催化作用,在做对比实验时加入硫酸锰观察反应速率是否变化即可,而氯化锰中也含Mn2+,却不能选为催化剂,原因就在于其中的Cl-易被酸性高锰酸钾溶液氧化。查看更多