- 2021-05-26 发布 |
- 37.5 KB |
- 57页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮配套课件:第7讲 铝、镁及其化合物
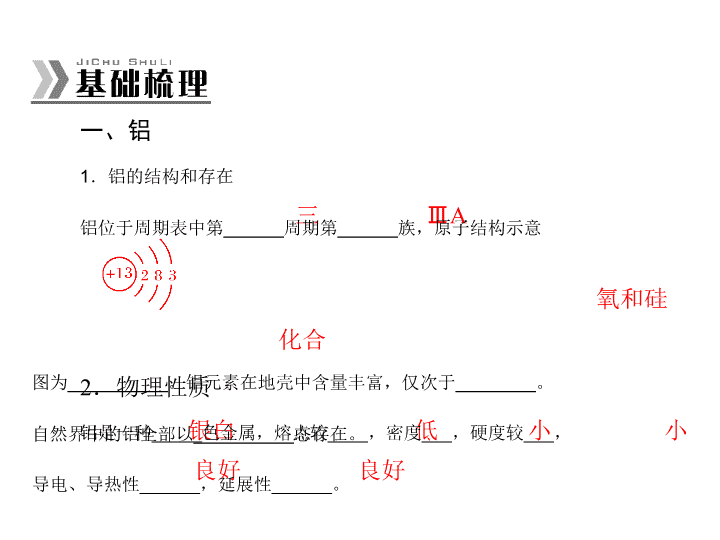
第7讲 铝、镁及其化合物 考纲定位 选项示例 1.理解Mg、Al的化 学性质。 2.了解Mg、Al的重 要化合物的主要性 质和用途。 1.将NaOH溶液缓慢滴入MgSO4溶液中, 观察Mg(OH)2沉淀的生成。(2011年广 东高考T10—B) 2.明矾能水解生成Al(OH)3胶体,可用 作净水剂。(2012年江苏高考T5—A) 3.Mg和Al都可以用电解法冶炼得到。 (2011年广东广州调研T9—A) 一、铝 三 ⅢA 氧和硅 化合 1.铝的结构和存在 铝位于周期表中第______周期第______族,原子结构示意 图为__________。铝元素在地壳中含量丰富,仅次于________。 自然界中的铝全部以__________态存在。 2.物理性质 银白 低 小 小 良好 良好 铝是一种_____色金属,熔点较____,密度___,硬度较___, 导电、导热性______,延展性______。 3.化学性质 4Al+3O2 化学性质 化学方程式 备注 ①暴露在 空气中 (与O2 反应) ___________________ 金属铝的熔点低,但其在空 气中易被氧化生成致密的且 熔点高的__________,故在 生活中可用铝制器皿来烹制 或盛放食物 ②燃烧(与 O2反应) 2Al2O3 — ③与酸反 应(与HCl 反应) ___________________ ___________________ 当金属铝与冷浓硫酸接触时 会发生_______,表面形成 致密的________,故可用铝 制容器来盛放冷浓硫酸 4Al+3O2===2Al2O3 氧化膜 2Al+6HCl=== 2AlCl3+3H2↑ 钝化 氧化膜 化学性质 化学方程式 备注 ④与碱反应 (与 NaOH 反 应) ________________________ ________________________ — ⑤铝热反应 ________________________ — ⑥铝的工业 制备 电解 2Al2O3(熔融) ===== 冰晶石 — (续表) 4Al+3O2↑ 2Al+2NaOH+2H2O ===2NaAlO2+3H2↑ 二、铝的氧化物与氢氧化物 2Al(OH)3 化学式 Al2O3 Al(OH)3 ①类别 ________氧化物 ________氢氧化物 ②颜色状态 白色固体 白色粉末 ③溶解性 ______溶于水 ______溶于水 ④热稳定性 稳定 _______________ ⑤与强酸反应 (离子方程式) _______________ _______________ _______________________ _______________________ 两性 两性 难 难 Al2O3+3H2O Al2O3+6H+=== 2Al3++3H2O Al(OH)3+3H+=== Al3++3H2O (续表) 化学式 Al2O3 Al(OH)3 ⑥与强碱反应 (离子方程式) ________________ ______________ ______________________ ______________________ ⑦制备方法 (化学方程式) — AlCl3+3NH3·H2O=== ______________________ 用途 耐火材料 净水剂、胃酸中和剂 Al(OH)3↓+3NH4Cl 三、明矾与偏铝酸盐 1.明矾[KAl(SO4)2·12H2O] KAl(SO4)2·12H2O 俗称明矾,是无色晶体,易溶于水,常用 作净水剂、吸附剂。用于净水时,反应的离子方程式:Al3++ 3H2O===____________________。 Al(OH)3(胶体)+3H+ 2.偏铝酸钠 偏铝酸钠的化学式为____________,加入同一种酸的量不 同,生成物也不同。试写出偏铝酸钠与下列物质反应的离子方 程式:(1)少量盐酸:____________________________________。 (2)过量盐酸:_____________________________________。 (3)少量 CO2:_____________________________________。 (4)过量 CO2:______________________________________。 NaAlO2 四、镁及其化合物 1.镁 发出耀眼的白光 Mg3N2 2MgO+C Mg(OH)2+H2↑ Mg2++H2↑ 2.氧化镁和氢氧化镁 物质 MgO Mg(OH)2 类别 ________氧化物 中强碱 与水反应 MgO+H2O=== Mg(OH)2(缓慢化 合) 不反应 与盐酸反应 (离子方程式) _______________ _______________ ____ _______________ _______________ ____ 碱性 MgO+2H+=== Mg2++H2O Mg(OH)2+2H+=== Mg2++2H2O 考点1 “铝三角”的相互转化关系及图像分析 1.“铝三角” 图 2-7-1 2.图像分析 (续表) (续表) 【例1】将一定质量的镁、铝合金投入一定浓度的 100 mL 盐酸中,使合金全部溶解,向所得溶液中滴加 5.00 mol·L-1 的 NaOH 溶液至过量,生成沉淀的质量与加入 NaOH 溶液的体积 图 2-7-2 的关系如图 2-7-2 所示。 试求:(1)原合金中 铝的质量分数。 (2)盐酸的物质的量 浓度。 思路指导:本题生成的沉淀有Mg(OH)2 和Al(OH)3,生成 沉淀达到最大量后,减少的质量为Al(OH)3 的质量,由消耗的 NaOH 的量通过计算可分别求出合金中镁、铝的质量。而盐酸 的物质的量浓度可由生成沉淀达到最大量时所消耗的NaOH 的 量求取。解析:观察图像可知:①镁、铝溶于盐酸后,盐酸过量, 中和过量的盐酸消耗NaOH 溶液20 mL。②当沉淀质量不变时, 此时沉淀(11.6 g)只有Mg(OH)2,则沉淀达到最大量时,Al(OH)3 的质量为(19.4-11.6)g,沉淀减少的过程中,消耗的NaOH 溶 液用于溶解Al(OH)3。 则c(HCl)=—= (2)由图像可知,完全沉淀时消耗NaOH 溶液的物质的量, 相当于中和剩余的盐酸和溶解Mg、Al 所消耗盐酸的总量,即 n(HCl)=0.16 L×5.00 mol·L-1=0.80 mol。n V 0.80 mol 0.10 L =8.00 mol·L-1 答:略。 【例2】(2013 年江苏南京模拟)在硝酸铝和硝酸镁的混合 溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧 化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )。 解析:向混合溶液中加入NaOH 溶液的过程中,Mg(NO3)2 会生成难溶物Mg(OH)2,Al(NO3)3 会生成难溶物Al(OH)3,随 着NaOH 溶液的加入,Al(OH)3 逐渐溶解,而Mg(OH)2 不能溶 解。 答案:C 考点2 利用滴加顺序不同的方法鉴别物质 2.NaAlO2 和盐酸:向 NaAlO2 溶液中逐滴滴加盐酸,先出 现白色沉淀,后沉淀消失: 【例3】下列各组溶液,只要用试管和胶头滴管,不用任 何试剂就可以鉴别的是( )。 思路指导:做题时,要认真阅读题干信息,由“不用任何 试剂”“只用试管和胶头滴管”可知,只能通过物理性质(如颜 色、状态等)或滴加顺序不同出现的现象不同而进行鉴别。 A.KOH和Al2(SO4)3 B.稀H2SO4和NaHCO3 C.CaCl2和Na2CO3 D.Ba(OH)2和NaHSO4 解析:向Al2(SO4)3 溶液中逐滴滴加KOH 溶液,先出现白 色沉淀后,沉淀消失;向KOH 溶液中逐滴滴加Al2(SO4)3 溶液, 开始无现象,后出现白色沉淀。答案:A 【例 4】(2012 年辽宁锦州模拟)只用试管和胶头滴管就可 以鉴别的下列各组溶液是( )。 ①AlCl3 溶液和 NaOH 溶液;②Ca(HCO3)2 溶液和 NaOH 溶 液;③NaAlO2 溶液和盐酸;④Al2(SO4)3 溶液和氨水。 A.①③ C.②③④ B.①②③ D.③④ 解析:①向AlCl3 溶液中滴加NaOH 溶液,随加入量依次 观察到的现象为出现白色沉淀,沉淀后溶解,向NaOH 溶液中 滴加AlCl3 溶液,产生沉淀,沉淀立刻消失,继续滴加至AlCl3 溶液过量,白色沉淀不溶解;②只有白色沉淀;③向NaAlO2 溶液中滴加盐酸,先出现白色沉淀,后沉淀溶解,向稀盐酸中 滴加NaAlO2 溶液,产生白色沉淀,但沉淀立刻消失,继续滴加 至NaAlO2 溶液过量,白色沉淀不溶解;④只有Al(OH)3 白色沉 淀。 答案:A 规律方法 有关铝及其化合物的定量计算 1.酸碱抵消法在计算中的应用 一般格式: 当沉淀量达最大值时,n(H+)=n(OH-)。 原金属质量+结合的OH 质量。 金属溶于酸,再加碱生成沉淀的质量的求法: 所以金属失去n mol 电子,就结合n mol OH-,沉淀质量= - 【例5】Al 和 Al2O3 的混合物 15 g,加入稀硫酸 150 mL, 在标准状况下放出氢气 1.68 L,Al 和 Al2O3 均不剩余,为中和 过量的硫酸,并使溶液中的 Al3+恰好完全转化为 Al(OH)3 沉淀,需要消耗 3 mol·L-1 的 NaOH 溶液 200 mL,则该稀硫酸的物质 的量浓度为( )。 A.2.25 mol·L-1 C.0.3 mol·L-1 B.2 mol·L L-1 D.0.6 mol·L-1 解析: 根据最终溶液中电荷守恒和化学反应中质量守恒可得: 答案:B 2.铝及其化合物常见题型的计算 图 2-7-3 ①n(Al3+)=(b-a)mol; ②n(Mg2+)=4a-3b 2 mol。 【例6】(2013年辽宁模拟)将一定量的钠铝合金置于水中, 合金全部溶解,得到 20 mL pH=14 的溶液,然后用 1 mol·L-1 的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图 2-7-4 所示,则下列选项正确的是( )。 图 2-7-4 A.原合金质量为 0.92 g B.标准状况下产生氢气 896 mL C.图中 m 值为 1.56 g D.图中 V2 为 60 mL 解。当沉淀量最大时溶液中只有氯化钠,n(Na+)=n(Cl-)= 解析:据分析可知反应过程为钠与水反应生成氢氧化钠, 铝与氢氧化钠溶液反应生成偏铝酸钠,因溶液pH 为14,则说 明氢氧化钠过量,滴加盐酸后先与氢氧化钠反应,再与偏铝酸 钠反应生成氢氧化铝沉淀,继续滴加盐酸,则氢氧化铝沉淀溶 1 mol·L-1×0.04 L=0.04 mol,即合金中钠的物质的量为0.04 mol, 与水反应生成 0.04 mol NaOH,由合金全部溶解后的溶液为 20 mL,pH=14,可知铝与氢氧化钠反应后过量的氢氧化钠为 0.02 mol,则反应的氢氧化钠为0.02 mol,铝的物质的量也是 C正确。0.02 mol氢氧化铝完全溶解需1 mol·L-1的HCl 60 mL, 0.02 mol,所以原合金的质量为0.92 g+0.54 g=1.46 g。0.04 mol 钠与水反应生成0.02 mol 氢气,0.02 mol 铝与氢氧化钠溶液反应 生成0.03 mol 氢气,故标况下体积为1120 mL,B 错误。沉淀 量最大时生成氢氧化铝的质量为0.02 mol×78 g·mol-1=1.56 g, 则V2=100 mL,D错误。 答案:C 实验探究 铝及其化合物的探究实验 【例7】在一次学生实验中,某学生用铝片分别和稀盐酸、 稀硫酸反应,发现铝片和稀盐酸反应现象非常明显,而和稀硫 酸几乎不反应。这和教材上的内容“铝能跟稀盐酸或稀硫酸反 应生成氢气”不一致。为了寻找原因,该学生在老师的指导下, 重新用浓盐酸和浓硫酸配制了一定浓度的溶液,然后加入 0.1 mm×10 mm×20 mm、纯度≥99.5%的铝片验证是否确实存 在上述现象,实验结果如下表: 从上表可以看出,无论用 1.5 mol·L-1 H2SO4还是3 mol·L-1 H2SO4 均无明显现象,为了探究“铝与稀盐酸和稀硫酸反应的 差异原因”,请回答下列问题: 反应时间 1 min 2 min 5 min 15 min 20 min 3 mol·L-1 HCl 少量 气泡 较多 气泡 大量 气泡 反应 剧烈 铝片 耗尽 1.5 mol·L-1 H2SO4 均无明显现象(无气泡) 3 mol·L-1 H2SO4 均无明显现象(无气泡) 实验步骤 可能的实验现象及可能的结论 (1)请写出盐酸与铝片反应的离子方程式:______________ ____________。 (3)请设计一个实验方案对你的假设进行论证。 答案:(2)Al+6H+===2Al3++3H2↑ (2)、(3) 实验步骤 可能的实验现象及可能的结 论 取一支试管倒入1.5 mol·L-1 H2SO4 5 mL,加入约0.5 g NaCl 晶体(约0.01 mol),然后再加入 0.1 mm×10 mm×20 mm、纯度 ≥99.5%的铝片;另一支试管倒 入1.5 mol·L-1 H2SO4 5 mL,加 入约1.4 g Na2SO4晶体(约0.01 mol),然后加入0.1 mm×10 mm×20 mm、纯度≥99.5%的 铝片进行对比实验 若加NaCl晶体的试管中的反 应明显加快,而加Na2SO4晶 体的试管中反应现象仍不明 显,说明假设正确。若加 NaCl晶体的试管中的反应现 象不明显,说明假设错误 题组一 镁及其化合物 1.将相同质量的镁条分别在①氧气中;②空气中;③氮气 中;④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小 )。到大的顺序是( A.④②①③ C.③②①④ B.④①②③ D.④①③② 答案:C 解析:Mg在氧气中燃烧:2Mg+O2===2MgO; Mg在空气中燃烧:2Mg+O2===2MgO(主),3Mg+N2 === Mg3N2(微量); Mg在氮气中燃烧:3Mg+N2===Mg3N2; Mg在二氧化碳中燃烧:2Mg+CO2===2MgO+C; 依元素守恒法,1 mol Mg 燃烧生成1 mol MgO,质量增 加16 g;1 mol Mg燃烧生成1/3 mol Mg3N2,质量增加28/3 g; 1mol Mg在二氧化碳中燃烧,固体产物分别为1/2 mol C和 1 mol MgO,质量增加6 g+16 g=22 g。因此,相同质量的镁 粉若分别在上述气体中燃烧,所得固体产物的质量是在二氧 化碳中燃烧最大,应选C。 2.(2011 年广东高考)某同学通过系列实验探究 Mg 及其化 合物的性质,操作正确且能达到目的的是( )。 A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探究 Mg 的活泼性 B.将 NaOH 溶液缓慢滴入 MgSO4 溶液中,观察 Mg(OH)2 沉淀的生成 C.将 Mg(OH)2 浊液直接倒入已装好滤纸的漏斗中过滤, 洗涤并收集沉淀 D.将 Mg(OH)2 沉淀转入表面皿中,加足量稀盐酸,加热 蒸干得无水 MgCl2 固体 解析:稀释浓硫酸时,应将浓硫酸沿着器壁慢慢加入水中, 并及时搅拌,A不正确;过滤时需要用玻璃棒引流,C 不正确; 蒸发溶液时应该用蒸发皿而不是表面皿,因为MgCl2 水解,所 以加热时必须在HCl 的气流中才能得到MgCl2 固体,D 不正确。 答案:B A.3 mol·L B.4 mol·L 题组二 铝的性质与应用 3.将等物质的量的镁和铝相混合,取等质量的该混合物四 份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )。 -1 HCl -1 HNO3 C.8 mol·L-1NaOH D.18 mol·L-1H2SO4 解析:镁、铝与硝酸、浓硫酸反应均不产生H2;Mg 不与 NaOH 反应;Mg、Al 都能与盐酸反应产生H2。 答案:A 4.(2013 年黑龙江哈尔滨模拟)下列有关铝及其化合物的叙 述正确的是( )。 A.铝粉与氧化镁共热可制取金属镁 B.足量铝分别与含 1 mol HCl、1 mol NaOH 的溶液反应, 产生相同量的氢气 C.工业上用电解熔融 Al2O3 的方法冶炼铝 D.在浓硝酸中加入等体积的浓硫酸后,立即加入铝片, 铝片表面发生钝化 解析:Mg 的活泼性强于铝,因而A 项反应不能发生;B 项后者产生的H2 多;D 项不再发生钝化,因为浓硫酸稀释后会 释放出大量的热,而热的浓硝酸与铝会发生反应。 答案:C 题组三 铝的氧化物与氢氧化物 5.向 MgSO4 和 Al2(SO4)3 的混合溶液中,逐滴加入 NaOH 溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入 NaOH 溶液的体积,纵坐标表示反应生成沉淀的质量)( )。 解析:MgSO4 和Al2(SO4)3 都能与NaOH 溶液反应生成沉淀, 但只有Al(OH)3 能继续与NaOH 反应生成可溶的NaAlO2,所以 沉淀只会部分溶解。 答案:D 6.治胃病的药物中通常含有氢氧化铝。某研究性学习小组 根据化学原理设计了如下五种制备方案: A.铝屑与硫酸反应,然后再加入氢氧化钠溶液沉淀铝离 子; B.铝屑与硫酸反应,然后再加氨水沉淀铝离子; C.铝屑与足量氢氧化钠溶液反应,再加入硫酸生成氢氧 化铝; D.铝屑与足量氢氧化钠溶液反应,再通入二氧化碳生成 氢氧化铝; E.铝屑先分别与硫酸、氢氧化钠溶液反应,然后将二者反 应后的溶液混合,生成氢氧化铝。 (1)你认为________(填选项)方案最佳。 (2)在你选择的最佳方案中,如何调整反应物的比例,从理 论上使铝全部转化成氢氧化铝: ________________________ _____________________________________________________。 (3)科学研究发现,长期服用含氢氧化铝药剂,会造成一些 副作用,如________(填字母)。 A.重金属中毒 C.智力低下 B.引起甲状腺肿 D.贫血症 上述三种方案若制取等量Al(OH)3,方案E 消耗的原料最 少,因此属于最佳方案。 H2SO4 氨水 NaOH CO2 6H2O===4Al(OH)3↓。因此使与H2SO4 反应的铝的物质的量和 与NaOH 反应的铝的物质的量比为1∶ 3,就能使铝完全转化成 Al(OH)3。 答案:(1)E (2)使与硫酸反应的铝的量和与氢氧化钠反应 的铝的量之比为 1∶ 3 (3)C 题组四 计算题 7.将 5.1 g 镁铝合金溶于 60 mL 5.0 mol·L-1 H2SO4溶液中。 完全溶解后再加入65 mL 10.0 mol·L-1 的 NaOH 溶液,得到沉淀 9.7 g,继续滴加 NaOH 溶液时沉淀会减少。 (1)当加入________mL NaOH 溶液,可使溶解在硫酸中的 Mg2+和 Al3+恰好完全沉淀。 (2)计算合金溶于硫酸时产生的氢气在标准状况下的体积。 解析:(1)当沉淀的量达到最大值的时,溶质只有Na2SO4, V(NaOH)=0.06×5×2 10 L=0.06 L=60 mL。 答案:(1)60 mL 根据第一问的结论,当加入氢氧化钠溶液的体积为 65 mL 时, 此时沉淀的质量不是最大值,有一部分的 Al(OH)3 被过量的 5 mL NaOH 溶解。 答:略 (2)解:硫酸是过量的,氢气不能直接用硫酸中的H+来算。查看更多