- 2021-05-26 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版原子结构与性质学案(5)
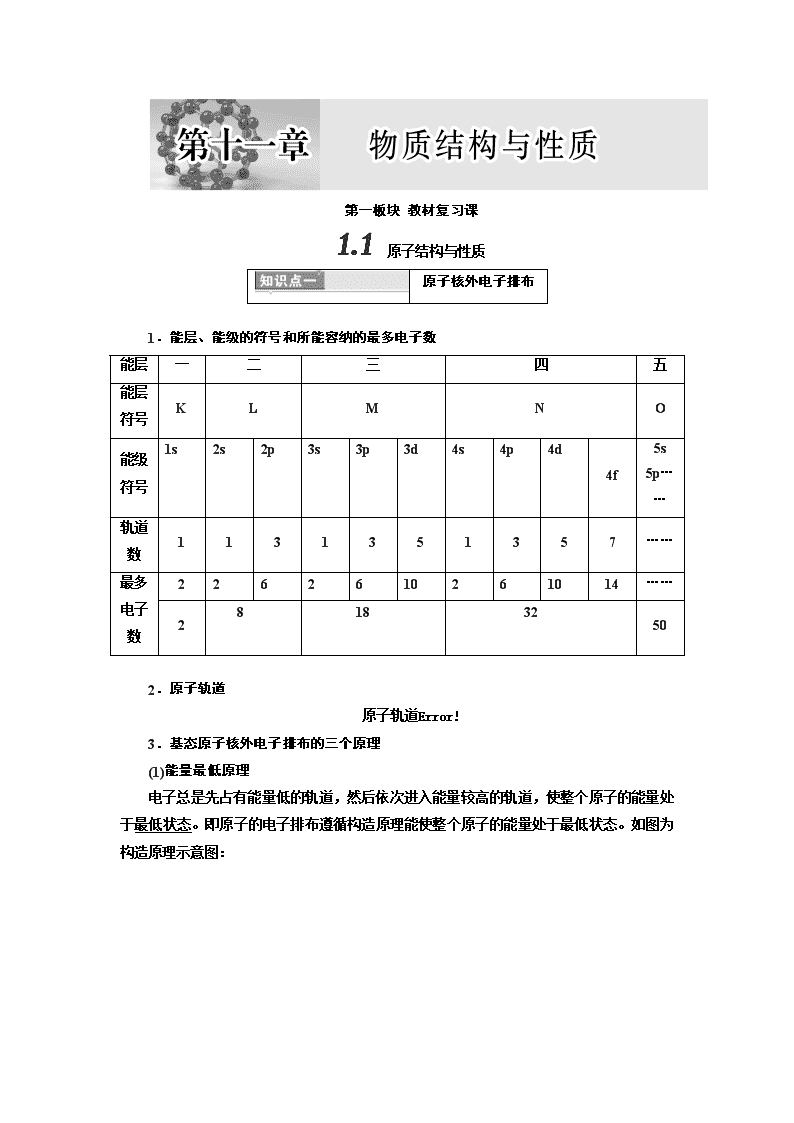
第一板块 教材复习课 原子结构与性质 原子核外电子排布 1.能层、能级的符号和所能容纳的最多电子数 能层 一 二 三 四 五 能层符号 K L M N O 能级符号 4f 5s 5p…… 轨道数 1 1 3 1 3 5 1 3 5 7 …… 最多 电子数 2 14 …… 2 50 2.原子轨道 原子轨道 3.基态原子核外电子排布的三个原理 (1)能量最低原理 电子总是先占有能量低的轨道,然后依次进入能量较高的轨道,使整个原子的能量处于最低状态。即原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。如图为构造原理示意图: (2)泡利原理 在一个原子轨道中,最多只能容纳2个电子,并且这两个电子的自旋状态相反。如2s轨道上的电子排布为,不能表示为。 (3)洪特规则 当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,并且自旋状态相同。如2p3的电子排布为,不能表示为或。 洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1。 4.基态原子核外电子排布的表示方法 表示方法 以硫原子为例 电子排布式 1s22s22p63s23p4 简化电子排布式 [Ne]3s23p4 电子排布图 (轨道表达式) 外围(价)电子排布式 3s23p4 5.原子状态与原子光谱 (1)原子的状态 ①基态原子:处于最低能量的原子。 ②激发态原子:基态原子的电子吸收能量后,从低能级跃迁到高能级状态的原子。 (2)原子光谱 不同元素的原子发生电子跃迁时会吸收或释放不同的光,用光谱仪记录下来便得到原子光谱。利用原子光谱的特征谱线可以鉴定元素,称为光谱分析。 (3)基态、激发态及光谱示意图 [对点练习] 1.判断正误(正确的打“√”,错误的打“×”)。 (1)p能级能量一定比s能级的能量高(×) (2)某原子M层上的电子数一定比L层上的电子数多(×) (3)同一原子中,2p、3p、4p能级的轨道数依次增多(×) (4)2p和3p轨道形状均为哑铃形,能量也相等(×) (5)磷元素基态原子的电子排布图为 (×) (6)Cr原子有6个未成对的电子(√) 2.下列说法错误的是( ) A.ns电子的能量不一定高于(n-1)p电子的能量 B.6C的电子排布式1s22s22p违反了洪特规则 C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 解析:选A 各能级能量的大小顺序为1s2s2p3s3p4s3d4p5s……ns电子的能量一定高于(n-1)p电子的能量,A错误;对于C原子来说,2p能级有3个能量相同的原子轨道,最后2个电子应以自旋状态相同的方式分布在两个不同的2p轨道上,违反了洪特规则,B正确;根据轨道能量高低顺序可知E4s查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档