- 2021-05-26 发布 |
- 37.5 KB |
- 20页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版第18讲原电池化学电源学案
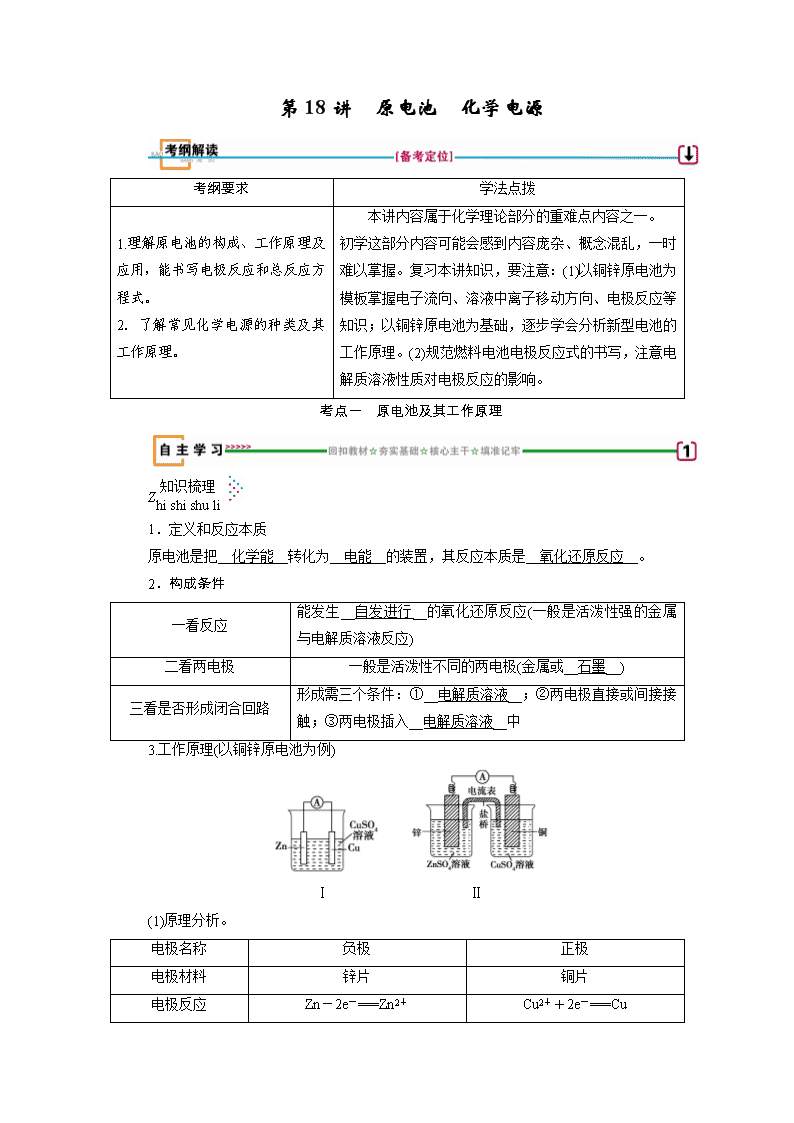
第18讲 原电池 化学电源 考纲要求 学法点拨 1.理解原电池的构成、工作原理及应用,能书写电极反应和总反应方程式。 2.了解常见化学电源的种类及其工作原理。 本讲内容属于化学理论部分的重难点内容之一。 初学这部分内容可能会感到内容庞杂、概念混乱,一时难以掌握。复习本讲知识,要注意:(1)以铜锌原电池为模板掌握电子流向、溶液中离子移动方向、电极反应等知识;以铜锌原电池为基础,逐步学会分析新型电池的工作原理。(2)规范燃料电池电极反应式的书写,注意电解质溶液性质对电极反应的影响。 考点一 原电池及其工作原理 Z 1.定义和反应本质 原电池是把__化学能__转化为__电能__的装置,其反应本质是__氧化还原反应__。 2.构成条件 一看反应 能发生__自发进行__的氧化还原反应(一般是活泼性强的金属与电解质溶液反应) 二看两电极 一般是活泼性不同的两电极(金属或__石墨__) 三看是否形成闭合回路 形成需三个条件:①__电解质溶液__;②两电极直接或间接接触;③两电极插入__电解质溶液__中 3.工作原理(以铜锌原电池为例) Ⅰ Ⅱ (1)原理分析。 电极名称 负极 正极 电极材料 锌片 铜片 电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu 反应类型 __氧化__反应 __还原__反应 电子流向 由__锌片__沿__导线__流向__铜片__ 盐桥中离子移向 盐桥含饱和KCl溶液,K+移向__正极__,Cl-移向__负极__ 电池反应方程式 Zu+Cu2+===Zn2++Cu (2)两种装置比较。 ①盐桥的作用:a.连接内电路形成闭合回路。b.维持两电极电势差(中和电荷),使电池能持续提供电流。 ②装置Ⅰ中有部分Zn与Cu2+直接反应,使电池效率降低;装置Ⅱ中使Zn与Cu2+隔离,电池效率提高,电流稳定。 4.三个移动方向 电子方向 从__负__极流出沿导线流入__正__极 电流方向 从__正__极沿导线流向__负__极 离子迁移方向 电解质溶液中,阴离子向__负__极迁移,阳离子向__正__极迁移 特别提醒: (1)只有氧化还原反应才能设计成原电池。 (2)活泼性强的金属不一定作负极,但负极一定发生氧化反应。(原电池中“负极氧化,正极还原”)。 (3)电子不能通过电解质溶液,溶液中的离子不能通过盐桥。(电子不下水,离子不上岸或电子走旱路,离子走水路。) (4)负极失去电子总数一定等于正极得到电子总数。 (5)对于同一反应,原电池反应速率一定比直接发生的氧化还原反应快。 X 1.判断正误,正确的画“√”,错误的画“×”。 (1)原电池可将化学能转化为电能,原电池需外接电源才能工作( × ) (2)在原电池中,负极材料的活泼性一定比正极材料强( × ) (3)NaOH溶液与稀硫酸反应是放热反应,此反应可以设计成原电池( × ) (4)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动( × ) (5)在铜锌原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生( × ) (6)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( × ) (7)MgAl稀H2SO4组成的原电池中,Mg作负极,MgAlNaOH溶液组成的原电池中,Mg作正极。( √ ) (8)氧化还原反应2H2O2H2↑+O2↑可以设计成原电池( × ) (9)同种条件下,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长( √ ) (10)某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液( × ) 2.在双液原电池中,盐桥的作用是什么? 答案: 形成闭合回路,使两溶液保持电中性。 3.在如图所示的8个装置中,属于原电池的是__②④⑥⑦__ 题组一 原电池工作原理 1.(2018·浙江嘉兴模拟)下列说法正确的是( D ) A.构成原电池的两个电极必须是活泼性不同的两种金属 B.如图原电池中,电流由锌棒经外电路流向铜棒 C.通过构成原电池,能将反应的化学能全部转化为电能 D.银锌纽扣电池的放电反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 [解析] 构成原电池的两个电极不一定都是金属,可以是一极为较活泼金属,另一极为石墨棒,故A错误;该原电池中,锌为负极,铜为正极,电流由铜棒经外电路流向锌棒,故B错误;通过原电池,能将反应的化学能转化为电能,由于存在能量损失,则不可能将化学能全部转化为电能,故C错误;由电池总反应可知该纽扣电池的反应中Zn为还原剂,Ag2O为氧化剂,故Zn为负极被氧化,Ag2O为正极被还原,故D正确。 2.(2018·天津高三检测)分析下图所示的四个原电池装置,其中结论正确的是( B ) A.①②中Mg作负极,③④中Fe作负极 B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑ C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+ D.④中Cu作正极,电极反应式为2H++2e-===H2↑ [解析] ②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应失去电子,故Al是负极;③中Fe在浓硝酸中钝化,Cu和浓硝酸反应失去电子作负极,A、C错;②中电池总反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,负极反应式为2Al+8OH--6e-===2AlO+4H2O,则正极反应式为6H2O+6e-===6OH-+3H2↑,B正确;④中Cu是正极,电极反应式为O2+2H2O+4e-===4OH-,D错。 3.(2018·福建省漳州市八校联考)“软电池”采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰,在纸内的带电离子“流过”水和氧化锌组成的电解液。电池总反应为:Zn+2MnO2+H2O===2MnO(OH)+ZnO。下列说法正确的是( C ) A.该电池的正极为锌 B.该电池反应中二氧化锰起催化作用 C.电池正极反应式:2MnO2+2e-+2H2O===2MnO(OH)+2OH- D.当0.1 mol Zn完全溶解时,流经电解液的电子的物质的量为0.2 mol [解析] 该原电池中,锌元素化合价由0价变为+2价。锌失电子作负极,故A错误;该原电池中,锰元素化合价由+4价变为+3价,所以二氧化锰作正极,故B错误;电子从负极沿导线流向正极,不经过电解质溶液,故D错误。 萃取精华: 1.图解原电池工作原理 2.规避原电池工作原理的3个易失分点 (1)原电池闭合回路的形成有多种方式,可以是用导线连接两个电极,也可以是两电极相接触。 (2)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路。 (3)电子不能通过电解质溶液。 3.原电池中正、负极的判断 判断原电池的正负极需抓住闭合回路和氧化还原反应进行分析,如图 原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成活泼金属一定作负极的思维定式。如Al、Mg和NaOH溶液构成的原电池中,Al为负极,Mg为正极。 题组二 盐桥原电池 4.(2018·山东滨州检测)用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述中正确的是( D ) A.电子通过盐桥从乙池流向甲池 B.铜导线替换盐桥,原电池将能继续工作 C.开始时,银片上发生的反应是:Ag-e-===Ag+ D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 [解析] 电子不经过电解质溶液,故A错误;铜导线代替盐桥,乙池是原电池,甲池是电解池,故B错误;银片是原电池的正极,电极反应是Ag++e-===Ag,故C错误;铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应都是Cu+2Ag+===2Ag+Cu2+,故D正确。 5.(2018·河南郑州检测)控制适合的条件,将反应Fe3++Ag??Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断中正确的是( D ) A.盐桥中的K+移向乙烧杯 B.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 C.在外电路中,电子从石墨电极流向银电极 D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 [解析] 该原电池中,Ag失电子作负极,石墨作正极,盐桥中K+移向正极(甲烧杯);一段时间后,原电池反应结束,电流计指针指向0;原电池外电路电子由负极流向正极,所以电子从银电极流向石墨电极;电流计指针居中后,往甲烧杯中加入一定量的铁粉,由2Fe3++Fe===3Fe2+,c(Fe3+)降低,c(Fe2+)增大,平衡Fe3++Ag??Fe2++Ag+向左移动,故电流计指针向左偏转。 6.(2018·山东省实验中学第二次月考)图Ⅰ、Ⅱ分别是甲、乙两组同学根据反应“AsO+2I-+2H+??AsO+I2+H2O”设计成的原电池装置,其中C1、C2、C3、C4均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图Ⅱ的B烧杯中逐滴加入适量40% NaOH溶液。下列叙述中正确的是( D ) A.甲组操作时,电流表(A)指针发生偏转 B.甲组操作时,溶液颜色变浅 C.乙组操作时,C4作正极 D.乙组操作时,C3上发生的电极反应为I2+2e-===2I- [解析] 装置Ⅰ中发生反应,AsO+2I-+2H+??AsO+I2+H2O,当加入适量浓盐酸时,平衡向右移动,有电子转移,但电子不会沿导线转移,所以甲组操作中,电流表(A)指针不会发生偏转,但由于I2浓度增大,所以溶液颜色变深,故A、B错误;向装置Ⅱ的B烧杯中加入NaOH溶液,AsO-2e-+2OH-===AsO+H2O,电子沿导线由C4移向C3棒,C3上发生的电极反应为I2+2e-===2I-,所以C4为负极,C3为正极,C错误,D正确。 萃取精华: 1.溶液pH变化判断: (1)当负极产生的金属离子结合溶液中的OH-时,电极附近的溶液pH降低。当正极O2得电子时结合溶液中的水时,生成OH-使溶液中的pH增大。 (2)电池工作时整个溶液pH的变化必须从总反应式来分析。当电解质溶液中酸被消耗时,溶液pH增大,当电解质溶液中碱被消耗时,溶液pH减小。 2.原电池的判断方法 (1)先分析有无外接电源,有外接电源的为电解池,无外接电源的可能为原电池。 (2)然后依据原电池的形成条件分析判断,主要是“四看”: (3)多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看做电解池。 考点二 原电池原理的四大应用 Z 原电池在化工、农业生产及科学研究中的四大应用 1.加快氧化还原反应速率 一个自发的氧化还原反应,设计成原电池时反应速率__增大__,例如Zn与稀硫酸反应时加入少量的CuSO4溶液能使产生氢气的速率加快。 2.比较金属活动性强弱 两种金属分别作原电池的两极时,一般作负极的金属活动比正极的__活泼__。 3.用作金属的防护 被保护的金属制品作原电池的__正__极而得到保护。例如,保护铁制输水管或钢铁桥梁,可用导线将其和一块锌块相连,使Zn作原电池的__负__极。 4.设计制作化学电源 特别提醒: 原电池的设计方法 设计原电池时要紧扣原电池的构成条件。具体方法是: (1)首先判断出氧化还原反应中的还原剂和氧化剂,将还原剂(一般为比较活泼金属)作负极,活动性比负极弱的金属或非金属作正极,含氧化剂的溶液作电解质溶液。 (2)如果两个半反应分别在要求的两个容器中进行(中间连接盐桥),则两个容器中的电解质溶液应含有与电极材料相同的金属的阳离子。 (3)设计实例: 根据反应2FeCl3+Cu===2FeCl2+CuCl2 设计的原电池为: (4)装置如下图所示: X 1.判断正误,正确的画“√”,错误的画“×”。 (1)电工操作中规定不能把铜导线与铝导线连接在一起使用,是因为铜、铝在潮湿的环境中形成原电池,加快了铝的腐蚀,易造成断路。( √ ) (2)镀锌铁皮与镀锡铁皮的镀层破损后,前者腐蚀速率大于后者。( × ) (3)生铁比纯铁更耐腐蚀。( × ) (4)铁与HCl反应时加入少量CuSO4溶液,产生H2的速率加快。( √ ) (5)C+H2O===CO+H2可设计成原电池。( × ) (6)将氧化还原反应设计成原电池,可以把物质内部的能量全部转化为电能。( × ) (7)太阳能电池不属于原电池。( √ ) 2.有A、B、C、D四种金属,做如下实验:①将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;②将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈;③将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序__D>A>B>C__。 解析:①A与B用导线连接后浸入电解质溶液中会构成原电池,B不易腐蚀,说明B为原电池的正极,说明金属活动性:A>B;②A、D与等物质的量浓度的盐酸反应,D比A反应剧列,说明金属活泼性:D>A;③根据置换反应规律,Cu不能置换出B,说明金属活泼性:B>Cu;Cu能置换出C,说明金属活动性:Cu>C。则四种金属活动性的排列顺序是D>A>B>C。 题组一 判断金属的活泼性及反应速率 1.(2018·试题调研)有A,B,C,D,E五块金属片,进行如下实验:①A,B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是( B ) A.A>B>C>D>E B.A>C>D>B>E C.C>A>B>D>E D.B>D>C>A>E 2.(2018·晋城模拟)有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下: 实验装置 部分实验现象 a极质量减小,b极质量增加 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极 由此可判断这四种金属的活动性顺序是( C ) A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c 3.把适合题意的图象填在横线上(用A、B、C、D表示) (1)将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是__A__。 (2)将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是__B__。 (3)将(1)中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图象是__C__。 [解析] 加入CuSO4溶液,Zn置换出Cu,形成原电池,加快应速率,(1)a中Zn减少,H2体积减小;(2)中由于H2SO4定量,产生H2的体积一样多;(3)当把CuSO4溶液改成CH3COONa溶液时,由于CH3COO-+H+??CH3COOH,a中c(H+)减少,反应速率减小,但产生H2的体积不变,所以C项正确。 萃取精华: 比较金属活泼性的三种方法 (1)根据原电池:一般情况下,负极大于正极。 (2)根据电解池:易得电子的金属阳离子,相应金属的活动性较弱。 (3)根据金属活动性顺序表。 题组二 设计原电池 4.(2018·山东济南高三检测)将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程为Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)(aq表示溶液)。若将该反应设计为如图的原电池,则下列说法一定错误的是( C ) A.Cd作负极,Co作正极 B.原电池工作时,电子从负极沿导线流向正极 C.根据阴阳相吸原理,盐桥中的阳离子向负极(甲池)移动 D.甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液 [解析] 在电池反应中,Co2+得电子发生还原反应,则Co作正极、Cd作负极,A正确;放电时,电子从负极Cd沿导线流向正极Co,B正确;盐桥中阳离子向正极区域乙池移动、 阴离子向负极区域甲池移动,C错误;甲池中的电极为Cd,故甲池中,电解质溶液为CdCl2溶液,乙池中盛放的是CoCl2溶液,D正确。 5.(2018·四川成都模拟)某校化学兴趣小组进行探究性活动:将氧化还原反应:2Fe3++2I-??2Fe2++I2,设计成带盐桥的原电池。提供的试剂:FeCl3溶液、KI溶液;其他用品任选。请回答下列问题: (1)请补充下面原电池的装置图,在括号内填上正负极的材料、电解质溶液。 (2)发生氧化反应的电极反应式为__2I--2e-===I2__。 (3)反应达到平衡时,外电路导线中__无__(填“有”或“无”)电流通过。 (4)平衡后向FeCl3溶液中加入少量FeCl2固体,当固体全部溶解后,则此时该溶液中电极变为__负__(填“正”或“负”)极。 [解析] (1)依据原电池原理分析,氧化还原反应中Fe3+在正极得电子发生还原反应,I-在负极失电子发生氧化反应,负极所在的电解质溶液为KI溶液,正极所在的电解质溶液为FeCl3溶液。电极材料可选取惰性电极,如石墨(碳棒)或其他不活泼性金属。 (2)发生氧化反应的电极是负极,I-失电子。 (3)反应达到平衡时,从左到右和从右到左移动的电子数目相同,故无电流生产。 (4)平衡后向FeCl3溶液中加入少量FeCl2固体,平衡逆向移动,此时Fe2+失电子,电极变成负极。 6.(2018·经典习题选萃)理论上任何一个自发的氧化还原反应均可以设计成原电池。 (1)根据氧化还原反应:Fe+2Fe3+===3Fe2+设计的原电池如图所示,其中盐桥内装琼胶-饱和KNO3溶液。请回答下列问题: ①电解质溶液X是__FeCl2(或FeSO4)__; 电解质溶液Y是__FeCl3[或Fe2(SO4)3]__。 ②写出两电极的电极反应式: 铁电极:__Fe-2e-===Fe2+__; 碳电极:__2Fe3++2e-===2Fe2+__。 ③外电路中的电子是从__Fe__电极流向__C__电极。(填“Fe”或“C”) ④盐桥中向X溶液中迁移的离子是__B__(填字母)。 A.K+ B.NO C.Ag+ D.SO (2)请将氧化还原反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O设计成原电池,在装置图中的横线上写出相应的电极及电解质溶液,并写出相应的电极反应式。 电极反应式: 正极:__2NO+6e-+8H+===2NO↑+4H2O__ 负极:__3Cu-6e-===3Cu2+__。 [解析] (1)①根据反应,Fe作负极,C作正极,负极电解液中应含有亚铁离子,正极反应为Fe3++e-===Fe2+,因而Y为含Fe3+的电解质溶液。 ②电极反应:负极Fe-2e-===Fe2+; 正极2Fe3++2e-===2Fe2+。 ③外电路电子由负极流向正极。 ④Fe是负极,因而向X溶液中迁移的是阴离子即为NO。 (2)由反应可知,Cu发生氧化反应,作负极,其电极反应式为3Cu-6e-===3Cu2+,正极应选用碳棒或其他惰性电极,其电极反应式为2NO+6e-+8H+===2NO↑+4H2O,参照其装置图可知其正极、负极的电解质分别为HNO3、Cu(NO3)2。 考点三 化学电源的种类及其工作原理 Z 1.一次电池(碱性锌锰干电池) 碱性锌锰干电池的工作原理如图: 负极(Zn),电极反应式:__Zn+2OH--2e-===Zn(OH)2__ 正极(MnO2),电极反应式:__2MnO2+2H2O+2e-===2MnOOH+2OH-__ 总反应:Zn+2MnO2+2H2O===__Zn(OH)2+2MnOOH__ 2.二次电池(以铅蓄电池为例) (1)放电时的反应: ①负极反应:__Pb(s)+SO(aq)-2e-===PbSO4(s)__ ②正极反应:__PbO2(s)+4H+(aq)+SO(aq)+2e-===PbSO4(s)+2H2O(l)__ ③总反应:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l) (2)充电时的反应 ①阴极反应:__PbSO4(s)+2e-===Pb(s)+SO(aq)__ ②阳极反应:__PbSO4(s)+2H2O(l)-2e-===PbO2(s)+4H+(aq)+SO(aq)__ ③总反应:2PbSO4(s)+2H2O(l)Pb(s)+PbO2(s)+2H2SO4(aq) 3.燃料电池 (1)氢氧燃料电池是目前最成熟的燃料电池,也可分为酸性和碱性两种。 酸性 碱性 负极反应式 __2H2-4e-===4H+__ __2H2-4e-+4OH-===4H2O__ 正极反应式 __O2+4e-+4H+===2H2O__ __O2+4e-+2H2O===4OH-__ 总反应式 2H2+O2===2H2O (2)燃料电池的电极本身不参与反应,燃料和氧化剂连续地由__外部__供给。对于燃料电池要注意燃料在负极反应,O2在正极反应,要注意电解质溶液或传导介质的影响,如碱性条件下,CO2以CO形式存在。 X 1.判断正误,正确的画“√”,错误的画“×”。 (1)碘可用作锂碘电池的材料,该电池反应为2Li(s)+I2(s)===2LiI(s),则碘电极作该电池的负极( × ) 提示:碘在反应中的化合价降低,发生还原反应,碘作正极。 (2)可充电电池中的放电反应和充电反应互为可逆反应( × ) 提示:可充电电池的充电与放电不是在相同条件下发生的,故不是可逆反应。 (3)铅蓄电池放电时的负极和充电时的阳极均发生氧化反应。( √ ) (4)铅蓄电池工作时,当电路中转移0.2 mol电子时,消耗的H2SO4为0.1 mol。( × ) (5)铅蓄电池工作时,当电路中转移0.1 mol电子时,负极增加4.8 g。( √ ) (6)在化学电源中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应。 ( × ) (7)二次电池充电时,充电器的正极接二次电源的正极。( √ ) (8)多孔碳可用作氢氧燃料电池的电极材料( √ ) (9)根据反应4Li+FeS2===Fe+2Li2S设计的可充电电池是一种应用广泛的锂电池,可用水溶液作电解质溶液( × ) (10)原电池中的电解质溶液一定参与反应( × ) (11)一种基本酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+,正极上发生的反应为O2+4e-+2H2O===4OH-( × ) (12)锂离子电池的总反应为LixC+Li1-xCoO2C+LiCoO2,放电时Li+向负极移动( × ) 2.(1)氢氧燃料电池以KOH溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将__减小__(填“减小”“增大”或“不变”,下同),溶液的pH__减小__。 (2)氢氧燃料电池以H2SO4溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将__减小__,溶液的pH__增大__。 3.化学电源中电极反应式的书写 (1)铝-空气海水电池:以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。 电池总反应为:4Al+3O2+6H2O===4Al(OH)3 负极:__4Al-12e-+12OH-===4Al(OH)3__ 正极:__3O2+6H2O+12e-===12OH-__ (2)LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2↑。 请回答下列问题: ①电池的负极材料为__锂__,发生的电极反应为__4Li-4e-===4Li+__。 ②电池正极发生的电极反应为__2SOCl2+4e-===4Cl-+S+SO2↑__。 解析:分析反应的化合价变化,可知Li失电子,被氧化,为还原剂,SOCl2得电子,被还原,为氧化剂。 ①负极材料为Li(还原剂),4Li-4e-===4Li+。 ②正极反应式可由总反应式减去负极反应式得到: 2SOCl2+4e-===4Cl-+S+SO2↑。 题组一 电极、电池反应式的书写 1.MgAgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( B ) A.负极反应式为Mg-2e-===Mg2+ B.正极反应式为Ag++e-===Ag C.电池放电时Cl-由正极向负极迁移 D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑ [解析] 该原电池中,Mg作负极,发生反应:Mg-2e-===Mg2+,A正确;AgCl在正极反应,电极反应式:AgCl+e-===Ag+Cl-,B错误;Cl-带有负电荷,电池放电时在电解质溶液中由正极向负极移动,C正确;Mg是活泼金属,负极发生副反应:Mg+2H2O===Mg(OH)2+H2↑,D正确。 2.以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法: (1)酸性条件 燃料电池总反应:CH4+2O2===CO2+2H2O ① 燃料电池正极反应:O2+4H++4e-===2H2O ② ①-②×2,得燃料电池负极反应: __CH4+2H2O-8e-===CO2+8H+__。 (2)碱性条件 燃料电池总反应: CH4+2O2+2NaOH===Na2CO3+3H2O ① 燃料电池正极反应:O2+2H2O+4e-===4OH- ② ①-②×2,得燃料电池负极反应: __CH4+10OH--8e-===CO+7H2O__。 (3)固体电解质(高温下能传导O2-) 燃料电池总反应:CH4+2O2===CO2+2H2O① 燃料电池正极反应:O2+4e-===2O2-② ①-②×2,得燃料电池负极反应: __CH4+4O2--8e-===CO2+2H2O__。 (4)熔融碳酸盐(如熔融K2CO3)环境下 电池总反应:CH4+2O2===CO2+2H2O。正极电极反应式:O2+2CO2+4e-===2CO。电池总反应-正极电极反应式得负极反应式:__CH4+4CO-8e-===5CO2+2H2O__。 萃取精华: 1.电极反应式的书写方法 (1)拆分法: ①写出原电池的总反应,如 2Fe3++Cu===2Fe2++Cu2+。 ②把总反应按氧化反应和还原反应拆分为两个半反应,并注明正、负极,并依据质量守恒、电荷守恒及电子得失守恒配平两个半反应: 正极:2Fe3++2e-===2Fe2+ 负极:Cu-2e-===Cu2+。 (2)加减法: ①写出总反应,如Li+LiMn2O4===Li2Mn2O4。 ②写出其中容易写出的一个半反应(正极或负极)。如 Li-e-===Li+(负极)。 ③利用总反应与上述的一极反应相减,即得另一个电极的反应式,即LiMn2O4+Li++e-===Li2Mn2O4(正极)。 2.电极反应书写的三个步骤 题组二 燃料电池 3.(2016·新课标)锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O===2Zn(OH)。下列说法正确的是( C ) A.充电时,电解质溶液中K+向阳极移动 B.充电时,电解质溶液中c(OH-)逐渐减小 C.放电时,负极反应为:Zn+4OH--2e-===Zn(OH) D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况) [解析] 该题考查原电池和电解池相关知识,意在通过电池反应考查离子迁移、溶液酸碱性变化、电极反应式的书写以及简单计算等。K+带正电荷,充电时K+应该向阴极移动,A项错误。根据该电池放电的总反应可知,放电时消耗OH-,则充电时,OH-浓度应增大,B项错误。放电时,Zn为负极,失去电子生成Zn(OH),其电极反应为Zn+4OH--2e-===Zn(OH),C项正确。消耗1 mol O2转移4 mol电子,故转移2 mol电子时消耗0.5 mol O2 ,0.5 mol O2在标准状况下的体积为11.2 L,D项错误。 4.(2018·河北衡水检测)某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。 (1)负极反应式为__CO+O2--2e-===CO2__; 正极反应式为__O2+4e-===2O2-__。 电池总反应为__2CO+O2===2CO2__。 (2)如果将上述电池中电解质“氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动”改为熔融的K2CO3,b极通入的气体为氧气和CO2,写出相关的电极反应式。 负极:__2CO-4e-+2CO===4CO2__; 正极:__O2+4e-+2CO2===2CO__; 电池总反应为__2CO+O2===2CO2__。 [解析] (1)该装置是原电池,通入一氧化碳的电极a是负极,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO+O2--2e-===CO2;b为正极,电极反应式O2+4e-===2O2-,总反应式为2CO+O2===2CO2。 (2)该电池的总反应为2CO+O2===2CO2。正极反应式为O2+4e-+2CO2===2CO。负极反应式=总反应式-正极反应式:2CO-4e-+2CO===4CO2。 萃取精华: 燃料电池电极反应式的书写 (1)写出电池总反应式:燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应,则总反应为加和后的反应。如甲烷燃料电池(电解质溶液为NaOH溶液)的反应式为CH4+2O2===CO2+2H2O ①、CO2+2NaOH===Na2CO3+H2O ② ①+②得燃料电池总反应式为CH4+2O2+2NaOH===Na2CO3+3H2O,其离子方程式为CH4+2O2+2OH-===CO+3H2O。 (2)写出电池的正极反应式 根据燃料电池的特点,一般在正极上发生还原反应的物质都是O2,电解质溶液不同,其电极反应有所不同,常见的类型有: ①酸性电解质溶液环境下电极反应式: O2+4H++4e-===2H2O。 ②碱性电解质溶液环境下电极反应式: O2+2H2O+4e-===4OH-。 ③固体电解质(高温下能传导O2-)环境下电极反应式: O2+4e-===2O2-。 ④熔融碳酸盐(如熔融K2CO3)环境下电极反应式: O2+2CO2+4e-===2CO。 (3)根据电池总反应式和正极反应式写出电池的负极反应式:电池的总反应式-电池正极反应式=电池负极反应式。因为O2不是负极反应物,因此在将两个反应式相减时,要消去O2. 题组三 新型电池 5.某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为: Li1-xCoO2+LixC6===LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( C ) A.放电时,Li+在电解质中由负极向正极迁移 B.放电时,负极的电极反应式为LixC6-xe-===xLi++C6 C.充电时,若转移1 mol e-,石墨(C6)电极将增重7x g D.充电时,阳极的电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+ [解析] 该题考查了电化学原理,意在考查考生运用电化学原理分析、解决问题的能力。 明确该电池的充放电原理是解题的关键。电池放电时,阳离子由负极移向正极,A项正确;由放电时的总反应看出,LixC6在负极发生失电子的氧化反应,B项正确;充电反应是放电反应的逆反应,充电时阳极发生失电子的氧化反应:LiCoO2-xe-===Li1-xCoO2+xLi+,D项正确;充电时,阴极发生得电子的还原反应:C6+xe-+xLi+===LixC6,当转移1 mol电子时,阴极(C6电极)析出1 mol Li,增重7g,C项错误。 6.(2018·贵州贵阳模拟)锂二硫化亚铁电池是一种高容量电池,用途广泛,该电池放电时的总反应为4Li+FeS2===Fe+2Li2S。下列说法正确的是( A ) A.放电时,Li作电源负极,负极反应为Li-e-===Li+ B.放电时,正极发生氧化反应 C.硫酸、羧酸及醇类物质都可以用作该锂电池的电解质 D.充电时,阳极只有Fe参与放电 [解析] 放电时负极发生氧化反应,电极反应式为Li-e-===Li+,A正确;放电时正极发生还原反应,B错误;加入硫酸、羧酸时,Li和硫酸、羧酸反应,所以不能用硫酸、羧酸作该锂电池的电解质,C错误;充电时,阳极发生氧化反应,而反应中S2-和Fe的化合价都升高,所以S2-和Fe都参与放电,D错误。 7.(2018·辽宁沈阳期末)锂空气电池放电时的工作原理如图所示。下列叙述正确的是( B ) A.放电时Li+由B极向A极移动 B.电池放电反应为4Li+O2+2H2O===4LiOH C.正极反应式为O2+4H++4e-===2H2O D.电解液a可以为LiCl溶液 [解析] A项,在原电池中,A是负极,B是正极,阳离子由A极向B极移动,A错误;B项,原电池放电反应为自发氧化还原反应,即4Li+O2+2H2O===4LiOH,B正确;C项,正极上是氧气得电子的还原反应,由于从电解液b中可回收LiOH,故电解液b不能是酸性溶液,C错误;D项,金属锂可以和水发生反应,电解液a中不能含有水,D项错误。 要点速记: 1.原电池、化学电源 2.原电池中的能量转化及本质 (1)能量转化:化学能转化为电能。 (2)反应本质:自发进行的氧化还原反应。 3.原电池中的四个“方向” (1)外电路中电子移动方向:负极→正极。 (2)外电路中电流方向:正极→负极。 (3)电池内部离子移动方向:阴离子→负极,阳离子→正极。 (4)盐桥中(含饱和KCl溶液)离子移动方向:K+→正极,Cl-→负极。 4.判断原电池正负极的六种方法 电极材料、电极现象、电子移动方向、离子移动方向、得失电子、电解质溶液。 5.书写电极反应式的三个原则 (1)共存原则 因为物质得失电子后在不同介质中的存在形式不同,所以电极反应式的书写必须考虑介质环境。当电解质溶液呈酸性时,不可能有OH-参加反应;碱性溶液中CO2不可能存在,也不可能有H+参加反应。 (2)得氧失氧原则 得氧时,在反应物中加H2O(电解质溶液为酸性时)或OH-(电解质溶液为碱性或中性时);失氧时,在反应中加H2O(电解质溶液为碱性或中性时)或H+(电解质溶液为酸性时)。 (3)中性吸氧反应成碱原则 在中性电解质溶液中,通过金属吸氧所建立起来的原电池反应,其反应的产物是碱。 6.原电池原理的四大应用 (1)加快氧化还原反应的速率; (2)比较金属活动性强弱; (3)用作金属的保护; (4)设计制作化学电源。查看更多