- 2021-05-26 发布 |
- 37.5 KB |
- 31页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版原电池化学电源学案(6)
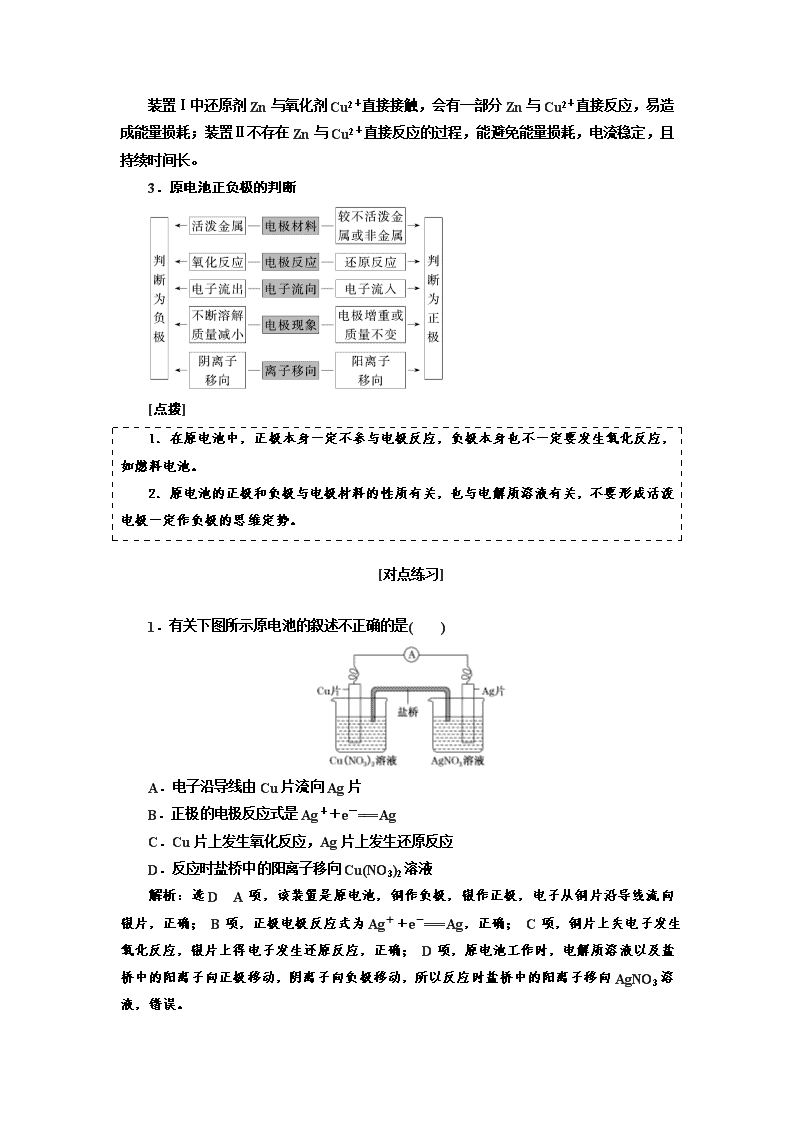
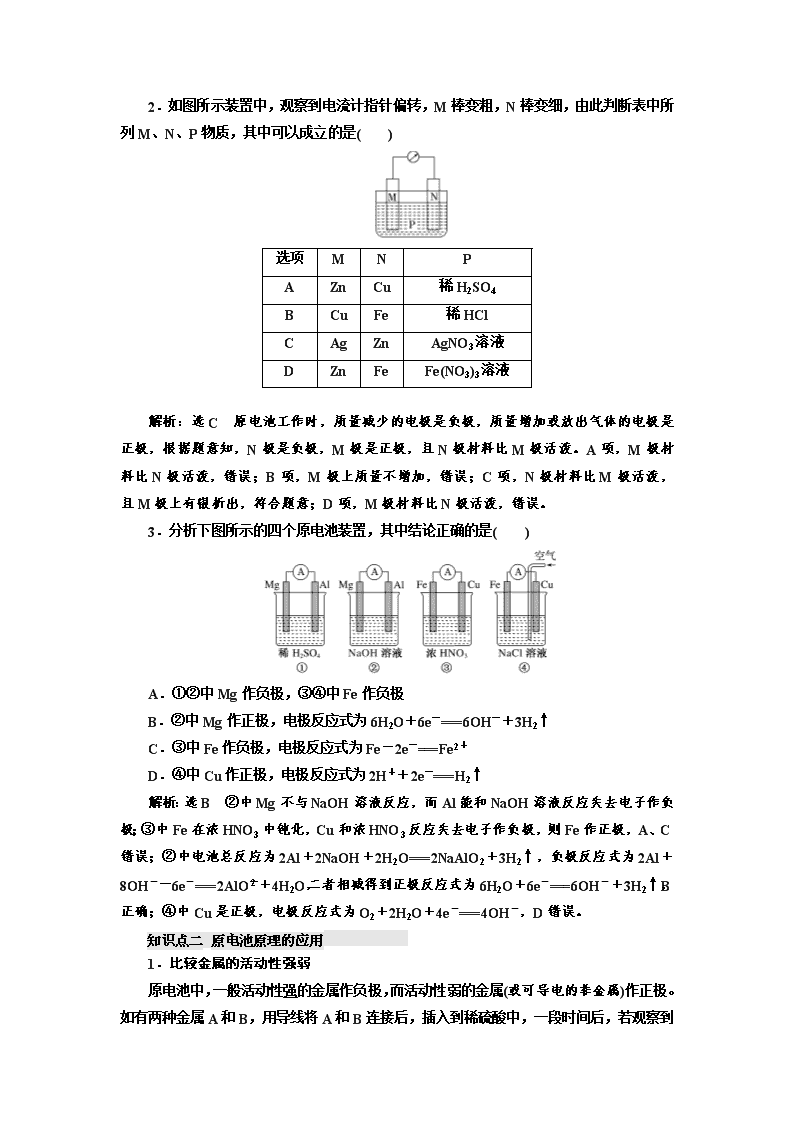
第二节 原电池 化学电源 教材复习——打牢基础,基稳才能楼高 知识点一 原电池的工作原理 1.构成条件 (1)能自发进行的氧化还原反应发生(一般是活动性强的金属与电解质溶液反应)。 (2)活动性不同的两电极(金属或石墨)。 (3)形成闭合回路: 形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入 电解质溶液中。 2.工作原理(以铜锌原电池为例) (1)两种装置 (2)反应原理 电极名称 负极 正极 电极材料 锌片 铜片 电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu 反应类型 氧化反应 还原反应 总反应 Zn+ Cu2+===Zn2++Cu (3)原电池中的三个方向 ①电子方向:从负极流出沿导线流入正极; ②电流方向:从正极沿导线流向负极; ③离子的迁移方向:电解质溶液及盐桥中,阴离子向负极迁移,阳离子向正极迁移。 (4)盐桥的组成和作用 ①盐桥中装有饱和的 KCl、KNO3 等溶液和琼胶制成的胶冻。 ②盐桥的作用: a.连接内电路,形成闭合回路; b.平衡电荷,使原电池不断产生电流。 (5)两种装置的比较 装置Ⅰ中还原剂 Zn 与氧化剂 Cu2+直接接触,会有一部分 Zn 与 Cu2+直接反应,易造 成能量损耗;装置Ⅱ不存在 Zn 与 Cu2+直接反应的过程,能避免能量损耗,电流稳定,且 持续时间长。 3.原电池正负极的判断 [点拨] 1.在原电池中,正极本身一定不参与电极反应,负极本身也不一定要发生氧化反应, 如燃料电池。 2.原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成活泼 电极一定作负极的思维定势。 [对点练习] 1.有关下图所示原电池的叙述不正确的是( ) A.电子沿导线由 Cu 片流向 Ag 片 B.正极的电极反应式是 Ag++e-===Ag C.Cu 片上发生氧化反应,Ag 片上发生还原反应 D.反应时盐桥中的阳离子移向 Cu(NO3)2 溶液 解析:选 D A 项,该装置是原电池,铜作负极,银作正极,电子从铜片沿导线流向银 片,正确; B 项,正极电极反应式为 Ag++e-===Ag,正确; C 项,铜片上失电子发生氧 化反应,银片上得电子发生还原反应,正确; D 项,原电池工作时,电解质溶液以及盐桥 中的阳离子向正极移动,阴离子向负极移动,所以反应时盐桥中的阳离子移向 AgNO3 溶液, 错误。 2.如图所示装置中,观察到电流计指针偏转,M 棒变粗,N 棒变细,由此判断表中所 列 M、N、P 物质,其中可以成立的是( ) 选项 M N P A Zn Cu 稀 H2SO4 B Cu Fe 稀 HCl C Ag Zn AgNO3 溶液 D Zn Fe Fe(NO3)3 溶液 解析:选 C 原电池工作时,质量减少的电极是负极,质量增加或放出气体的电极是正 极,根据题意知,N 极是负极,M 极是正极,且 N 极材料比 M 极活泼。A 项,M 极材料比 N 极活泼,错误;B 项,M 极上质量不增加,错误;C 项,N 极材料比 M 极活泼,且 M 极 上有银析出,符合题意;D 项,M 极材料比 N 极活泼,错误。 3.分析下图所示的四个原电池装置,其中结论正确的是( ) A.①②中 Mg 作负极,③④中 Fe 作负极 B.②中 Mg 作正极,电极反应式为 6H2O+6e-===6OH-+3H2↑ C.③中 Fe 作负极,电极反应式为 Fe-2e-===Fe2+ D.④中 Cu 作正极,电极反应式为 2H++2e-===H2↑ 解析:选 B ②中 Mg 不与 NaOH 溶液反应,而 Al 能和 NaOH 溶液反应失去电子作负 极;③中 Fe 在浓 HNO3 中钝化,Cu 和浓 HNO3 反应失去电子作负极,则 Fe 作正极,A、C 错误;②中电池总反应为 2Al+2NaOH+2H2O===2NaAlO2+3H2↑,负极反应式为 2Al+ 8OH--6e-===2AlO-2 +4H2O,二者相减得到正极反应式为 6H2O+6e-===6OH-+3H2↑, B 正确;④中 Cu 是正极,电极反应式为 O2+2H2O+4e-===4OH-,D 错误。 知识点二 原电池原理的应用 1.比较金属的活动性强弱 原电池中,一般活动性强的金属作负极,而活动性弱的金属(或可导电的非金属)作正极。 如有两种金属 A 和 B,用导线将 A 和 B 连接后,插入到稀硫酸中,一段时间后,若观察到 A 溶解,而 B 上有气体放出,则说明 A 作负极,B 作正极,即可以判断金属活动性 A>B。 2.加快化学反应速率 一个自发进行的氧化还原反应,设计成原电池时反应速率增大。如 Zn 与稀硫酸反应制 氢气时,可向溶液中滴加少量 CuSO4 溶液,形成 CuZn 原电池,加快化学反应速率。 3.用于金属的防护 使需要保护的金属制品作原电池正极而受到保护。例如要保护一个铁质的输水管道或 钢铁桥梁,可用导线将其与一块锌块相连,使锌作原电池的负极。 4.设计制作化学电源 设计原电池时要紧扣原电池的构成条件。具体方法是: (1)首先判断出氧化还原反应中的还原剂和氧化剂,将还原剂(一般为比较活泼金属)作负 极,活泼性比负极弱的金属或导电的非金属(如石墨等)作正极,含氧化剂对应离子的电解质 溶液作电解液。 (2)如果两个半反应分别在要求的两个容器中进行(中间连接盐桥),则两个容器中的电解 质溶液应含有与电极材料相同的金属的阳离子。如在 CuZn 构成的原电池中,负极 Zn 浸 泡在含有 Zn2+的电解质溶液中,而正极 Cu 浸泡在含有 Cu2+的电解质溶液中。 (3)实例:根据 Cu+2Ag+===Cu2++2Ag 设计电池: [对点练习] 1.M、N、P、E 四种金属,已知:①M+N2+===N+M2+;②M、P 用导线连接放入 NaHSO4 溶液中,M 表面有大量气泡逸出;③N、E 用导线连接放入 E 的硫酸盐溶液中,电 极反应为 E2++2e-===E,N-2e-===N2+。则这四种金属的还原性由强到弱的顺序是( ) A.P>M>N>E B.E>N>M>P C.P>N>M>E D.E>P>M>N 解析:选 A 由①知,金属活动性:M>N;M、P 用导线连接放入 NaHSO4 溶液中,M 表面有大量气泡逸出,说明 M 作原电池的正极,故金属活动性:P>M;N、E 构成的原电 池中,N 作负极,故金属活动性:N>E。 2.选择合适的图像: (1)将等质量的两份锌粉 a、b 分别加入过量的稀硫酸中,同时向 a 中加入少量的 CuSO4 溶液,产生 H2 的体积 V(L)与时间 t(min)的关系是________。 (2)将过量的两份锌粉 a、b 分别加入定量的稀硫酸,同时向 a 中加入少量的 CuSO4 溶 液,产生 H2 的体积 V(L)与时间 t(min)的关系是________。 (3)将(1)中的 CuSO4 溶液改成 CH3COONa 溶液,其他条件不变,则图像是________。 解析:(1)a 中加入 CuSO4,消耗一部分 Zn,Cu、Zn 形成原电池,反应速率加快,所 以 a 放出 H2 的量减少,但速率加快。(2)a 中加入 CuSO4 消耗 Zn,但不影响产生 H2 的量, 速率也加快。(3)CH3COONa 与 H2SO4 反应后生成弱酸 CH3COOH,从而减慢反应速率, 但产生 H2 的量没发生变化。 答案:(1)A (2)B (3)C 3.利用如图装置,可以模拟铁的电化学防护。 若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于________处。若 X 为 锌,开关 K 置于 M 处,该电化学防护法称为_____________________。 解析:铁被保护,可以作原电池的正极,或者电解池的阴极。若 X 为碳棒,开关 K 应置于 N 处,Fe 作阴极受到保护;若 X 为锌,开关 K 置于 M 处,铁作 正极,锌作负极,称为牺牲阳极的阴极保护法。 答案:N 牺牲阳极的阴极保护法 4.某校化学兴趣小组进行探究性活动:将氧化还原反应:2Fe3++2I-2Fe2++I2, 设计成带盐桥的原电池。提供的试剂:FeCl3 溶液,KI 溶液;其他用品任选。请回答下列 问题: (1)请补充下面原电池的装置图,在括号内填上正负极的材料、电解质溶液。 (2)发生氧化反应的电极反应式为____________________________________________。 (3)反应达到平衡时,外电路导线中__________(填“有”或“无”)电流通过。 (4)平衡后向 FeCl3 溶液中加入少量 FeCl2 固体,当固体全部溶解后,则此时该溶液中电 极变为__________(填“正”或“负”)极。 解析:(1)依据原电池原理分析,氧化还原反应中 Fe3+在正极得电子发生还原反应,I- 在负极失电子发生氧化反应,负极所在的电解质溶液为 KI 溶液,正极所在的电解质溶液为 FeCl3。电极材料可选取惰性电极,如石墨(碳棒)或其他不活泼金属。 (2)发生氧化反应的电极是负极,I-失电子。 (3)反应达到平衡时,从左到右和从右到左移动的电子数目相同,故无电流产生。 (4)平衡后向 FeCl3 溶液中加入少量 FeCl2 固体,平衡 2Fe3++2I-2Fe2++I2 逆向移 动,此时 Fe2+失电子,电极变成负极。 答案:(1)如图 (2)2I--2e- ===I2 (3)无 (4)负 知识点三 化学电源 1.一次电池 (1)碱性锌锰干电池 正极反应:2MnO2+2H2O+2e-===2MnOOH+2OH-; 负极反应:Zn+2OH--2e-===Zn(OH)2; 总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。 (2)锌银电池 负极反应:Zn+2OH--2e-===Zn(OH)2; 正极反应:Ag2O+H2O+2e-===2Ag+2OH-; 总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag。 2.二次电池(可充电电池) 铅蓄电池是最常见的二次电池,负极材料是 Pb,正极材料是 PbO2。 (1)放电时的反应 ①负极:Pb(s)+SO2-4 (aq)-2e-===PbSO4(s)(氧化反应)。 ②正极:PbO2(s)+4H+(aq)+SO2-4 (aq)+2e-===PbSO4(s)+2H2O(l)(还原反应)。 ③总反应:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l)。 (2)充电时的反应 ①阴极:PbSO4(s)+2e-===Pb(s)+SO2-4 (aq)(还原反应)。 ②阳极:PbSO4(s)+2H2O(l)-2e-===PbO2(s)+4H+(aq)+SO2-4 (aq)(氧化反应)。 ③总反应:2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)。 3.燃料电池 氢氧燃料电池是目前最成熟的燃料电池,可分成酸性和碱性两种。 酸性 碱性 负极反应式 2H2-4e-===4H+ 2H2+4OH--4e- ===4H2O 正极反应式 O2+4H++4e-===2H2O O2+2H2O+4e-===4OH- 电池总反应式 2H2+O2===2H2O [思考] (1)可充电电池充电时电极与外接电源的正、负极如何连接? (2)氢氧燃料电池以 KOH 溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度 如何变化?溶液的 pH 如何变化?当氢氧燃料电池以 H2SO4 溶液作电解质溶液时,又会如 何变化? 提示:(1)充电时阴极连负极,阳极连正极。 (2)无论以 KOH 溶液作电解质溶液还是以 H2SO4 溶液作电解质溶液,总反应均为 2H2 +O2===2H2O,所以反应一段时间后,因为有 H2O 的生成而使电解质溶液的浓度均降低, 所以当 KOH 溶液作电解质溶液时 pH 减小,H2SO4 溶液作电解质溶液时 pH 增大。 [对点练习] 1.电子表和电子计算器的电源常用微型银锌原电池,其电极分别为 Ag2O 和 Zn,电解 质溶液为一定浓度的 KOH 溶液,放电时锌极上的电极反应式为 Zn-2e - +2OH - ===Zn(OH)2;氧化银电极上的反应式为 Ag2O+2e-+H2O===2Ag+2OH-,总反应式为 Ag2O+H2O+Zn===Zn(OH)2+2Ag。下列说法正确的是( ) A.溶液中 OH-向正极移动,K+、H+向负极移动 B.锌发生还原反应,氧化银发生氧化反应 C.锌是负极,氧化银是正极 D.随着电极反应的不断进行,电解质的碱性减弱 解析:选 C A 项,原电池工作时阴离子移向负极,阳离子移向正极,错误;B 项,锌 失电子发生氧化反应,氧化银得电子发生还原反应,错误;C 项,Zn 被氧化,为原电池的 负极,正极为 Ag2O,正确;D 项,从总反应方程式分析,氢氧根离子的物质的量没变化, 但溶剂的量减少,导致氢氧根离子浓度增大,碱性增强,错误。 2.铅蓄电池的两极分别为 Pb、PbO2,电解质溶液为 H2SO4,工作时的电池反应为 Pb +PbO2+2H2SO4===2PbSO4+2H2O,下列结论正确的是( ) A.Pb 为正极被氧化 B.溶液的 pH 不断减小 C.SO 2-4 只向 PbO2 处移动 D.电子由 Pb 极流向 PbO2 极 解析:选 D 由 Pb―→PbSO4,可知,Pb 是负极,A 错误;由电池反应可知,H2SO4 不断被消耗,pH 不断增大,B 错误;原电池工作时,外电路中电子由 Pb 极流向 PbO2 极; 内电路中,阴离子移向 Pb 极,C 错误、D 正确。 3.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气 进入以磷酸为电解质的燃料电池发电。该电池负极反应为( ) A.H2+2OH--2e-===2H2O B.O2+4H++4e-===2H2O C.H2-2e-===2H+ D.O2+2H2O+4e-===4OH- 解析:选 C 负极失去电子发生氧化反应,在酸性条件下,H2 失去电子生成 H+,C 正 确。 [基础过关练] 1.(2017·娄底模拟)下列说法正确的是( ) A.构成原电池正极和负极的材料必须是金属 B.在原电池中,电子流出的一极是负极,该电极被还原 C.实验室欲快速制取氢气,可利用粗锌与稀硫酸反应 D.原电池可以把物质内部的能量全部转化为电能 解析:选 C 构成原电池的电极材料可以是导电的非金属,如石墨棒,A 错误;在原电 池中,电子流出的一极失电子被氧化,B 错误;粗锌中含有杂质 Cu 可形成 ZnCu 原电池, 加快了 Zn 与硫酸的反应,C 正确;能量转化率不可能达 100%,D 错误。 2.(2017·梧州模拟)下列叙述与原电池无关的是( ) A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 B.镀锌铁表面有破损时也能阻止铁被氧化 C.红热的铁丝与水接触表面形成蓝黑色保护层 D.铁与稀硫酸反应时,加少量 CuSO4 反应明显变快 解析:选 C 黄铜(CuZn 合金)发生原电池反应时,Zn 为负极,Cu 为正极,Zn 被氧 化,铜被保护,与原电池有关;B 项,锌比铁活泼,锌、铁与外部环境一起形成原电池,锌 被氧化,铁被保护,与原电池有关;C 项,红热的铁丝与水直接反应生成 Fe3O4,与原电池 无关;D 项,铁与硫酸铜反应生成铜,铁、铜、稀硫酸形成原电池,反应加快,与原电池有 关。 3.关于铅蓄电池的说法正确的是( ) A.在放电时,正极发生的反应是 Pb(s)+SO2-4 (aq)-2e-===PbSO4(s) B.在放电时,该电池的负极材料是铅板 C.在充电时,电池中硫酸的浓度不断变小 D.在充电时,阳极发生的反应是 PbSO4(s)+2e- === Pb(s)+SO24 -(aq) 解析:选 B A 项,放电时正极发生还原反应,此电极反应式是氧化反应,错误;B 项, 铅蓄电池的负极材料是铅板,正确;C 项,放电时硫酸浓度不断变小,充电时硫酸浓度不断 变大,错误;D 项,阳极发生的是氧化反应,此电极反应式是还原反应,错误。 4.控制适合的条件,将反应 Fe3++AgFe2++Ag+设计成如图所示的原电池(盐桥 装有琼脂—硝酸钾溶液;灵敏电流计的 0 刻度居中,左右均有刻度)。已知接通后观察到电 流计指针向右偏转。下列判断正确的是( ) A.盐桥中的 K+移向乙烧杯 B.一段时间后,电流计指针反向偏转,越过 0 刻度,向左边偏转 C.在外电路中,电子从石墨电极流向银电极 D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 解析:选 D 该原电池中,Ag 失电子作负极,石墨作正极,盐桥中 K+移向正极(甲烧 杯);一段时间后,原电池反应结束,电流计指针指向 0;原电池外电路电子由负极流向正 极,所以电子从银电极流向石墨电极;电流计指针居中后,往甲烧杯中加入一定量的铁粉, 由 2Fe3++Fe===3Fe2+,c(Fe3+)降低,c(Fe2+)增大,该平衡向左移动,故电流计指针向左 偏转。 5.(2015·天津高考)锌铜原电池装置如图所示,其中阳离子 交换膜只允许阳离子和水分子通过,下列有关叙述正确的是 ( ) A.铜电极上发生氧化反应 B.电池工作一段时间后,甲池的 c(SO2-4 )减小 C.电池工作一段时间后,乙池溶液的总质量增加 D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 解析:选 C A 项,Cu 作正极,电极上发生还原反应,错误;B 项,电池工作过程中, SO 2-4 不参加电极反应,故甲池的 c(SO2-4 )基本不变,错误;C 项,电池工作时,甲池反应 为 Zn-2e-===Zn2+,乙池反应为 Cu2++2e-===Cu,甲池中 Zn2+会通过阳离子交换膜进 入乙池,以维持溶液中电荷平衡,由电极反应式可知,乙池中每有 64 g Cu 析出,则进入乙 池的 Zn2+为 65 g,溶液总质量略有增加,正确;D 项,由题干信息可知,阴离子不能通过 阳离子交换膜。 6.(2013·广东高考)(1)能量之间可相互转化:电解食盐水制备 Cl2 是将电能转化为化学 能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。 限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。 ①完成原电池甲的装置示意图(见图),并作相应标注。 要求:在同一烧杯中,电极与溶液含相同的金属元素。 ②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一 段时间后,可观察到负极________。 ③甲、乙两种原电池中可更有效地将化学能转化为电能的是________,其原因是 ____________________________________________________________________________。 (2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在限选材料中 应选________作阳极。 解析:(1)①根据电子的流向知,左烧杯中电极为负极,右烧杯中电极为正极。②负极 可以是 Zn 或 Fe, 可以观察到负极逐渐溶解。③甲电池能更有效地将化学能转化为电能。(2) 利用牺牲阳极的阴极保护法原理,减缓铁片的腐蚀时,选择比 Fe 活泼的 Zn 作阳极。 答案:(1)①如图所示(合理即可) ②逐渐溶解(质量减少) ③甲 甲使用了盐桥,避免 负极金属直接与溶液中的铜离子反应而造成能量损失 (2)锌片 高考研究——把握考情,方向不对努力白费 考 纲 要 求 高 频 考 点 1.原电池电极反应式总反 应方程式的书写 5 年 5 考 1.理解原电池的构成、工作原理及应用。 2.能书写电极反应和总反应方程式。 3.了解常见化学电源的种类及其工作原理。 2.新型化学电源 5 年 4 考 原电池电极反应式、总反应方程式的书写 [高考这样考] 1.(2016·全国丙卷)锌空气燃料电池可用作电动车动力电源,电池的电解质溶液为 KOH 溶液,反应为 2Zn+O2+4OH-+2H2O===2Zn(OH)2-4 。下列说法正确的是( ) A.充电时,电解质溶液中 K+向阳极移动 B.充电时,电解质溶液中 c(OH-)逐渐减小 C.放电时,负极反应为 Zn+4OH--2e-===Zn(OH)2-4 D.放电时,电路中通过 2 mol 电子,消耗氧气 22.4 L(标准状况) 解析:选 C A 项,充电时装置为电解池,溶液中的阳离子向阴极移动。B 项,充电时 的总反应为放电时的逆反应:2Zn(OH)2-4 ===2Zn+O2+4OH-+2H2O,c(OH-)逐渐增大。 C 项,放电时负极失电子发生氧化反应,由放电时的总反应可知,负极反应式为 Zn+4OH- -2e-===Zn(OH)2-4 。D 项,由放电时的总反应可知,电路中通过 2 mol 电子时,消耗 0.5 mol O2,其体积为 11.2 L(标准状况)。 2.(2013·全国卷Ⅰ)银质器皿日久表面会逐渐变黑,这是生成了 Ag 2S 的缘故。根据电 化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中, 一段时间后发现黑色会褪去。下列说法正确的是( ) A.处理过程中银器一直保持恒重 B.银器为正极,Ag2S 被还原生成单质银 C.该过程中总反应为 2Al+3Ag2S===6Ag+Al2S3 D.黑色褪去的原因是黑色 Ag2S 转化为白色 AgCl 解析:选 B 根据信息可知在银器处理过程中运用了原电池原理,铝质容器作负极,电 极反应为 2Al-6e-===2Al3+;银器作正极,电极反应为 3Ag2S+6e-===6Ag+3S2-;继而 Al3+和 S2-发生互相促进的水解反应:2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑,故原 电池的总反应为 3Ag2S+2Al+6H2O===6Ag+2Al(OH)3+3H2S↑,故 C 错误。黑色褪去的 原因是 Ag2S 被还原为 Ag,此过程中银器质量逐渐减小,故 A、D 错误,B 正确。 3.(2015·全国卷Ⅱ节选)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳 棒,其周围是由碳粉、MnO2、ZnCl2 和 NH4Cl 等组成的糊状填充物。该电池放电过程产生 MnOOH。回收处理该废电池可得到多种化工原料。回答下列问题: (1) 该 电 池 的 正 极 反 应 式 为 ______________________ , 电 池 反 应 的 离 子 方 程 式 为 ________________________________________________________________________。 (2)维持电流强度为 0.5 A,电池工作 5 分钟,理论上消耗锌________g。(已知 F=96 500 C·mol-1) 解析:(1)酸性锌锰干电池中正极上发生还原反应,该电池放电过程中产生 MnOOH, 则正极反应式为 MnO2+H++e-===MnOOH。金属锌作负极,发生氧化反应生成 Zn2+, 则负极反应式为 Zn-2e-===Zn2+,结合得失电子守恒可得电池反应式为 2MnO2+2H++ Zn===2MnOOH+Zn2+。 (2)电流强度为 I=0.5 A,时间为 t=5 min=300 s,则通过电极的电量为 Q=It=0.5 A×300 s=150 C,又知 F=96 500 C·mol-1,故通过电子的物质的量为 150 C 96 500 C·mol-1≈0.001 6 mol,则理论上消耗 Zn 的质量为 65 g·mol-1×0.001 6 mol×1 2 ≈0.05 g。 答案:(1)MnO2+H++e-===MnOOH 2MnO2+Zn+2H+===2MnOOH+Zn2+ [注:式中 Zn2+可写为 Zn(NH3)2+4 ,Zn(NH3)2Cl2 等,H+可写为 NH+4 ] (2)0.05 [师说高考] 知考情 电极反应式及总反应方程式的书写是每年高考必考内容,选择题和填空题中 都会出现,常结合新型化学电源进行考查 明考向 根据原电池电极反应的特点,从氧化还原反应的基本原理入手,结合得失电 子守恒,书写出两极反应框架,再结合电荷守恒或反应物的酸碱性,在方程 式左边或右边补充 H+、OH-或 H2O 等,进行配平即可,也可灵活应用“加 减法”书写 [备考这样办] 突破点 1 一般电极反应式的书写 1.书写步骤 2.常见介质 常见介质 注意事项 中性溶液 反应物若是 H+得电子或 OH-失电子,则 H+或 OH-均来自于水的电离 酸性溶液 反应物或生成物中均没有 OH- 碱性溶液 反应物或生成物中均没有 H+ 水溶液 不能出现 O2- [对点训练] 1.(2016·四川高考)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为 Li1-xCoO2+LixC6===LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( ) A.放电时,Li+在电解质中由负极向正极迁移 B.放电时,负极的电极反应式为 LixC6-xe-===xLi++C6 C.充电时,若转移 1 mol e-,石墨(C6)电极将增重 7x g D.充电时,阳极的电极反应式为 LiCoO2-xe-===Li1-xCoO2+xLi+ 解析:选 C A.原电池中阳离子由负极向正极迁移,正确;B.放电时,负极发生氧化 反应,电极反应式为 LixC6-xe-===xLi++C6,正确;C.充电时,若转移 1 mol 电子,石墨 电极质量将增重 7 g,错误;D.充电时阳极发生氧化反应,电极反应式为 LiCoO2-xe-===Li1 -xCoO2+xLi+,正确。 2.(2016·北京高考节选)用零价铁(Fe)去除水体中的硝酸盐(NO -3 )已成为环境修复研究 的热点之一。 Fe 还原水体中 NO -3 的反应原理如图所示。 (1)作负极的物质是________。 (2)正极的电极反应式是____________________________________________。 解析:(1)根据反应原理的图示可知,Fe 作负极,正极上 NO -3 得电子生成 NH+4 ,结合 电荷守恒和原子守恒写出电极反应式为 NO-3 +8e-+10H+===NH+4 +3H2O。 答案:(1)Fe (2)NO-3 +8e-+10H+===NH+4 +3H2O 3.NOx 是汽车尾气中的主要污染物之一。通过 NOx 传感器可监测 NOx 的含量,其工 作原理示意图如下: (1)Pt 电极上发生的是________反应(填“氧化”或“还原”)。 (2)写出 NiO 电极的电极反应式:_______________________________________。 答案:(1)还原 (2)NO+O2--2e-===NO2 4.锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂 (LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为 6C+xLi++ xe-===LixC6。充放电过程中,发生 LiCoO2 与 Li1-xCoO2 之间的转化,写出放电时电池反 应方程式_________________________________________________________________。 解析:由充电时阴极(题目中锂离子电池的负极)的电极反应式知,放电时 LixC6 是反应 物、Li+是生成物,锂的价态升高,故另一反应物中钴的价态降低,由此知该反应物是 Li1- xCoO2,相应的反应方程式为 LixC6+Li1-xCoO2===LiCoO2+6C。 答案:Li1-xCoO2+LixC6===LiCoO2+6C 5.与 MnO2Zn 电池类似,K2FeO4Zn 也可以组成碱性电池,K2FeO4 在电池中作为正 极材料,其电极反应式为________________________________,该电池总反应的离子方程 式为________________________________________________________________________。 解析:根据题意可写出题给原电池的负极反应式为 Zn-2e-+2OH-===Zn(OH)2,总 反应式为 3Zn+2FeO2-4 +8H2O===3Zn(OH)2+2Fe(OH)3+4OH-。用总反应式减去负极反 应式可得正极反应式为 FeO2-4 +3e-+4H2O===Fe(OH)3+5OH-。 答案:FeO2-4 +3e-+4H2O===Fe(OH)3+5OH- 3Zn+2FeO2-4 +8H2O===3Zn(OH)2+2Fe(OH)3+4OH- 6.铁炭混合物在水溶液中可形成许多微电池。将含有 Cr2O 2-7 的酸性废水通过铁炭混 合 物 , 在 微 电 池 正 极 上 Cr2O 2-7 转 化 为 Cr3 + , 其 电 极 反 应 式 为 ____________________________。 解析:由题意知,正极上 Cr2O 2-7 得电子生成 Cr3+,其电极反应式为 Cr2O2-7 +6e-+ 14H+===2Cr3++7H2O。 答案:Cr2O2-7 +6e-+14H+===2Cr3++7H2O 突破点 2 3 步突破燃料电池电极反应式的书写 第一步:写出电池总反应式 燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应则总反应为加和后 的反应。 如甲烷燃料电池(电解质为 NaOH 溶液)的反应式为 CH4+2O2===CO2+2H2O ① CO2+2NaOH===Na2CO3+H2O ② ①式+②式得燃料电池总反应式为 CH4+2O2+2NaOH===Na2CO3+3H2O。 第二步:写出电池的正极反应式 根据燃料电池的特点,一般在正极上发生还原反应的物质是 O2,随着电解质溶液的不 同,其电极反应式有所不同,大致有以下四种情况: (1)酸性电解质溶液环境下电极反应式: O2+4H++4e-===2H2O; (2)碱性电解质溶液环境下电极反应式: O2+2H2O+4e-===4OH-; (3)固体电解质(高温下能传导 O2-)环境下电极反应式: O2+4e-===2O2-; (4)熔融碳酸盐(如熔融 K2CO3)环境下电极反应式: O2+2CO2+4e-===2CO2-3 。 第三步:根据电池总反应式和正极反应式,写出负极反应式 电池反应的总反应式-电池正极反应式=电池负极反应式。因为 O2 不是负极反应物, 因此两个反应式相减时要彻底消除 O2。 [对点训练] 7.(2015·江苏高考)一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法 正确的是( ) A.反应 CH4+H2O =====催化剂 △ 3H2+CO,每消耗 1 mol CH4 转移 12 mol 电子 B.电极 A 上 H2 参与的电极反应为 H2+2OH--2e-===2H2O C.电池工作时,CO 2-3 向电极 B 移动 D.电极 B 上发生的电极反应为 O2+2CO2+4e-===2CO2-3 解析:选 D A 选项,甲烷中的 C 为-4 价,一氧化碳中的 C 为+2 价,每个碳原子失 去 6 个电子,因此每消耗 1 mol 甲烷失去 6 mol 电子,错误;B 选项,熔融盐中没有氢氧根 离子,因此氢氧根离子不能参与电极反应,电极反应式应为 H2+CO+2CO2-3 -4e-===3CO2 +H2O,错误;C 选项,碳酸根离子应向负极移动,即向电极 A 移动,错误;D 选项,电 极 B 上氧气和二氧化碳得电子生成碳酸根离子,正确。 8.写出甲烷燃料电池在不同环境下的电极反应式及总反应式。 (1)固体电解质(高温下能传导 O2-) 负极:______________________________________________________________; 正极:_______________________________________________________________; 总反应式:_________________________________________________________________。 (2)熔融碳酸盐(如熔融 K2CO3)环境下 负极:______________________________________________________________; 正极:______________________________________________________________; 总反应式:__________________________________________________________。 答案:(1)CH4-8e-+4O2-===CO2+2H2O 2O2+8e-===4O2- CH4+2O2===CO2+2H2O (2)CH4-8e-+4CO2-3 ===5CO2+2H2O 2O2+8e-+4CO2===4CO2-3 CH4+2O2===CO2+2H2O 9.(1)(2013·全国卷Ⅰ节选)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密 度高于甲醇直接燃料电池(5.93 kW·h·kg -1)。若电解质为酸性,二甲醚直接燃料电池的负极 反 应 为 _______________________ , 一 个 二 甲 醚 分 子 经 过 电 化 学 氧 化 , 可 以 产 生 ________________ 个 电 子 的 电 量 ; 该 电 池 的 理 论 输 出 电 压 为 1.20 V , 能 量 密 度 E = ________________(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×10 6 J)。 (2)(2011·全国卷节选)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的 反 应 式 为 ________________________________________________________________________、 正极的反应式为________________。理想状态下,该燃料电池消耗 1 mol 甲醇所能产 生的最大电能为 702.1 kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指 电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,用醇的燃烧热 ΔH=- 726.5 kJ·mol-1)。 解析:(1)酸性电解质中,二甲醚燃烧方程式为 CH3OCH3+3O2===2CO2+3H2O,正极 反应式为 3O2+12e -+12H +===6H2O,由总反应式减去正极反应式得负极反应式为 CH3OCH3-12e-+3H2O===2CO2+12H+。 (2)酸性电解质中,甲醇燃烧反应方程式为 CH3OH+3 2O2===CO2+2H2O,正极反应式 为 3 2O2+6e-+6H+===3H2O,由燃烧反应方程式减去正极反应式得负极反应式 CH3OH-6e -+H2O===CO2+6H+。根据理论效率的计算方法,该燃料电池的理论效率为:702.1 kJ 726.5 kJ ×100%≈96.6%。 答案:(1)CH3OCH3-12e-+3H2O===2CO2+12H+ 12 1.20 V × 1 000 g 46 g·mol-1 × 12 × 96 500 C·mol-1 1 kg ÷(3.6×106J·kW-1·h-1)=8.39 kW·h·kg -1 (2)CH3OH-6e-+H2O===CO2+6H+ 3 2O2+6H++6e-===3H2O 96.6% 新型化学电源 [高考这样考] 1.(2016·全国甲卷)MgAgCl 电池是一种以海水为电解质溶液的水激活电池。下列叙述 错误的是( ) A.负极反应式为 Mg-2e-===Mg2+ B.正极反应式为 Ag++e-===Ag C.电池放电时 Cl-由正极向负极迁移 D.负极会发生副反应 Mg+2H2O===Mg(OH)2+H2↑ 解析:选 B MgAgCl 电池的电极反应:负极 Mg-2e -===Mg2+,正极 2AgCl+2e- ===2Ag+2Cl-,A 项正确,B 项错误。在原电池的电解质溶液中,阳离子移向正极,阴离 子移向负极,C 项正确。Mg 是活泼金属,能和 H2O 发生反应生成 Mg(OH)2 和 H2,D 项正 确。 2.(2015·全国卷Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其 工作原理如图所示。下列有关微生物电池的说法错误的是( ) A.正极反应中有 CO2 生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为 C6H12O6+6O26CO2+6H2O 解析:选 A 图示所给出的是原电池装置。A.有氧气反应的一极为正极,发生还原反应, 因为有质子通过,故正极电极反应式为 O2+4e-+4H+===2H2O,C6H12O6 在微生物的作用 下发生氧化反应,电极反应式为 C6H12O6-24e-+6H2O===6CO2+24H+,负极上有 CO2 产 生,故 A 不正确。B.微生物电池是指在微生物作用下将化学能转化为电能的装置,所以微 生物促进了反应中电子的转移,故 B 正确。C.质子是阳离子,阳离子由负极区移向正极区, 故 C 正确。D.正极的电极反应式为 6O2+24e-+24H+12H2O,负极的电极反应式为 C6H12O6 -24e-+6H2O===6CO2+24H+,两式相加得电池总反应为 C6H12O6+6O2===6CO2+6H2O, 故 D 正确。 3.(2014·全国卷Ⅱ)2013 年 3 月我国科学家报道了如图所示的水溶液锂离子电池体系。 下列叙述错误的是( ) A.a 为电池的正极 B.电池充电反应为 LiMn2O4===Li1-xMn2O4+xLi C.放电时,a 极锂的化合价发生变化 D.放电时,溶液中 Li+从 b 向 a 迁移 解析:选 C 图示所给出的是原电池装置。A.由图示分析,金属锂易失电子,由原电池 原理可知,含有锂的一端为原电池的负极,即 b 为负极,a 为正极,故正确。B.电池充电时 为电解池,反应式为原电池反应的逆反应,故正确。C.放电时,a 极为原电池的正极,发生 还原反应的是 Mn 元素,锂元素的化合价没有变化,故不正确。D.放电时为原电池,锂离子 为阳离子,应向正极(a 极)迁移,故正确。 4.(2013·全国卷Ⅱ)“ZEBRA”蓄电池的结构如图所示,电极材料多孔 Ni/NiCl 2 和金属 钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( ) A.电池反应中有 NaCl 生成 B.电池的总反应是金属钠还原三价铝离子 C.正极反应为 NiCl2+2e-===Ni+2Cl- D.钠离子通过钠离子导体在两电极间移动 解析:选 B 该电池总反应为 2Na+NiCl2===2NaCl+Ni,因此有 NaCl 生成,A 项正 确;电池总反应为 Na 还原 Ni2+,B 项错误;正极为 NiCl2 发生还原反应:NiCl2+2e-===Ni +2Cl-,C 项正确;钠离子通过钠离子导体由负极移向正极,D 项正确。 [师说高考] 知考情 新型化学电源几乎是高考每年必考,题目往往与生产、生活及新科技等相联 系,题材广、信息新、陌生度大,考查考生阅读相关材料、提炼关键信息或 结合图示等综合分析的能力、知识迁移的能力,具有一定的难度 明考向 复习时,必须熟练掌握原电池正负极的判断、电极产物的判断、溶液 pH 变 化、离子移动方向的判断等知识,熟练书写电极反应式并能灵活运用得失电 子守恒原理进行相关计算 [备考这样办] 1.正、负极的判断 负极材料 元素化合价升高的物质;发生氧化反应的物质 正极材料 元素化合价降低的物质;发生还原反应的物质 2.“放电”时正极、负极电极反应式的书写 (1)分析物质得失电子的情况。 (2)考虑电极反应生成的物质是否跟电解质溶液中的离子发生反应。 (3)对于较为复杂的电极反应,可以利用“总反应式-较简单一极的电极反应式=较复 杂一极的电极反应式”的方法解答。 3.“充电”时阴极、阳极的判断 (1)明确原电池放电时的正、负极。 (2)根据电池充电时阳极接正极、阴极接负极的原理进行分析。 (3)电极反应式,放电时的负极与充电时的阴极、放电时的正极与充电时的阳极分别互 逆。 4.充、放电时电解质溶液中离子移动方向的判断 分析电池工作过程中电解质溶液的变化时,要结合电池总反应进行分析。 (1)首先应分清电池是放电还是充电。 (2)再判断出正、负极或阴、阳极。 放电:阳离子→正极,阴离子→负极; 充电:阳离子→阴极,阴离子→阳极; 总之:阳离子→发生还原反应的电极; 阴离子→发生氧化反应的电极。 [过关这样练] 1.某电池以 K2FeO4 和 Zn 为电极材料,KOH 溶液为电解质溶液。下列说法正确的是 ( ) A.Zn 为电池的正极 B.正极反应式为 2FeO2-4 +10H++6e-===Fe2O3+5H2O C.该电池放电过程中电解质溶液浓度不变 D.电池工作时 OH-向负极迁移 解析:选 D A.根据化合价升降判断,Zn 化合价只能上升,故为负极材料,K2FeO4 为正极材料,错误;B.KOH 溶液为电解质溶液,则正极电极方程式为 2FeO2-4 +6e-+8H2O ===2Fe(OH)3+10OH-,错误;C.由电池总反应式 3Zn+2K 2FeO4+8H2O===3Zn(OH)2+ 2Fe(OH)3+4KOH 可得,电解质溶液浓度变大,错误;D.电池工作时阴离子 OH-向负极迁 移,正确。 2.(2016·浙江高考)金属(M)空气电池(如图)具有原料易得、能量密度高等优点,有望 成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为 4M+nO 2 + 2nH2O===4M(OH)n 已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下 列说法不正确的是( ) A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电 极表面 B.比较 Mg、Al、Zn 三种金属空气电池,Al空气电池的理论比能量最高 C.M空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-===4M(OH)n D.在 Mg空气电池中,为防止负极区沉积 Mg(OH)2,宜采用中性电解质及阳离子交 换膜 解析:选 C 金属 M 失电子作负极,由总反应式 4M+nO2+2nH2O===4M(OH)n 推出 正极反应物是 O2。多孔石墨电极主要是增大接触面积,有利于气体的扩散与反应,A 项正 确;单位质量释放电能最大也就是转移电子数最多,转移相同电子数所需 Al 的质量最小, 也就是理论比能量最高,B 项正确;中间是阴离子交换膜,所以 Mn+不会转移到正极参与 反应,正极反应式应为 O2+2H2O+4e-===4OH-,C 项错误;Mg空气电池中,容易在负 极生成 Mg(OH)2 沉淀,采用阳离子交换膜,则 Mg2+转移到正极反应生成沉淀,同时负极 区不能显碱性,D 项正确。 3.某原电池装置如图所示,电池总反应为 2Ag+Cl2===2AgCl。下列说法正确的是( ) A.正极反应为 AgCl+e-===Ag+Cl- B.放电时,交换膜右侧溶液中有大量白色沉淀生成 C.若用 NaCl 溶液代替盐酸,则电池总反应随之改变 D.当电路中转移 0.01 mol e-时,交换膜左侧溶液中约减少 0.02 mol 离子 解析:选 D 在原电池中负极发生氧化反应,正极发生还原反应,故由总反应式可知, 负极反应为:2Ag-2e-+2Cl-===2AgCl,正极反应为:Cl2+2e-===2Cl-,A 项错误;由 于电解质溶液中含有大量 Cl-,故放电时,Ag+在交换膜左侧即与 Cl-反应生成 AgCl 沉淀, B 项错误;用 NaCl 溶液代替盐酸,电池总反应不变,C 项错误;电路中转移 0.01 mol e-时, 交换膜左侧溶液有 0.01 mol Cl-参与反应生成 AgCl 沉淀,还有 0.01 mol H+通过阳离子交 换膜进入右侧溶液,故 D 项正确。 [课堂巩固落实练] 1.(2017·昆明测试)直接供氨式固态氧化物燃料电池的结构如图所示。下列有关该电池 的说法正确的是( ) A.通入氧气的电极是正极,氧气发生氧化反应 B.正极的电极反应式为 O2+4e-+2H2O===4OH- C.该燃料电池可直接将化学能全部转化为电能 D.负极的电极反应式为 2NH3-6e-+3O2-===N2+3H2O 解析:选 D 通入 O2 的电极是正极,O2 发生还原反应,A 错误;该电池的电解质是固 态氧化物,其中自由移动的阴离子是 O2-,正极的电极反应式应为 O2+4e-===2O2-,B 错 误;该燃料电池的能量转化效率较高,但不能将化学能全部转化为电能,C 错误;在负极 NH3 发生氧化反应生成 N2 和水,D 正确。 2.如图所示为以葡萄糖为燃料的微生物燃料电池的结构示意图。关于该电池的叙述不 正确的是( ) A.该电池不能在高温下工作 B.电池的负极反应为 C6H12O6+6H2O-24e-===6CO2↑+24H+ C.放电过程中,电子从正极区向负极区每转移 1 mol,便有 1 mol H+从阳极室进入阴 极室 D.微生物燃料电池具有高能量转换效率、原料广泛、操作条件温和、有生物相容性等 优点,值得研究与推广 解析:选 C 高温条件下微生物会死亡,电池不能正常工作,A 正确;电池的负极上燃 料,发生氧化反应,即葡萄糖失电子生成 CO2 气体,B 正确;放电过程中,电子从负极沿 导线移向正极,C 错误;结合题给条件分析,D 正确。 3.(2017·宁波模拟)肼(N 2H4)空气燃料电池是一种碱性燃料电 池,电解质溶液是 20%~30%的 KOH 溶液。下列说法中,不正 确的是( ) A.该电池放电时,通入肼的一极为负极 B.电池每释放 1 mol N2 转移的电子数为 4NA C.通入空气的一极的电极反应式是 O2+2H2O+4e-===4OH- D.电池工作一段时间后,电解质溶液的 pH 将不变 解析:选 D 该电池中肼是燃料,在负极通入,A 正确;肼中氮元素的化合价是-2 价, 氧化产物是 N2,负极反应为 N2H4+4OH--4e-===4H2O+N2↑,所以每释放 1 mol N2 转 移的电子数为 4NA ,B 正确;通入空气的一极为正极,正极上 O2 发生还原反应,反应式是 O2+2H2O+4e-===4OH-,C 正确;电池总反应为 N2H4+O2===N2↑+2H2O,反应生成水, 溶液浓度降低,电解质溶液的 pH 将降低,D 错误。 4.(2017·衡水模拟)某充电宝锂离子电池的总反应为 nLi+Li 1 - nMn2O4 放电 充电 LiMn2O4,某手机镍氢电池总反应为 NiOOH+MH 放电 充电 M+Ni(OH)2(M 为储氢金属或 合金),有关上述两种电池的说法不正确的是( ) A.锂离子电池放电时 Li+向正极迁移 B.锂离子电池充电时,阴极的电极反应式:LiMn2O4-ne-===Li1-nMn2O4+nLi C.如图表示用锂离子电池给镍氢电池充电 D.镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e-===Ni(OH)2+OH- 解析:选 B A 项,电池放电时阳离子移向正极,所以 Li+向正极移动,正确;B 项, 锂离子电池充电时,阴极的电极反应式:Li++e-===Li,错误;C 项,充电时,正极接正 极,负极接负极,正确;D 项,放电时,正极发生还原反应,电极反应式为 NiOOH+e-+ H2O===Ni(OH)2+OH-,正确。 5.(2017·焦作模拟)LiFePO4 电池具有稳定性高、安全、对环境友好等优点,可用于电 动汽车。电池反应为 FePO4+Li 放电 充电 LiFePO4,电池的正极材料是 LiFePO4,负极材料 是石墨,含 Li+导电固体为电解质。下列有关 LiFePO4 电池说法正确的是( ) A.可加入硫酸以提高电解质的导电性 B.放电时电池内部 Li+向负极移动 C.充电过程中,电池正极材料的质量增多 D.放电时电池正极反应为 FePO4+Li++e-===LiFePO4 解析:选 D 放电时,负极:Li-e—===Li+,正极:FePO4+Li++e-===LiFePO4;充 电时,阳极:LiFePO4-e—===FePO4+Li+,阴极:Li++e—===Li,D 正确。负极反应物为 Li,若加入硫酸,与 Li 单质(固体)发生反应,A 错误;放电时,Li+向正极移动,B 错误; 充电过程中,正极材料参加了反应,质量减少,C 错误。 6.(2017·成都模拟)某种聚合物锂离子电池放电时的反应为 Li1-xCoO2+LixC6===6C+ LiCoO2,其电池如图所示。下列说法不正确的是( ) A.放电时,LixC6 发生氧化反应 B.充电时,Li+通过阳离子交换膜从左向右移动 C.充电时,将电池的负极与外接电源的负极相连 D.放电时,电池的正极反应为 Li1-xCoO2+xLi++xe-===LiCoO2 解析:选 B 反应时,Li1-xCoO2 中 Co 元素化合价降低,发生还原反应,作正极,LixC6 作负极,发生氧化反应,A 正确;充电时,电池负极作电解池的阴极,阳离子向阴极移动, Li+应从右向左移动,B 错误;充电时,电池的负极与外接电源的负极相连,C 正确;放电 时,负极反应为 LixC6-xe-===xLi++6C,由电池反应减去负极反应得正极反应为 Li1- xCoO2+xe-+xLi===LiCoO2,D 正确。 [课下高考达标练] [本节过关达标练] 1.某原电池总反应为 Cu+2Fe3+===Cu2++2Fe2+,下列能实现该反应的原电池是( ) 选项 A B C D 电极材料 Cu、Zn Cu、C Fe、Zn Cu、Ag 电解液 FeCl3 Fe(NO3)2 CuSO4 Fe2(SO4)3 解析:选 D 由题意知,Cu 为负极材料,正极材料的金属活动性必须弱于 Cu,其中 B、D 项符合该条件;由 Fe3+得电子生成 Fe2+知,电解质溶液中必须含有 Fe3+,同时符合 上述两条件的只有 D 项。 2.一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成 H2 的总量, 可采取的措施是( ) A.加入少量稀 NaOH 溶液 B.加入少量 CH3COONa 固体 C.加入少量 NH4HSO4 固体 D.加入少量 CuSO4 溶液 解析:选 D A 中加入 NaOH 溶液,消耗盐酸,氢气的生成量减少,错误;B 中加入 CH3COONa,CH3COO-会结合 H+,生成醋酸,减慢反应速率,错误;C 中加入 NH4HSO4 固体,增加了 H+的量,生成的氢气增多,错误;D 中加入少量 CuSO4 溶液,Zn 置换出少 量 Cu 附着在锌表面,形成原电池可以加快反应速率,并且没有影响氢气的生成量,正确。 3.(2017·聊城模拟)将镁片、铝片平行插入一定浓度的 NaOH 溶液中,用导线连接成闭 合回路,该装置在工作时,下列叙述正确的是( ) A.镁比铝活泼,镁失去电子被氧化成 Mg2+ B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成 C.该装置的内、外电路中,均是电子的定向移动形成电流 D.该装置开始工作时,铝片表面的氧化膜可以不必处理 解析:选 D 铝、镁在 NaOH 溶液中构成原电池,Mg 不反应,铝与 NaOH 溶液反应, 镁为正极,铝为负极,负极反应 Al-3e-+4OH-===AlO-2 +2H2O,开始工作时溶液中没有 白色沉淀生成,A、B 错误;电子从铝极流出经导线流向镁极,溶液中阴离子移向负极,阳 离子向正极移动,C 错误;氧化铝溶于氢氧化钠溶液,D 正确。 4.(2017·开封模拟)如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电 极 X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( ) A.溶液中的 SO 2-4 向 Y 极移动 B.若两电极分别为铁和碳棒,则 X 为碳棒,Y 为铁 C.X 极上发生的是还原反应,Y 极上发生的是氧化反应 D.若两电极都是金属,则它们的活动性顺序为 X>Y 解析:选 D A 项,根据电子流向知,X 是负极、Y 是正极,溶液中的 SO2-4 移向负极, 即 X 极,错误;B 项,因为 X 是负极、Y 是正极,所以若两电极分别为铁和碳棒,则 X 为 铁,Y 为碳棒,错误;C 项,负极 X 上发生氧化反应、正极 Y 上发生还原反应,错误;D 项,原电池中,活泼的金属作负极,若两电极都是金属,则它们的活动性顺序为 X>Y,正 确。 5.(2017·潍坊二模)某兴趣小组同学利用氧化还原反应:2KMnO 4 +10FeSO 4 + 8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O 设计如下原电池,盐桥中装有饱和 K2SO4 溶液。下列说法正确的是( ) A.b 电极上发生还原反应 B.外电路电子的流向是从 a 到 b C.电池工作时,盐桥中的 SO 2-4 移向甲烧杯 D.a 电极上发生的反应为 MnO-4 +8H++5e-===Mn2++4H2O 解析:选 D 根据化学方程式和图示判断,b 极是 FeSO4 发生氧化反应,为负极,A 错 误;b 为负极,a 为正极,电子从 b 流向 a,B 错误;盐桥中的 SO 2-4 移向乙烧杯,C 错误; a 极上发生还原反应,Mn 元素的化合价降低,电极反应为 MnO-4 +8H++5e-===Mn2++ 4H2O,D 正确。 6.(2016·上海高考)图 1 是铜锌原电池示意图。图 2 中,x 轴表示实验时流入正极的电 子的物质的量,y 轴表示( ) A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO2-4 ) 解析:选 C 该原电池装置中,Zn 是负极,Cu 是正极。A 项,在正极 Cu 上,溶液中 的 H+获得电子变为氢气,Cu 棒的质量不变,错误;B 项,由于 Zn 是负极,不断发生反应 Zn-2e-===Zn2+,溶液中 c(Zn2+)增大,错误;C 项,由于反应不断消耗 H+,溶液的 c(H +)逐渐降低,正确;D 项,SO 2-4 不参加反应,其浓度不变,错误。 7.(2017·日照模拟)利用生活中常见的材料可以进行很多科学实验,下图就是一个用废 旧材料制作的可用于驱动玩具的电池示意图。当电池工作时,有关说法正确的是( ) A.铝罐将逐渐被腐蚀 B.该电池驱动电动玩具时,石墨棒应与玩具电机的负极相连 C.石墨棒上发生的反应为 O2-4e-+2H2O===4OH- D.该电池工作一段时间后石墨棒的质量会减轻 解析:选 A 该电池中铝是负极,则铝罐逐渐被腐蚀,A 正确;铝作负极,石墨作正极, 石 墨 棒 应 与 玩 具 电 机 正 极 相 连 , B 错 误 ; 正 极 石 墨 棒 上 发 生 的 反 应 为 O2 + 4e - + 2H2O===4OH-,C 错误;石墨棒不参与电极反应,其质量不变,D 错误。 8.(2017·漳州模拟)一种微生物燃料电池的结构示意图如图所 示,关于该电池的叙述正确的是( ) A.电池工作时,电子由 a 流向 b B.微生物所在电极区放电时发生还原反应 C.放电过程中,H+从正极区移向负极区 D.正极反应式为 MnO2+4H++2e-===Mn2++2H2O 解析:选 D 由 a 极上 MnO2―→Mn2+知,a 极上发生还原反应,a 作正极,b 作负极, 电池工作时电子由 b 极经外电路流向 a 极,A 项错误;微生物所在电极区放电时发生氧化反 应,B 项错误;H+向正极移动,C 项错误;放电时正极发生还原反应,D 项正确。 9.(2017·江西重点中学联考)以熔融 Li 2CO3 和 K2CO3 为电解质,天然气经重整催化作 用提供反应气的燃料电池如下图。下列说法正确的是( ) A.以此电池为电源电解精炼铜,当有 0.1 mol e-转移时,有 3.2 g 铜溶解 B.若以甲烷为燃料气时负极反应式:CH4+5O2--8e-===CO2-3 +2H2O C.该电池使用过程中需补充 Li2CO3 和 K2CO3 D.空气极发生的电极反应式为 O2+4e-+2CO2===2CO2-3 解析:选 D 因为电解精炼铜时,粗铜作阳极,粗铜中的 Zn、Fe 等活泼金属均失电子, 所以溶解的铜小于 0.05 mol,质量小于 3.2 g,A 错误;若以甲烷为燃料气时,因为电解质 中无 O2-,O2-不参加反应,CO 2-3 参加反应,正确的负极反应式为 CH4+4CO2-3 -8e- ===5CO2+2H2O,正极反应式为 O2+4e-+2CO2===2CO2-3 ,反应中没有消耗 Li2CO3 和 K2CO3,不需要补充,B、C 错误,D 正确。 10.(2017·孝感模拟)我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次 电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为 V2O5+xLi 放电 充电 LixV2O5。下列说法中正确的是( ) A.电池在放电时,Li+向负极移动 B.锂在放电时作正极,充电时作阳极 C.该电池充电时阳极的反应为 LixV2O5-xe-===V2O5+xLi+ D.V2O5 只是锂发生反应的载体,不参与电池反应 解析:选 C 电池在放电时,Li+向正极移动,A 错误;锂在放电时作负极,充电时作 阴极,B 错误;该电池充电时阳极发生氧化反应,电极反应式是 LixV2O5-xe-===V2O5+xLi +,C 正确;V2O5 参与电池反应,D 错误。 11.(1)Fe 和 KClO4 反应放出的热量,能为熔融盐电池提供 550~660 ℃的温度,使低 熔点盐熔化导电,从而激活电池,这类电池称为热电池。Li/FeS2 热电池工作时,Li 转变为 硫化锂,FeS2 转变为铁,该电池工作时,电池总反应为_________________________________。 (2)铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。 ①某原电池装置如图所示,右侧烧杯中的电极反应式为________________________。 ②已知图中甲、乙两池的总反应式均为 Fe+H2SO4===FeSO4+H2↑,且在同侧电极(指 均在“左电极”或“右电极”)产生 H2。请在两池上标出电极材料(填“Fe”或“C”)。 (3)用铅蓄电池电解苦卤水(含 Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b 为石墨电 极)。下列说法中正确的是________(填字母)。 A.铅蓄电池负极的反应式为 Pb-2e-===Pb2+ B.铅蓄电池放电时,B 极质量减轻,A 极质量增加 C.铅蓄电池充电时,A 极应与外电源负极相连 D.电解苦卤水时,a 电极首先放电的是 Br- 解析:(1)依据题意可知,反应物为 FeS2、Li,生成物为 Fe、Li2S,反应的化学方程式 为 FeS2+4Li===Fe+2Li2S。(2)①原电池中 Fe 作负极,石墨棒作正极,右侧烧杯中电极反 应为 2H++2e-===H2↑。②装置乙是电解装置,阴极(右侧)产生 H2,同时根据电池的总反 应式可知 Fe 只能作阳极(左侧)。由已知条件知在装置甲中,Fe 作原电池的负极,在左侧,C 作原电池的正极,在右侧。(3)负极 Pb 失电子生成 PbSO4,B 极质量增大,A、B 选项错误; A 极为正极,充电时应与电源正极相连,C 选项错误;a 电极与电源正极相连为电解池阳极, 阴离子失电子,因还原性 Br->Cl-,则 Br-首先放电,D 选项正确。 答案:(1)FeS2+4Li===Fe+2Li2S (2)①2H++2e-===H2↑ ②甲中:左—Fe,右—C 乙中:左—Fe,右—C (3)D 12.(2017·深圳模拟)如图所示,是原电池的装置图。请回答: (1)若 C 为稀 H2SO4 溶液,电流表指针发生偏转,B 电极材料为 Fe 且 作负极,则 A 电极上发生的电极反应式为____________________;反应进 行一段时间后溶液 C 的 pH 将______(填“升高”“降低”或“基本不变”)。 (2)若需将反应:Cu+2Fe3+===Cu2++2Fe2+设计成如上图所示的原电池装置,则 A(负 极)极材料为__________,B(正极)极材料为________,溶液 C 为________。 (3)若 C 为 CuCl2 溶液,Zn 是____________极,Cu 极发生________反应,电极反应为 ________________________________________________________________________。 反应过程溶液中 c(Cu2+)__________(填“变大”“变小”或“不变”)。 (4)CO 与 H2 反应还可制备 CH3OH,CH3OH 可作为燃料使用,用 CH3OH 和 O2 组合 形成的质子交换膜燃料电池的结构示意图如下: 电池总反应为 2CH3OH+3O2===2CO2+4H2O,则 c 电极是________(填“正极”或“负 极”),c 电极的反应方程式为__________________________________________。 若线路中转移 2 mol 电子,则上述 CH3OH 燃料电池消耗的 O2 在标准状况下的体积为 ________ L。 解析:(1)铁作负极,则该原电池反应是铁与稀硫酸置换氢气的反应,正极反应是 H+得 电子生成 H2,电极反应式为 2H++2e-===H2↑;溶液中 H+放电,导致溶液中 c(H+)减小, pH 升高。 (2)把反应 Cu+2Fe3+===Cu2++2Fe2+设计成如题图所示的原电池装置,根据方程式中 物质发生的反应类型判断,Cu 发生氧化反应,作原电池的负极,所以 A 材料是 Cu,B 极 材料是比 Cu 不活泼的导电物质如石墨、Ag 等即可。溶液 C 中含有 Fe3+,如 FeCl3 溶液。 (3)Zn 比较活泼,在原电池中作负极,Cu 作正极,正极发生还原反应,Cu2+在正极得 到电子变成 Cu,电极反应为 Cu2++2e-===Cu,Cu2+发生了反应,则 c(Cu2+)变小。 (4)根据图中的电子流向知 c 是负极,是甲醇发生氧化反应:CH3OH-6e-+H2O===CO2 +6H+,线路中转移 2 mol 电子时消耗氧气 0.5 mol,标准状况下体积为 11.2 L。 答案:(1)2H++2e-===H2↑ 升高 (2)Cu 石墨 FeCl3 溶液 (3)负 还原 Cu2++2e-===Cu 变小 (4)负极 CH3OH-6e-+H2O===CO2+6H+ 11.2 [已学知识回顾练] 13.按要求回答下列问题: (1)已知在常温常压下: ①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1 ②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1 写出表示甲醇燃烧热的热化学方程式_______________________________________。 (2)已知:CH3OH(g)+1 2O2(g)===CO2(g)+2H2(g)ΔH1=-192.9 kJ·mol-1 H2(g)+1 2O2(g)===H2O(g) ΔH2=-120.9 kJ·mol-1 则甲醇与水蒸气催化重整反应的焓变 ΔH3=____________________________。 (3)苯乙烯是重要的基础有机原料。工业中用乙苯(C6H5—CH2CH3)为原料,采用催化脱 氢的方法制取苯乙烯(C6H5—CH===CH2)的反应方程式为 C6H5—CH2CH3(g)―→C6H5—CH===CH2(g)+H2(g) ΔH1 已知:3C2H2(g)―→C6H6(g) ΔH2 C6H6(g)+C2H4(g)―→C6H5—CH2CH3(g) ΔH3 则反应 3C2H2(g)+C2H4(g)―→C6H5—CH===CH2(g)+H2(g)的 ΔH=______________。 (4)氨的合成是最重要的化工生产之一。 工业上合成氨用的 H2 有多种制取的方法: ①用焦炭跟水反应: C(s)+H2O(g) =====高温 CO(g)+H2(g); ②用天然气跟水蒸气反应: CH4(g)+H2O(g) =====高温 催化剂 CO(g)+3H2(g) 已知有关反应的能量变化如图所示,则方法②中反应的 ΔH=________________。 (5)甲醇是一种用途广泛的化工原料。 工业上常用下列两种反应制备甲醇: ①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.1 kJ·mol-1 ②CO2(g)+3H2(g)===CH3OH(g)+H2O(l) ΔH2 已知:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1 H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1 则 ΔH2=________________。 答案:(1)CH3OH(l)+3 2O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1 (2)-72.0 kJ·mol-1 (3)ΔH1+ΔH2+ΔH3 (4)(a+3b-c)kJ·mol-1 (5)-93.0 kJ·mol-1查看更多