- 2021-05-25 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习镁、铝及其重要化合物学案
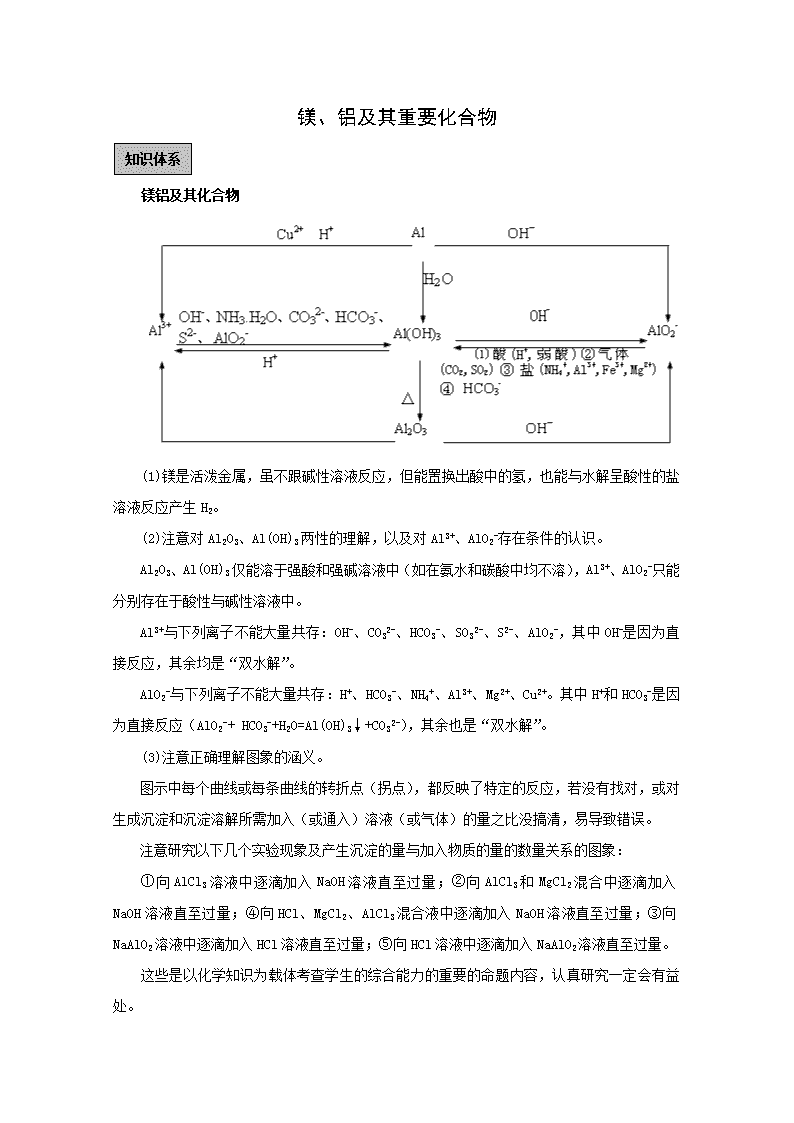
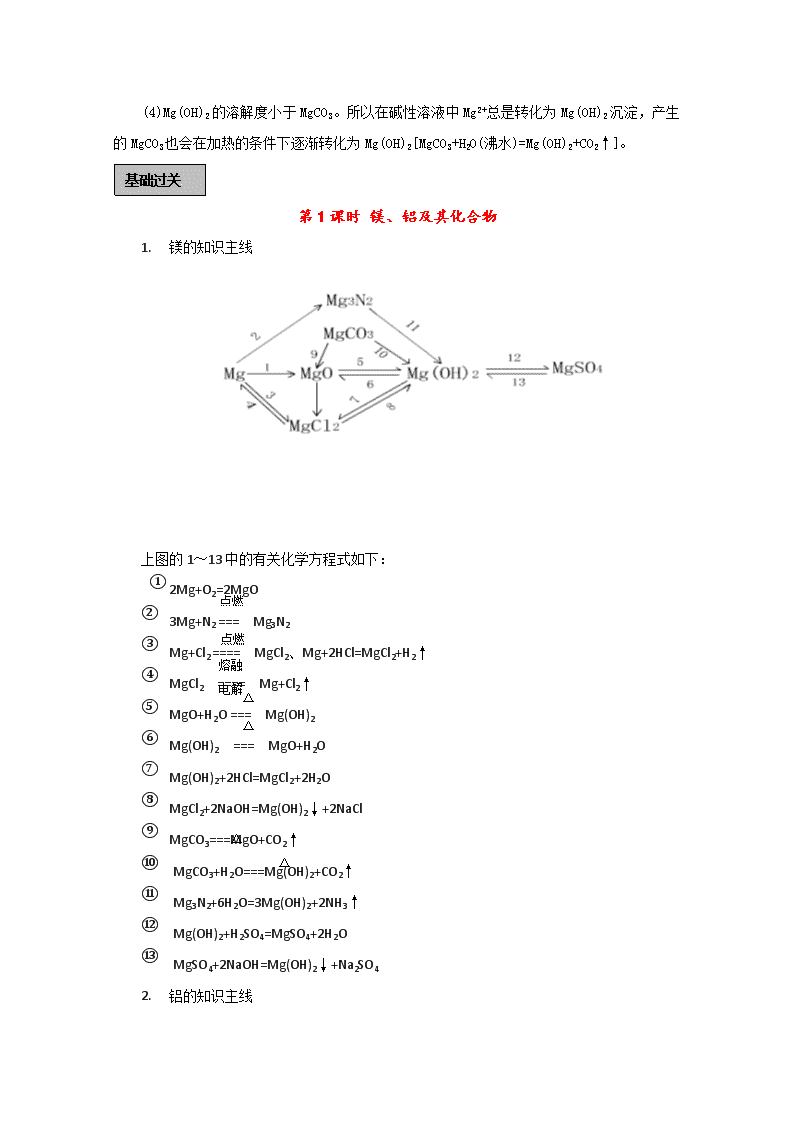
镁、铝及其重要化合物 知识体系 镁铝及其化合物 (1)镁是活泼金属,虽不跟碱性溶液反应,但能置换出酸中的氢,也能与水解呈酸性的盐溶液反应产生H2。 (2)注意对Al2O3、Al(OH)3两性的理解,以及对Al3+、AlO2-存在条件的认识。 Al2O3、Al(OH)3仅能溶于强酸和强碱溶液中(如在氨水和碳酸中均不溶),Al3+、AlO2-只能分别存在于酸性与碱性溶液中。 Al3+与下列离子不能大量共存:OH-、CO32-、HCO3-、SO32-、S2-、AlO2-,其中OH-是因为直接反应,其余均是“双水解”。 AlO2-与下列离子不能大量共存:H+、HCO3-、NH4+、Al3+、Mg2+、Cu2+。其中H+和HCO3-是因为直接反应(AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32-),其余也是“双水解”。 (3)注意正确理解图象的涵义。 图示中每个曲线或每条曲线的转折点(拐点),都反映了特定的反应,若没有找对,或对生成沉淀和沉淀溶解所需加入(或通入)溶液(或气体)的量之比没搞清,易导致错误。 注意研究以下几个实验现象及产生沉淀的量与加入物质的量的数量关系的图象: ①向AlCl3溶液中逐滴加入NaOH溶液直至过量;②向AlCl3和MgCl2混合中逐滴加入NaOH溶液直至过量;④向HCl、MgCl2、AlCl3混合液中逐滴加入NaOH溶液直至过量;③向NaAlO2溶液中逐滴加入HCl溶液直至过量;⑤向HCl溶液中逐滴加入NaAlO2溶液直至过量。 这些是以化学知识为载体考查学生的综合能力的重要的命题内容,认真研究一定会有益处。 (4)Mg(OH)2的溶解度小于MgCO3。所以在碱性溶液中Mg2+总是转化为Mg(OH)2沉淀,产生的MgCO3也会在加热的条件下逐渐转化为Mg(OH)2[MgCO3+H2O(沸水)=Mg(OH)2+CO2↑]。 基础过关 第1课时 镁、铝及其化合物 1. 镁的知识主线 上图的1~13中的有关化学方程式如下: 点燃 ① 2Mg+O2=2MgO ② 3Mg+N2 === Mg3N2 点燃 熔融 ③ Mg+Cl2 ==== MgCl2、Mg+2HCl=MgCl2+H2↑ △ 电解 ④ MgCl2 ==== Mg+Cl2↑ △ ⑤ MgO+H2O === Mg(OH)2 ⑥ Mg(OH)2 === MgO+H2O ⑦ Mg(OH)2+2HCl=MgCl2+2H2O ⑧ MgCl2+2NaOH=Mg(OH)2↓+2NaCl △ △ ⑨ MgCO3===MgO+CO2↑ ⑩ MgCO3+H2O===Mg(OH)2+CO2↑ ⑪ Mg3N2+6H2O=3Mg(OH)2+2NH3↑ ⑫ Mg(OH)2+H2SO4=MgSO4+2H2O ⑬ MgSO4+2NaOH=Mg(OH)2↓+Na2SO4 2. 铝的知识主线 上图1~12的有关化学方程式如下: 熔融 ① 4Al + 3O2 =2Al2O3 电解 ② 2Al2O3 ==== 4Al +3O2↑ ③ 2Al + 6HCl = 2AlCl3 +3H2↑ 加热 ④ 2Al + 2NaOH + 6H2O= 2Na[Al(OH)4] +3H2↑ ⑤ 2Al(OH)3 ====Al2O3 + 3H2O ⑥ Al2O3 +6HCl =2AlCl3 + 3H2O ⑦ AlCl3 +3NH3·H2O + Al(OH)3↓ +3NH4Cl ⑧ Al(OH)3 +3HCl = AlCl3 + 3H2O ⑨ Na[Al(OH)] + CO2 = Al(OH)3↓ + NaHCO3 ⑩ Al(OH)3 +NaOH = NA[Al(OH)4] ⑪ 2KAl(SO4)2 + 6NH3·H2O = 2Al(OH)3↓ + K2SO4 +3(NH4)2SO4 典型例题 【例1】甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是 A.甲中沉淀一定比乙中的多 B.甲中沉淀可能比乙中的多 C.甲中沉淀一定比乙中的少 D.甲中和乙中的沉淀可能一样多 答案:BD 解析:此题考查了元素化合物知识。根据氢氧化铝的性质,其能溶于氢氧化钠但不溶于氨水,故此加入时,两烧杯中生成的都是氢氧化铝沉淀;相同体积相同pH的两溶液中的溶质氨水大于氢氧化钠,当两者均不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠恰好时,生成的沉淀一样多;氨水和氢氧化钠都过量时,生成的沉淀氨水多;可知BD正确。 解法点拨:此题解答时,选用的是讨论法,其多用在计算条件不足,据此求解时需要在分析推理的基础上通过某些假设条件,加以讨论才能正确解答;故此在应用讨论法解题时,关键是先要分析条件与求解问题之间的联系,形成正确的解题方法。 【例2】下列叙述正确的是 A.铝制容器可盛装热的H2SO4 B.Agl胶体在电场中自由运动 C.K与水反应比Li与水反应剧烈 D.红磷在过量Cl2中燃烧生成PCl3 8. 答案C 【解析】本题考察物质的性质。A项,铝与热的浓硫酸反应,错误。B项,AgL胶体吸附电荷而带电,故在电场作用下做定向移动,错误。C项,K比Li活泼,故与水反应剧烈,正确。D项,P与过量的反应,应生成,错误。 【误区警示】铝在冷、热中发生钝化,但是加热则可以发生反应,胶体自身不带电,但是它可以吸附电荷而带电。由此警示我们,化学学习的平时学生一定要严谨,对细小知识点要经常记忆,并且要找出关键字、词。 【例3】对金属制品进行抗腐蚀处理,可延长其使用寿命。 (1)以下为铝材表面处理的一种方法: ①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的______.。 a.NH3 b.CO2 c.NaOH d.HNO3 ②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,阳极电极反应为____。取少量废电解液,加入NaHCO,溶液后产生气泡和白色沉淀,产生沉淀的原因是_____。 (2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______。 (3)利用右图装置,可以模拟铁的电化学防护。 若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。 若X为锌,开关K置于M处,该电化学防护法称为_______。 解析:(1) ①冒气泡的原因是Al与NaOH反应了,方程式为:2Al+2OH-+4H2O==2Al(OH)4-+3H2; 使Al(OH)4-生成沉淀,最好是通入CO2,加HNO3的话,沉淀容易溶解。 ②阳极是Al发生氧化反应,要生成氧化膜还必须有H2O参加,故电极反应式为:2Al+3H2O-6e -Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解。 (2)电镀时,阳极Cu可以发生氧化反应生成Cu2+。 (3)铁被保护,可以是做原电池的负极,或者电解池的阴极,故若X为碳棒,开关K应置于N处,Fe做阴极受到保护;若X为锌,开关K置于M处,铁是做负极,称为牺牲阳极保护法。 答案: (1)①2Al+2OH-+4H2O==2Al(OH)4-+3H2;c ②2Al+3H2O-6e -Al2O3+6H+;因为 Al3+和HCO3-发生了互促水解; Al3++3HCO3-== Al(OH)3↓+CO2↑ (2)阳极Cu可以发生氧化反应生成Cu2+ (3)N 牺牲阳极保护法。 基础过关 第2课时 镁、铝的图像 基本坐标图像 实验现象及反应原理 衍生坐标图像 化学反应原理 铝盐溶液与强碱反应 现象:先产生沉淀,后沉淀消失。 原理: Al3++3OH–Al(OH)3 ↓ 铝酸盐溶液与强酸反应 现象:沉淀不断增多,而后沉淀溶解。 原理:Al(OH)3+3H+=Al3++3H2O 铝盐溶液与弱碱反应 现象:产生沉淀。 原理:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 铝酸盐溶液与弱酸反应 现象:产生沉淀。 原理:[Al(OH)4]-+CO2=Al(OH)3↓+HCO3- 典型例题 【例1】已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( ) A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多 B.c—d时溶液中离子的物质的量:AlO2–比Ba2+多 C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3 D.d—e时溶液中离子的物质的量:Ba2+可能等于OH– [解析]采用定量法分析。假设有1molA12(SO4)3则溶液中含有2molA13+、3molSO42–。向溶液中逐滴加入Ba(OH)2溶液时发生的反应为:Al3++3OH-Al(OH)3↓、SO42–+Ba2+ BaSO4↓。则当2molA13+完全沉淀时,消耗Ba(OH)23mol,此时3molSO42–全部沉淀;生成沉淀为2molAl(OH)3和3molBaSO4共5mol,因此,在整个反应过程中BaSO4的物质的量始终大于Al(OH)3的物质的量;再加入Ba(OH)2溶液时发生Al(OH)3+OH-=[Al(OH)4] -,沉淀的量将逐渐减少,因此b点是沉淀的最大值,b~d中Al(OH)3沉淀逐渐溶解转化为Ba(AlO2)2,由于AlO2-微弱水解,因此再b~d中AlO2-的物质的量大于Ba2+;d点时Al(OH)3 沉淀恰好完全溶解,此时溶液中只存在Ba(AlO2)2,因此随Ba(OH)2的加入在某一点,当d~e中加入的Ba(OH)2的物质的量等于Ba(AlO2)2的物质的量时,溶液中Ba2+与OH-的量相等。 [答案]BD [规律总结]析图或作图时不仅要注意加入酸或碱的强弱,而且要注意所加入的量或滴加顺序,正因滴加顺序不同可产生的现象不同。若产生沉淀有多种,则应细细分析相关量间的关系。要持别关注沉淀是否同步完全,沉淀物是否溶于所加入的过量试剂中,同时要注意纵生标的物理量意义。对于一些复杂问题可先分解后组合,进行图像的叠加工作。抓住一些关键点(如最高点,最低点,转折点)和变化趋势,才能较顺利地解决图像问题。 【例2】向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量) 【解析】 (1)本题考查知识点为镁盐、铝盐的性质及氢氧化镁、氢氧化铝性质, 涉及到的离子反应为 Mg(OH)2 + NaOH 因此反应最终结果沉淀不为“O”所以敏捷判断A、B不为此题答案。 (2)从(1)可以分析得出, 此混合物与NaOH溶液反应过程中必有沉淀减少过程(氢氧化铝溶于NaOH溶液中)最终有Mg(OH)2¯。∴C不正确, D为此题正确答案。 【例3】将下列各组物质, 分别按等物质的量混合后加水溶解, 有沉淀生成的是 A.Na2CO3、NaAlO2、NaOH B.AlCl3、K2SO4、HCl C.CaCl2、Na2CO3、NaOH D.AlCl3、Ba(OH)2、HNO3 【解析】(1)本题解答关键知识点为离子反应的有关知识, 只需分析等摩有关物质溶于水后, 提供有关离子能否相互反应生成沉淀, 如有沉淀生成即为本题答案。 (2)A选项分析: 等摩Na2CO3、NaAlO2、NaOH三种物质混合溶液中含有Na+、 这些离子能共存不能发生反应, 当然不会有沉淀生成, ∴不为此题答案。 (3)AlCl3、K2SO4、HCl溶于水后提供了这些离子仍可以共存, 不会相互反应产生沉淀故不为答案。 (4)等摩CaCl2、Na2CO3、NaOH混合溶于水, 溶液中n(Ca2+)∶n(Cl-)∶n(Na+)∶n()∶n(OH-) = 1∶2∶3∶1∶1, 其中n(Ca2+)∶n() = 1∶1, ∵, ∴为此题答案。 (5)等摩AlCl3、Ba(OH)2、HNO3混合溶于水, 溶液中n(Al3+)∶n(Cl-)∶n(Ba2+)∶n(OH-)∶n(H+)∶n() = 1∶3∶1∶2∶1∶1, 其中n(Al3+)∶n(OH-)∶n(H+) = 1∶2∶1, ∵, ∴n(Al3+) ∶n(OH-) = 1∶1, , 可以明显看出OH-为适量 ∴有沉淀Al(OH)3产生为此题答案(不存在Al(OH)3溶于过量强碱问题)。答案为C、D。查看更多