- 2021-05-25 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021年高考化学模拟专练卷07(学生版)
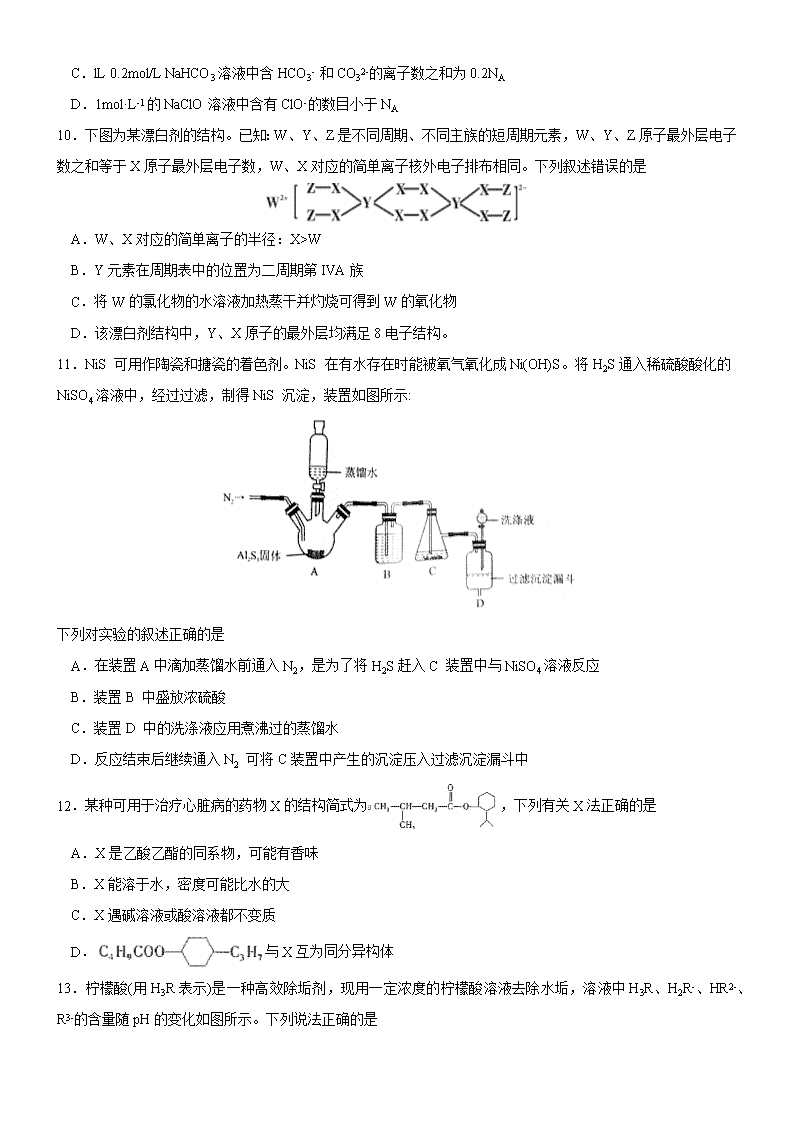
模拟专练卷 07 化学 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦 干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 Cl-35.5 Fe-56 Cu-64 Au-197 一、选择题:本题共 7 个小题,每小题 6 分。共 42 分,在每小题给出的四个选项中,只有一项是符合题目要求 的。 7.化学与人类生活、社会可持续发展密切相关,下列说法错误的是 A.新型冠状病毒主要由 C、H、O、N、S 等元素组成,常用质量分数为 75%的医用酒精杀灭新型冠状病毒 B.葡萄中含有的花青素在碱性环境下显蓝色,可用苏打粉检验假葡萄酒 C.植物油长期露置在空气中会因发生氧化反应而变质 D.防疫时期很多家庭都备有水银温度计,若不慎打破,应立即用硫磺粉末覆盖 8.已知反应 S2O82-(aq)+2I-(aq)⇌ 2SO42-(aq)+I2(aq),若往该溶液中加人含 Fe3+的某溶液,反应机理:① 2Fe3++(aq)+2I-(aq)⇌ I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O82-(aq) ⇌2Fe3+(aq)+2SO42-(aq),下列有关该反应的说法不正确 的是 A.增大 S2O82-浓度或 I-浓度,反应①、反应②的反应速率均加快 B.Fe3+是该反应的催化剂 C.因为正反应的活化能比逆反应的活化能小,所以该反应是放热反应 D.往该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深 9.设 NA 为阿伏加德罗常数的值,下列说法正确的是 A.S+2KNO3+3C= K2S+3CO2↑+N2↑每生成 0.5mol N2,反应中转移电子数为 6NA B.a g C2H4 和 C3H6 混合气体含有的原子数目为 a NA/14 C.lL 0.2mol/L NaHCO3 溶液中含 HCO3- 和 CO32-的离子数之和为 0.2NA D.1mol·L-1 的 NaClO 溶液中含有 ClO-的数目小于 NA 10.下图为某漂白剂的结构。已知:W、Y、Z 是不同周期、不同主族的短周期元素,W、Y、Z 原子最外层电子 数之和等于 X 原子最外层电子数,W、X 对应的简单离子核外电子排布相同。下列叙述错误的是 A.W、X 对应的简单离子的半径:X>W B.Y 元素在周期表中的位置为二周期第 IVA 族 C.将 W 的氯化物的水溶液加热蒸干并灼烧可得到 W 的氧化物 D.该漂白剂结构中,Y、X 原子的最外层均满足 8 电子结构。 11.NiS 可用作陶瓷和搪瓷的着色剂。NiS 在有水存在时能被氧气氧化成 Ni(OH)S。将 H2S 通入稀硫酸酸化的 NiSO4 溶液中,经过过滤,制得 NiS 沉淀,装置如图所示: 下列对实验的叙述正确的是 A.在装置 A 中滴加蒸馏水前通入 N2,是为了将 H2S 赶入 C 装置中与 NiSO4 溶液反应 B.装置 B 中盛放浓硫酸 C.装置 D 中的洗涤液应用煮沸过的蒸馏水 D.反应结束后继续通入 N2 可将 C 装置中产生的沉淀压入过滤沉淀漏斗中 12.某种可用于治疗心脏病的药物 X 的结构简式为 ,下列有关 X 法正确的是 A.X 是乙酸乙酯的同系物,可能有香味 B.X 能溶于水,密度可能比水的大 C.X 遇碱溶液或酸溶液都不变质 D. 与 X 互为同分异构体 13.柠檬酸(用 H3R 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中 H3R、H2R-、HR2-、 R3-的含量随 pH 的变化如图所示。下列说法正确的是 A.H3R 的第二步电离常数 Ka2(H3R)的数量级为 10-4 B.pH=6 时,c(R3-)=c(HR2-)>c(H+)>c(OH-) C.Na2HR 溶液中 HR2-的水解程度大于电离程度 D.pH=4 时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-) 二、非选择题:共 58 分,第 26~28 题为必考题,每个试题考生都必须作答。第 35~36 题为选考题,考生根据要 求作答。 (一)必考题:共 43 分。 26.(14 分)碱式氯化铜[Cux(OH)yClz·mH2O]是重要的农药、医药中间体,还可用作木材防腐剂、饲料添加剂 等.研究小组在实验室用某厂废铜渣(主要成分为 Cu、CuO,含少量 Fe3O4、Ni、Al2O3)制备碱式氯化铜 的流程如下,回答下列问题: (1)“研磨”的目的为________。 (2)“碱溶”的目的为____________。 (3)“酸溶”时生成 Fe3+反应的离子方程式为_______;生成的 Fe3+对 Cu 发生的氧化反应的催化原理如上 图所示。N 代表的物质为________(填化学式或离子符号)。 (4)“酸溶”时温度不能过高的理由为_________。 (5)若滤液 2 中 c(Fe3+)=4×10-8 mol/L,pH=4,则 Ksp[Fe(OH)3]=__________。 (6)为测定 Cux(OH)yClz·mH2O 的组成,进行如下操作:取样品 23.25 g,用适量酸溶解后配成 100mL 溶液;取 10.00 mL 溶液加入足量 AgNO3 溶液,生成 1.435 g 沉淀;另取 10.00 mL 溶液,用 1.000 mol/L 的 EDTA 标准液滴定 Cu2+(Cu2+与 EDTA 以物质的量之比 1∶1 反应),滴定至终点时消耗标准液体积为 20.00 mL。 ①溶解样品所用酸的化学式为________; ②最终确定该样品的化学式为______。 27.(14 分) 碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。 (1)合成该物质的步骤如下: 步骤 1:配制 0.5mol·L-1 MgSO4 溶液和 0.5mol·L-1 NH4HCO3 溶液。 步骤 2:用量筒量取 500mL NH4HCO3 溶液于 1000mL 三颈烧瓶中,开启搅拌器。温度控制在 50℃。 步骤 3:将 250mL MgSO4 溶液逐滴加入 NH4HCO3 溶液中,1min 内滴加完后,用氨水调节溶液 pH 到 9.5。 步骤 4:放置 1h 后,过滤,洗涤。 步骤 5:在 40℃的真空干燥箱中干燥 10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。 ①步骤 2 控制温度在 50℃,较好的加热方法是_________。 ②步骤 3 生成 MgCO3·nH2O 沉淀的化学方程式为__________。 ③步骤 4 检验沉淀是否洗涤干净的方法是__________。 (2)测定生成的 MgCO3·nH2O 中的 n 值。 称量 1.000 碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的 CO2 被 NaOH 溶液吸收,在室温下反应 4~5h,反应后期将温度升到 30℃,最后将烧杯中的溶液用已知浓度的盐酸 滴定,测得 CO2 的总量;重复上述操作 2 次。 ①图中气球的作用是_________。 ②上述反应后期要升温到 30℃,主要目的是______。 ③测得每 7.8000g 碳酸镁晶须产生标准状况下 CO2 为 1.12L,则 n 值为_______。 (3)碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中 铁的含量,在实验室分别称取 12.5g 菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用 0.010mol/L H2O2 溶液进行滴定。平行测定四组。消耗 H2O2 溶液的体积数据如表所示。 实验编号 1 2 3 4 消耗 H2O2 溶液体积/mL 15.00 15.02 15.62 14.98 ①H2O2 溶液应装在_________(填“酸式”或“碱式”)滴定管中。 ②根据表中数据,可计算出菱镁矿中铁元素的质量分数为_________ %(保留小数点后两位)。 28.(15 分) CH4 超干重整 CO2 技术可得到富含 CO 的化工原料。回答下列问题: (1)CH4 超干重整 CO2 的催化转化如图所示: ①已知相关反应的能量变化如图所示: 过程Ⅰ的热化学方程式为________。 ②关于上述过程Ⅱ的说法不正确的是________(填序号)。 a.实现了含碳物质与含氢物质的分离 b.可表示为 CO2+H2=H2O(g)+CO c.CO 未参与反应 d.Fe3O4、CaO 为催化剂,降低了反应的ΔH ③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应 CH4(g)+CO2(g)=2CO(g)+2H2(g) 进行相同时间后,CH4 的转化率随反应温度的变化如图所示。a 点所代表的状态________(填“是”或“不是”) 平衡状态;b 点 CH4 的转化率高于 c 点,原因是________。 (2)在一刚性密闭容器中,CH4 和 CO2 的分压分别为 20kPa、25kPa,加入 Ni/α-Al2O3 催化剂并加热至 1123K 使其发生反应 CH4(g)+CO2(g)=2CO(g)+2H2(g)。 ①研究表明 CO 的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得 p(CO)=20kPa, 则 p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。 ②达到平衡后测得体系压强是起始时的 1.8 倍,则该反应的平衡常数的计算式为 Kp=________(kPa)2。 (用各物质的分压代替物质的量浓度计算) (3)CH4 超干重整 CO2 得到的 CO 经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加 入一定浓度的 NaOH 溶液,所得溶液中 2- 2 2 4 2 4c H C O =c C O ,则此时溶液的 pH=________。(已知常 温下 H2C2O4 的 Ka1=6×10-2,Ka2=6×10-5,lg6=0.8) (二)选考题:共 15 分。请考生从 2 道化学题中任选一题作答。如果多做,则按所做的第一题计分。 35.[化选修 3:物质结构与性质](15 分) Ⅰ.过渡金属元素性质研究在无机化学中所占的比重越来越大。 (1)铜元素在周期表的位置是______。 (2)比较 NH3 和[Cu(NH3)2]2+中 H-N-H 键角的大小:NH3______[Cu(NH3)2]2+(填“>”或“<”),并说明理由 ______。 (3)铜金合金是一种储氢材料,晶胞参数 anm,面心立方堆积,铜原子在晶胞的面心位置,金原子在晶胞 的顶点位置。已知阿伏加德罗常数的数值为 NA,铜、金的摩尔质量分别为 M(Cu)、M(Au),该晶体的密度 为______g/cm3;氢原子可以进入到铜原子和金原子构成的四面体的空隙中,该材料储满氢后的化学式为 ______。 (4)研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图 1,在图中画出 由钒离子形成的配合物中的配位键______。 Ⅱ.氮元素可以形成多种化合物。 (5)NO3-的立体构型的名称是______,NO3-的一种等电子体为______。 (6)硫酸和硝酸都是常见的强酸,但性质差异明显:硫酸是粘稠的油状液体,沸点 338℃;硝酸是无色液 体,沸点仅为 122℃,试从氢键的角度解释原因:______。 (7)图 2 表示某种含氮有机化合物的结构,其分子内 4 个氮原子分别位于正四面体的四个顶点(见图 3), 分子内存在空腔,能嵌入某离子或分子并形成 4 个氢键予以识别。下列分子或离子中,能被该有机化合物识 别的是______(填标号)。 a.CF4 b.CH4 c.NH4+ d.H2O 36.[化选修 5:有机化学基础](15 分) 1,3—环己二酮( )常用作医药中间体,用于有机合成。下列是一种合成 1,3—环己二酮的路线。 回答下列问题: (1)甲的分子式为 __________。 (2)丙中含有官能团的名称是__________。 (3)反应①的反应类型是________;反应②的反应类型是_______。 (4)反应④的化学方程式_______。 (5)符合下列条件的乙的同分异构体共有______种。 ①能发生银镜反应 ②能与 NaHCO3 溶液反应,且 1mol 乙与足量 NaHCO3 溶液反应时产生气体 22.4L(标准状况)。 写出其中在核磁共振氢谱中峰面积之比为 1∶6∶2∶1 的一种同分异构体的结构简式:________。(任意一种) (6)设计以 (丙酮)、乙醇、乙酸为原料制备 (2,4—戊二醇)的合成路线(无机试剂 任选)_______。查看更多