- 2021-05-25 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021学年高二化学新教材人教版必修第二册教师用书:7
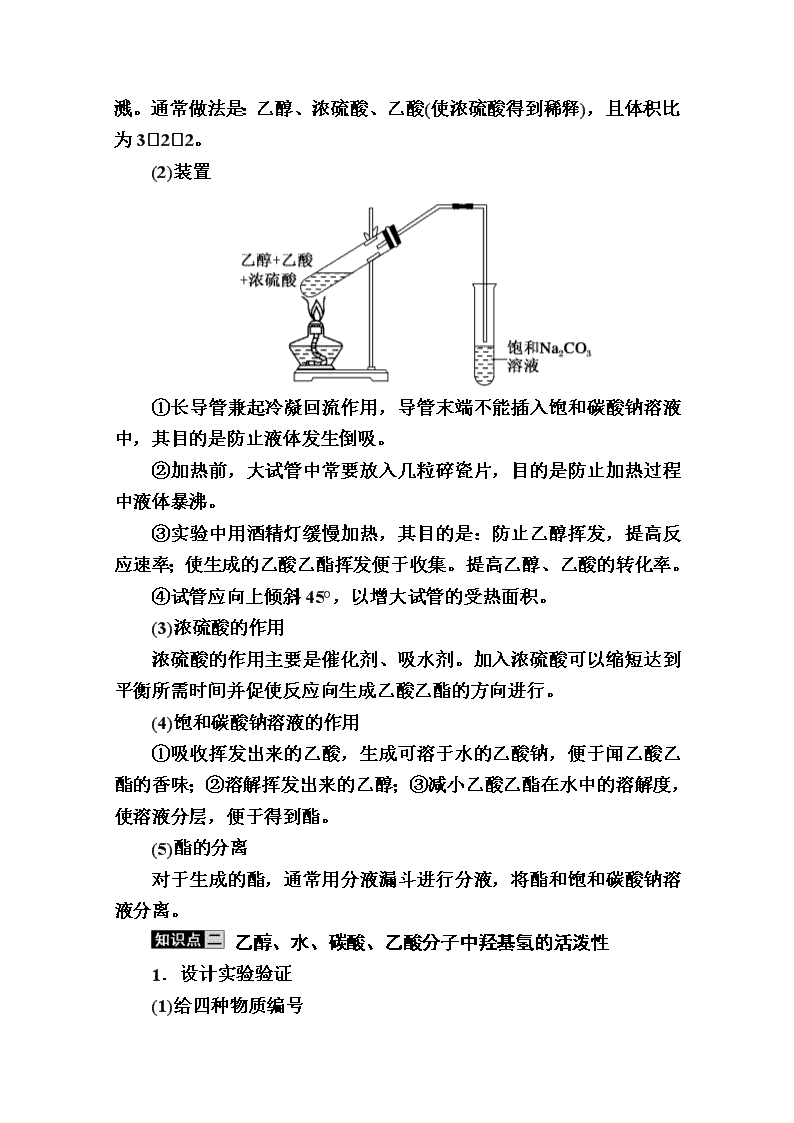
www.ks5u.com 第2课时 乙酸 课前自主预习 一、乙酸 1.物理性质 乙酸俗称醋酸,是有强烈刺激性气味的无色液体,沸点是117.9 ℃,熔点是16.6 ℃,温度低于16.6 ℃时,凝结成像冰一样的晶体,又称为冰醋酸。乙酸易溶于水和乙醇等。 2.分子结构 乙酸的分子式为C2H4O2,结构式为,结构简式为CH3COOH,羧基为官能团,乙酸是由甲基和羧基组成的,乙酸的化学性质主要由官能团—COOH决定。 3.化学性质 (1)乙酸的酸性 乙酸是一种有机弱酸,但酸性比碳酸强,具有酸的通性。 ①可使紫色石蕊溶液变红CH3COOHCH3COO-+H+。 ②能与活泼金属反应,如能与Mg反应:2CH3COOH+Mg―→(CH3COO)2Mg+H2↑。 ③能与CaCO3反应:2CH3COOH+CaCO3―→(CH3COO)2Ca+CO2↑+H2O。 ④能与Mg(OH)2反应:2CH3COOH+Mg(OH)2―→ (CH3COO)2Mg+2H2O。 (2)与乙醇的酯化反应 在浓硫酸存在并加热的条件下,乙酸和乙醇发生反应生成乙酸乙酯和水,反应的方程式为CH3COOH+C2H5OH CH3COOCH2CH3+H2O。 ①酯化反应:酸和醇起作用,生成酯和水的反应。 ②酯化反应是可逆的,浓硫酸的作用是催化剂(提高化学反应速率)和吸水剂(提高乙醇、乙酸的转化率)。 二、酯 1.概念 酯是羧酸中的—COOH中的—OH被—OR′取代后的产物,可简写成RCOOR′,官能团为或—COOR。 2.性质 (1)物理性质 酯在水中的溶解性:一般难溶于水;密度(与水相比):比水小,低级酯具有果香气味。 (2)化学性质:能发生水解反应。 课堂互动探究 乙酸和乙醇的酯化反应 1.实验原理 CH3COOH+HO—CH2CH3CH3COOCH2CH3+H2O 2.实验中的注意事项 (1)加入试剂的顺序 化学药品加入大试管时,一定注意不能先加浓硫酸,以防液体飞溅。通常做法是:乙醇、浓硫酸、乙酸(使浓硫酸得到稀释),且体积比为322。 (2)装置 ①长导管兼起冷凝回流作用,导管末端不能插入饱和碳酸钠溶液中,其目的是防止液体发生倒吸。 ②加热前,大试管中常要放入几粒碎瓷片,目的是防止加热过程中液体暴沸。 ③实验中用酒精灯缓慢加热,其目的是:防止乙醇挥发,提高反应速率;使生成的乙酸乙酯挥发便于收集。提高乙醇、乙酸的转化率。 ④试管应向上倾斜45°,以增大试管的受热面积。 (3)浓硫酸的作用 浓硫酸的作用主要是催化剂、吸水剂。加入浓硫酸可以缩短达到平衡所需时间并促使反应向生成乙酸乙酯的方向进行。 (4)饱和碳酸钠溶液的作用 ①吸收挥发出来的乙酸,生成可溶于水的乙酸钠,便于闻乙酸乙酯的香味;②溶解挥发出来的乙醇;③减小乙酸乙酯在水中的溶解度,使溶液分层,便于得到酯。 (5)酯的分离 对于生成的酯,通常用分液漏斗进行分液,将酯和饱和碳酸钠溶液分离。 乙醇、水、碳酸、乙酸分子中羟基氢的活泼性 1.设计实验验证 (1)给四种物质编号 (2)设计实验 2.实验结论总结 典例题组训练 题组一 酯化反应 1.实验室制取乙酸乙酯的主要步骤如下: ①在甲试管(如图)中加入3 mL乙醇、2 mL浓硫酸和2 mL乙酸的混合溶液。 ②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5 min。 ③待试管乙收集到一定量产物后停止加热,撤出试管乙,并用力振荡,然后静置待分层。 ④分离出乙酸乙酯层,洗涤、干燥。 (1)配制该混合溶液的主要操作步骤为 将浓硫酸加入乙醇中,边加边振荡,然后再加入乙酸;反应中浓硫酸的作用是作催化剂和吸水剂。 (2)上述实验中饱和碳酸钠溶液的作用是BC(填字母)。 A.中和乙酸和乙醇 B.中和乙酸并吸收部分乙醇 C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的小,有利于分层析出 D.加速酯的生成,提高其产率 (3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出(填“下口放出”或“上口倒出”)。 解析:(1)浓硫酸稀释或与其他溶液混合时会放出大量的热,操作不当会造成液体迸溅,故应将浓硫酸加入乙醇中,边加边振荡,然后再加入乙酸,或先将乙醇与乙酸混合好后再加浓硫酸,并在加入过程中不断振荡。(2)饱和碳酸钠溶液的作用:①中和乙酸并吸收部分乙醇;②降低乙酸乙酯的溶解度有利于分层析出。(3)分离不相混溶的液体应采用分液法,上层液体从分液漏斗的上口倒出,下层液体从分液漏斗的下口放出。 2.具有一个羟基的化合物A 10 g,与乙酸反应生成乙酸某酯11.85 g,并回收了未反应的A 1.3 g,则A的相对分子质量为( B ) A.98 B.116 C.158 D.278 解析:设醇为ROH,其相对分子质量为x,实际参加反应的A的质量为:10 g-1.3 g=8.7 g。 =,解得x=116,故选B。 酯化反应 (1)特点:可逆反应。 (2)类型:取代反应。 (3)实质:羧酸去羟基醇去氢。 可用原子示踪法证明:用含18O的乙醇参与反应,生成的乙酸乙酯(CH3CO18OC2H5)分子中含18O原子,表明反应物羧酸分子中的羟基与乙醇分子中羟基上的氢原子结合成水,其余部分结合生成酯(即水中的氧原子来自于羧酸)。 题组二 乙酸的酸性 3.同温同压下,某有机物和过量的金属钠反应得到V1 L氢气,取另一份等量的该有机物和足量的NaHCO3溶液反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是( A ) 解析:1 mol羟基与足量的金属钠反应产生0.5 mol H2,1 mol羧基与足量的金属钠反应产生0.5 mol H2;NaHCO3只能与有机物中的羧基反应而不与羟基反应,且1 mol羧基与足量的NaHCO3溶液反应产生1 mol CO2;若满足题干条件,该有机物中应既有羟基又有羧基,且个数相等,故选A。 4.莽草酸()是从烹调香料“八角”中提取出的一种有机物,是合成抗禽流感药物的基本原料。1 mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为( A ) A.41 B.11 C.31 D.14 解析:醇羟基、羧基都能与Na反应,而只有羧基与NaOH反应,有关反应的化学方程式如下: 官能团反应时量的规律 (1)能与金属钠反应的有机物含有—OH或—COOH,反应关系为2Na~2—OH~H2↑或2Na~2—COOH~H2↑。 (2)能与NaHCO3和Na2CO3反应生成CO2的有机物一定含有—COOH,反应关系为NaHCO3~—COOH~CO2↑或Na2CO3~2—COOH~CO2↑。 核心素养 制备乙酸乙酯的注意事项 (1)为防止试管中液体在受热时暴沸,盛反应液的试管要倾斜约45°,加热前在试管中加入几块碎瓷片或沸石。 (2)玻璃导管的末端不要插入饱和Na2CO3溶液中,以防液体倒吸。 (3)开始时要用小火均匀加热,加快反应速率,减少乙醇和乙酸的挥发;待有大量产物生成时,可大火加热,以便将产物蒸出。 (4)装置中的长导管起导气兼冷凝作用。 (5)饱和Na2CO3溶液的作用: 挥发出的乙酸与Na2CO3溶液反应生成易溶于水的盐,乙醇易溶于Na2CO3溶液,有利于乙酸乙酯与乙酸、乙醇的分离。另外乙酸乙酯在饱和Na2CO3溶液中的溶解度较小,与饱和Na2CO3溶液混合时易分层,可用分液法分离。 (6)不能用NaOH溶液代替饱和Na2CO3溶液,因为NaOH溶液碱性很强,会使乙酸乙酯水解。 (7)欲提高乙酸的转化率,可采取以下措施: ①用浓H2SO4吸水,使平衡向正反应方向移动; ②加热将酯蒸出; ③可适当增加乙醇的量,并加装冷凝回流装置。 【例】 已知下列数据: 实验室制乙酸乙酯的主要装置如图甲所示,主要步骤如下: ①在30 mL的大试管中按体积比144的比例配制浓硫酸、乙 ++醇和乙酸的混合液; ②按照图甲连接装置,使产生的蒸气经导管通入到15 mL试管所盛饱和Na2CO3溶液(加入1滴酚酞溶液)上方约0.5 cm处; ③小火加热试管中的混合液; ④待小试管中收集约4 mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层; ⑤分离出纯净的乙酸乙酯。 请回答下列问题: (1)步骤①中,配制这一比例的混合液的操作是 ____________________________________________。 (2)步骤③中,用小火加热试管中的混合液,其原因是 ___________________________________________________。 (3)步骤④所观察到的现象是_______________________。 (4)步骤⑤中,分离出乙酸乙酯选用的仪器是__________,产物应从________口倒出,因为______________________________。 (5)为提高乙酸乙酯的产率,A、B两位同学分别设计了如图乙、丙的装置(B同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置合理,为什么?________________________________________________。 【解析】 (1)要注意题目对三种液体的比例的限制,30 mL的试管最多加入10 mL液体加热,故乙醇和乙酸均加入4 mL,浓硫酸加1 mL,要将浓硫酸加入乙醇中,边加边振荡,冷却后再加乙酸并振荡,并不断振荡混合均匀。(2)乙酸、乙醇、乙酸乙酯的沸点较低且接近,大火加热,会使反应物大量挥发而损失。(3)Na2CO3溶液显碱性,加入1滴酚酞溶液变红色,乙酸乙酯密度比水小,难溶于水,在上层,振荡时挥发出来的乙酸与碳酸钠反应产生气泡,溶液的红色变浅,油层变薄。(5)丙中的反应物能够冷凝回流,损失少,乙酸乙酯的产率高。 【答案】 (1)先加4 mL乙醇,再缓缓加入1 mL浓硫酸,边加边振荡,冷却后再加4 mL乙酸并振荡混合均匀 (2)防止暴沸且减少反应物的挥发 (3)在浅红色Na2CO3溶液上层有无色液体,振荡后Na2CO3溶液层红色变浅且有气泡产生,油层变薄 (4)分液漏斗 上 乙酸乙酯的密度比水的密度小 (5)丙装置合理,丙中的反应物能够冷凝回流,损失少,乙酸乙酯的产率高查看更多