- 2021-05-25 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019年中考化学试卷
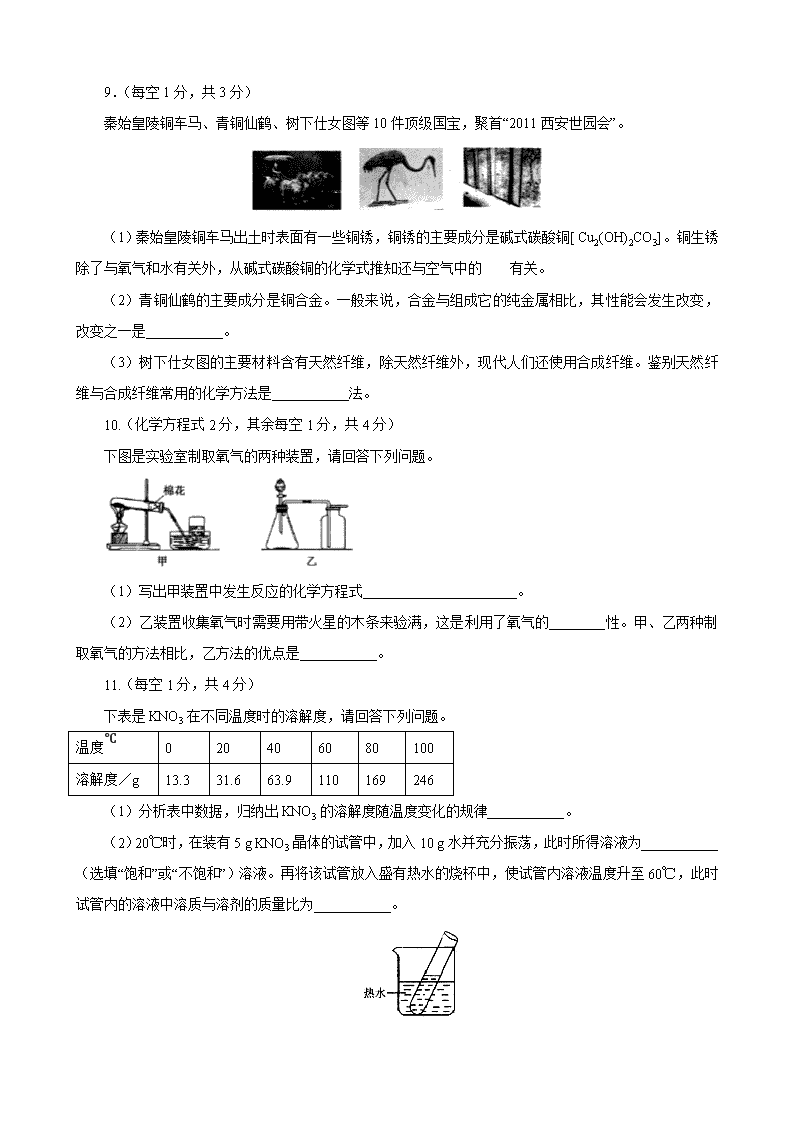
201 9年陕西省初中毕业学业考试 化学部分 可能用到的相对原子质量:H-1 C-12 O-16 C1-35.5 Ca-40 第1卷(选择题 共14分) 一、选择题(共7小题,每小题2分,计14分。每小题只有一个选项是符合题意的) 1.某同学做氧化铜与稀硫酸反应的实验,操作示意图如下,其中操作有错误的是 ( ) 2.下列物质的用途利用了其物理性质的是 ( ) A.生活中用镶有金刚石的玻璃刀裁划玻璃 B.农业上常用熟石灰改良酸性土壤 C.工业上常用一氧化碳作还原剂冶炼金属 D.化工生产中以煤为原料制取甲醇(CH3OH) 3.四位同学在一起讨论某种物质,请根据他们的讨论判断该物质是 ( ) 4.随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所认知。下图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图。下列说法错误的是 ( ) A.碘的相对原子质量为126.9,原子核内质子数为53 B.碘原子核外共有53个电子,最外层有7个电子 C.碘元素属于非金属元素,碘原子在化学反应中容易得到电子 D.碘盎中含有碘酸钾(KIO3),KIO3中碘元素的化合价为-1 5.某反应的微观示意图如下,下列说法正确的是 ( ) A.图中甲、乙、丙三种物质均是由分子构成的 B.图中甲、乙、丙三种物质中,甲、丙属于氧化物 C.该反应前后分子种类、原子种类均没有改变 D.图中甲、乙、丙三种物质既有单质又有化合物 6.节能减排、低碳出行是我们倡导的生活方式,“低碳”指的是尽量减少二氧化碳的排放。下列有关二氧化碳的说法正确的是 ( ) A.二氧化碳通入紫色石蕊溶液,溶液变为红色,说明二氧化碳具有酸性 B.二氧化碳的过度排放会加剧温室效应,因此应禁止使用化石燃料 C.二氧化碳和一氧化碳的组成元素相同,在一定条件下可以相互转化 D.进入久未开启的菜窖之前,必须做灯火试验,是因为二氧化碳有毒 7.下列有关物质的检验、除杂、分离、区分所用的试剂或方法错误的是 ( ) 选项 实验目的 所用试剂或方法 A 检验NH4NO3,溶液和K2 SO4溶液 NaOH溶液或Ba(NO3)2溶液 B 除去生石灰中含有的杂质石灰石 水或稀盐酸 C 从H2O2溶液制氧气的残余物中分离出MnO2 过滤或蒸发 D 区分失去标签的浓硫酸和稀硫酸 水或小木条 第Ⅱ卷(非选择题 共36分) 二、填空及简答题(共5小题,计19分) 8.(每空1分,共3分)Ⅰ、Ⅱ两小题只选做一题,如果两题全做,只按Ⅰ题计分。 Ⅰ.清新的空气、洁净的饮用水、均衡的营养都与人体健康息息相关。 (1)清新的空气属于_____________(选填“纯净物”或“混合物”)。 (2)洁净的饮用水经过了净化,在净化水过程中常用_________吸附色素和异味。 (3)均衡的营养需要合理膳食。食品中的有机营养素有糖类、脂肪、蛋白质、维生素,食用水果蔬菜为人体补充的主要有机营养素是_____________。 Ⅱ.食品的安全、粮食的生产是全国人民关注的大事。 (1)不法商贩用硫燃烧产生的二氧化硫熏蒸馒头、生姜等,该过程发生了________(选填“物理变化”或“化学变化”)。 (2)农作物生长对土壤酸碱度有一定的要求,常用_____________测定土壤的酸碱度。 (3)合理施用化肥可增加粮食产量,常用的化肥有K2SO4、CO(NH2)2、Ca(H2PO4)2等,其中属于氮肥的是___________。 9.(每空1分,共3分) 秦始皇陵铜车马、青铜仙鹤、树下仕女图等10件顶级国宝,聚首“2011西安世园会”。 (1)秦始皇陵铜车马出土时表面有一些铜锈,铜锈的主要成分是碱式碳酸铜[ Cu2(OH)2CO3]。铜生锈除了与氧气和水有关外,从碱式碳酸铜的化学式推知还与空气中的 有关。 (2)青铜仙鹤的主要成分是铜合金。一般来说,合金与组成它的纯金属相比,其性能会发生改变,改变之一是___________。 (3)树下仕女图的主要材料含有天然纤维,除天然纤维外,现代人们还使用合成纤维。鉴别天然纤维与合成纤维常用的化学方法是___________法。 10.(化学方程式2分,其余每空1分,共4分) 下图是实验室制取氧气的两种装置,请回答下列问题。 (1)写出甲装置中发生反应的化学方程式______________________。 (2)乙装置收集氧气时需要用带火星的木条来验满,这是利用了氧气的________性。甲、乙两种制取氧气的方法相比,乙方法的优点是___________。 11.(每空1分,共4分) 下表是KNO3在不同温度时的溶解度,请回答下列问题。 温度℃ 0 20 40 60 80 100 溶解度/g 13.3 31.6 63.9 110 169 246 (1)分析表中数据,归纳出KNO3的溶解度随温度变化的规律___________。 (2)20℃时,在装有5 g KNO3晶体的试管中,加入10 g水并充分振荡,此时所得溶液为___________(选填“饱和”或“不饱和”)溶液。再将该试管放入盛有热水的烧杯中,使试管内溶液温度升至60℃,此时试管内的溶液中溶质与溶剂的质量比为___________。 (3)配制一定溶质质量分数的KNO3溶液时,溶解过程所需要的仪器有__________。 12.(化学方程式2分,其余每空1分,共5分) 下图中的几种物质是常见的盐,请回答下列问题。 (1)在碳酸钠溶液中滴入氯化钙溶液,现象是______________________。 (2)碳酸钙、碳酸钠均能与稀盐酸反应生成CO2,是因为碳酸钙、碳酸钠中均含有___________(写离子符号)。 (3)硫酸铜溶液与氢氧化钠溶液能发生反应,该反应的化学方程式为___________;硫酸铜溶液与氯化钠溶液不能反应,其理由是______________________。 三、实验及探究题(共2小题,计12分) 13.(化学方程式2分,其余每空1分,共5分) 化学是一门以实验为基础的科学,下面是初中化学中几个重要的对比实验。 (1)实验1中,观察到铜片上的白磷燃烧而红磷不燃烧,可得出可燃物燃烧的一个条件为______________________。 (2)实验2中,观察到A烧杯中的现象是______________________,由此可验证分子的性质。 (3)实验3中,对比铁钉表面的不同现象,可推知防止铁生锈的原理是___________。 (4)实验4中,对比两支试管内液面高低的不同,可说明氢氧化钠能与二氧化碳发生反应,该反应的化学方程式为______________________。 14.(化学方程式2分,其余每空1分,共7分) 铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。 【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢? 【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。 将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中: 操作 根据现象得出金属活动性顺序 片刻后现象 有少量气泡 无气泡 无气泡 Fe > A1,Fe > Cu 几分钟后现象 有少量气泡 有大量气泡 无气泡 ___________ 【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与稀盐酸反应。 【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是_______________。 【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中: 操作 根据现象得出金属活动性顺序 现象 无明显现象 ______________ A1> Fe> Cu 写出铁与硫酸铜溶液反应的化学方程式______________。 【拓展迁移】(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与稀盐酸反应的要一次将稀盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为______________。 (2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序______________。 四、计算与分析题(5分) 15.为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取20 mL(密度为1.1 g/mL)的该盐酸与大理石充分反应,共用去含碳酸钙85%的大理石7.1g。 (1)浓盐酸需要密封保存的原因是______________。 (2)计算该盐酸的溶质质量分数。 参考答案 9.【C】 10.【A】 11.【A】12.【D】13.【D】14.【C】15.【B】 二、16.(Ⅰ、Ⅱ两小题只选做一题,如果两题全做。只按Ⅰ题计分。) Ⅰ.(1)混合物(2)活性炭(3)维生素 Ⅱ.(1)化学变化(2)pH试纸(3)CO(NH2)2或尿素 。 17.(1)CO2或二氧化碳(2)硬度增大或熔点降低。(3)燃烧。 18.(1)2KMnO4 △ K2MnO4+MnO2+O2↑(未配平或无条件或无“↑”符号扣1分,化学式错误扣2分) 。 (2)助燃或氧化 操作简便、节能、安全等(答一点即可) 。 19. (1)随温度的升高而增大。(2)饱和 1:2 。(3)烧杯和玻璃棒 。 20.(1) 产生白色沉淀 。(2)CO32- (3)CuSO4+2NaOH== Na2SO4+Cu(OH)2↓(未配平或无“↓”符号扣1分,化学式错误扣2分) ; 没有沉淀生成 。 三、21. (1)温度达到着火点 。(2)溶液由无色变为红色(3)隔绝氧气或隔绝水 。 (4)2NaOH+CO2==Na2CO3+H2O(未配平扣1分,化学式错误扣2分) 。 22. 【反思评价】除去金属表面的氧化物(或污物) 。 铁与硫酸铜溶液反应的化学方程式 Fe+CuSO4==FeSO4+Cu (化学式错误扣2分) 。 【拓展迁移】(1) Cu Fe Al(或铜 铁 铝)或Fe Cu Al(或铁 铜 铝) 。 (2) Cu Fe Al(或铜 铁 铝) 。 四、计算与分析题(5分) 23(1) 浓盐酸易挥发 。 (2)解:设该盐酸中溶质的质量为x。 CaCO3 + 2HCl === CaCl2 + H2O + CO2↑…………………………………(1分) 100 73 ………………………………………………………(1分) 7.1g×85% x ……………………………………………………………… (1分) x=4.4 g 盐酸的溶质质量分数=………………………………… (1分) 答:理论上可炼出纯铁336 t。 查看更多