- 2021-05-25 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】江苏省淮安市淮安区2019-2020学年高一下学期期中学业水平测试试题
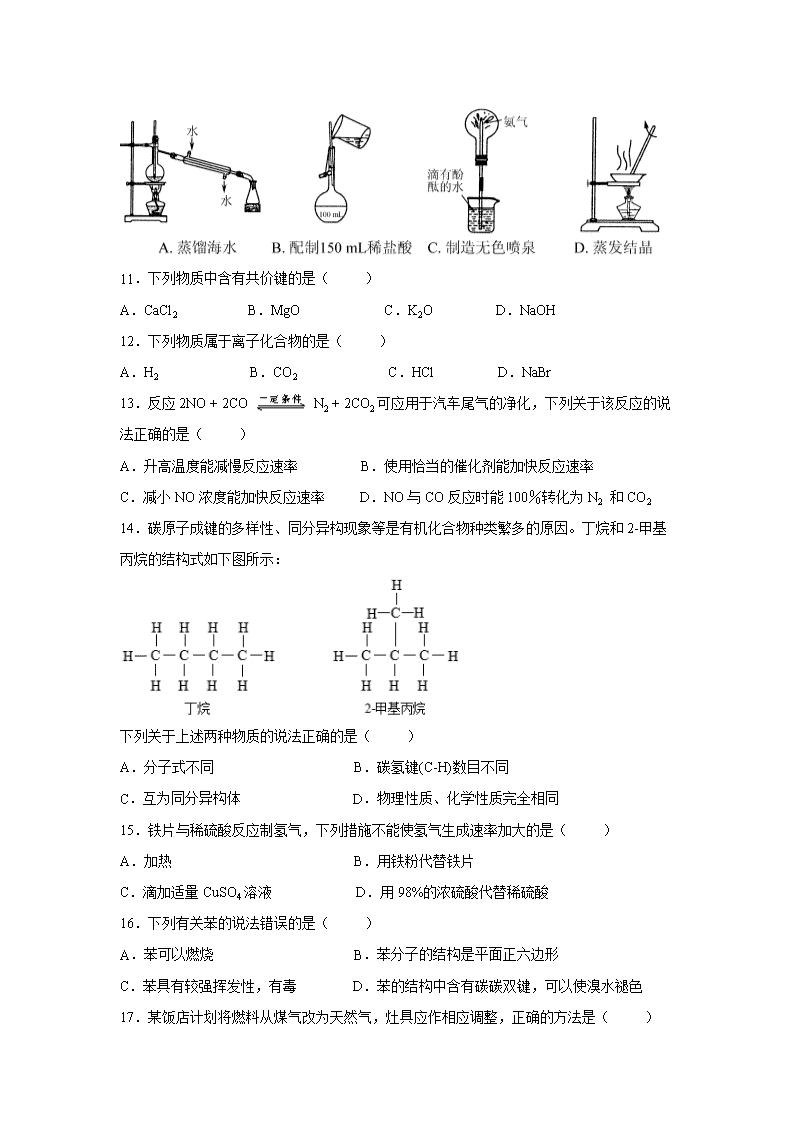
江苏省淮安市淮安区2019-2020学年高一下学期期中学业水平测试试题 考试时间:75分钟 总分:100分 可能用到的相对原子质量:H:1 N:14 O:16 Na:23 S:32 Ca:40 选择题(本题共26小题,每小题3分,共计78分。每小题只有一个选项符合题意) 1.2020年是淮安市创建全国文明城市决胜之年。下列做法不应提倡的是( ) A.拒绝露天烧烤,合理健康饮食 B.秸秆就地焚烧,增强土壤肥效 C.推广电动汽车,践行绿色交通 D.施行垃圾分类,有效节约资源 2.是常用于医学PET显像的一种核素。这里的“13”是指该原子的( ) A.质子数 B.电子数 C.中子数 D.质量数 3.下列变化属于化学变化的是( ) A.煤的干馏 B.石油分馏 C.氨气液化 D.矿石粉碎 4.下列化学用语正确的是( ) A.N2的电子式: B.NaCl的电子式: C.H2O的结构式:H-O-H D.Cl-的结构示意图: 5.下列属于吸热反应是( ) A.煤炭燃烧 B.硫酸和氢氧化钠溶液反应 C.铁与盐酸反应 D.NH4Cl与Ba(OH)2·8H2O反应 6.在含有大量 H+、Ba2+、Cl-的溶液中,还可能大量共存的离子是( ) A.Ag+ B.K+ C.CO32- D.SO42- 7.下列常见物质的俗名与化学式相对应的是( ) A.胆矾——CuSO4·5H2O B.烧碱——Na2CO3 C.小苏打——Na2SO4 D.明矾——Al2(SO4)3 8.以下物质间转化不能通过一步反应实现的是( ) A.Fe→FeCl2 B.N2→NO2 C.SiO2→Na2SiO3 D.Cl2→HCl 9.下列气体排放到空气中,会导致酸雨的是( ) A.NH3 B.CO2 C.N2 D.NO2 10. 下列有关实验装置进行的相应实验,能达到实验目的是( ) 11.下列物质中含有共价键的是( ) A.CaCl2 B.MgO C.K2O D.NaOH 12.下列物质属于离子化合物的是( ) A.H2 B.CO2 C.HCl D.NaBr 13.反应2NO + 2CO N2 + 2CO2可应用于汽车尾气的净化,下列关于该反应的说法正确的是( ) A.升高温度能减慢反应速率 B.使用恰当的催化剂能加快反应速率 C.减小NO浓度能加快反应速率 D.NO与CO反应时能100%转化为N2 和CO2 14.碳原子成键的多样性、同分异构现象等是有机化合物种类繁多的原因。丁烷和2-甲基丙烷的结构式如下图所示: 下列关于上述两种物质的说法正确的是( ) A.分子式不同 B.碳氢键(C-H)数目不同 C.互为同分异构体 D.物理性质、化学性质完全相同 15.铁片与稀硫酸反应制氢气,下列措施不能使氢气生成速率加大的是( ) A.加热 B.用铁粉代替铁片 C.滴加适量CuSO4溶液 D.用98%的浓硫酸代替稀硫酸 16.下列有关苯的说法错误的是( ) A.苯可以燃烧 B.苯分子的结构是平面正六边形 C.苯具有较强挥发性,有毒 D.苯的结构中含有碳碳双键,可以使溴水褪色 17.某饭店计划将燃料从煤气改为天然气,灶具应作相应调整,正确的方法是( ) A.空气和天然气进入量都减小 B.增大空气进入量或减小天然气进入量 C.空气和天然气进入量都增大 D.增大天然气进入量或减小空气进入量 请阅读下列材料,回答18~ 20题。 联合国将2019年定为“国际化学元素周期表年”以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。 18.为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素Md的中子数为( ) A.101 B.359 C.258 D.157 19.O和S都属于元素周期表ⅥA元素,它们原子结构中相同的是( ) A.质子数 B.电子层数 C.电子数 D.最外层电子数 20.锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( ) A.金属性比钠弱 B.最高化合价为+2 C.单质与水的反应比钠更剧烈 D.原子半径比钠的大 21.下列反应的离子方程式书写正确的是( ) A.铁与盐酸反应: B.钠与水反应: C.碳酸钙与醋酸反应: D.铜与稀硝酸反应: 22.某原电池装置如图所示。该电池工作时,下列说法正确的是( ) A.铜片作负极 B.Zn片发生还原反应 C.将化学能转化为电能 D.电子由铜片经导线流向锌片 23.下列有机反应方程式书写正确且为加成反应的是( ) A. B.CH2 = CH2 + Br2 → CH3—CHBr2 C.CH2 = CH2+H2OCH3CH2OH D. 24.下列实验操作能达到目的的是( ) A.用碱石灰干燥氯气 B.用品红溶液鉴别CO2和SO2 C.用乙醇萃取碘水中的碘单质 D.用澄清石灰水检验碳酸钠溶液中是否含有碳酸氢钠 25.短周期主族元素 X、Y、Z、W 的原子序数依次增大。X原子的最外层电子数是内层电子数的3倍,Y原子半径是短周期元素中最大的,Z与X属于同一主族。下列说法正确的是( ) A.由W、Y 组成的化合物为共价化合物 B.Z 的简单气态氢化物的热稳定性比X的强 C.原子半径:r(W) > r(Z) > r(Y) > r(X) D.Y的最高价氧化物对应的水化物是一种强碱 26.根据下列实验操作和现象,所得结论正确的是 ( ) 选项 操作 现象 结论 A 将两根打磨光亮的镁条分别插入硫酸铜溶液和硝酸银溶液 两根镁条上均有固体附着 金属的活动性顺序为Mg>Cu>Ag B 将KSCN溶液滴入盛有无色溶液的试管中 溶液变为血红色 溶液中含有Fe3+ C 将铝片插入盛有浓硫酸的试管中 无明显现象 铝与浓硫酸不反应 D 将混有乙烯的甲烷气体通入到酸性KMnO4溶液中 紫红色溶液褪色 甲烷与酸性KMnO4溶液发生了反应 非选择题(本大题共3题,共计22分) 27.(6分)根据题意完成下列填空 (1)a.金刚石和石墨 b.12C和13C c.CH4和C2H6 d.乙醇与二甲醚(填字母) ① 互为同位素的是 ▲ ② 互为同素异形体的是 ▲ ③ 互为同系物的是 ▲ ④ 互为同分异构体的是 ▲ (2)请补充完下列方程式: ① CH4 + Cl2 ▲ + HCl ② CH2 = CH2 + Br2 → ▲ 28.(6分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下图是元素周期表的一部分,表中所列序号①、②、③、④、⑤、⑥、⑦、⑧分别代表某种化学元素。根据表格所给信息,回答下列问题: (1)8种元素中,性质最稳定的是 ▲ (填元素符号); (2)①与④可形成 ▲ 化合物(填“共价”、“离子”),其电子式为 ▲ 。 (3)原子半径② ▲ ③,① ▲ ⑤(填 “>” 、 “<”或 “=”)。 (4)在元素⑤、⑥、⑦中,金属性最强的元素是 ▲ 。(填元素符号)。 29.(10分) Ca(NO2)2常用于电子、仪表及冶金工业。某化工厂采用下列方案制备Ca(NO2)2,并除去氮氧化物(大气污染物),工艺流程如下: ①NO2+NO+Ca(OH) 2 ═ Ca(NO2)2+H2O;4NO2+2Ca(OH)2 ═ Ca(NO2)2+Ca(NO3)2+2H2O ②在酸性条件下2NO2-+ 4H++2I- ═ 2NO↑ + I2 + 2H2O ;2S2O32- + I2 = S4O62- + 2I- (1)为加快CaCO3的分解速率,可以采取的措施有 ▲ (任写一种)。 (2)“制浆”过程中生成Ca(OH)2的化学方程式是 ▲ 。 (3)该工艺流程中需控制NO和NO2物质的量之比接近1∶1。若n(NO2)∶n(NO)>1∶1,则会导致 ▲ 。 (4)Ca(NO2)2样品纯度的测定 ①准确称取1.50g Ca(NO2)2样品配成250ml的溶液,取25ml于锥形瓶中,加入过量的KI溶液、淀粉溶液,滴加稀硫酸,溶液变蓝。 ②用0.1mol·L-1Na2S2O3溶液滴定溶液至无色,消耗Na2S2O3 溶液的体积为20.00ml,据此计算样品中Ca(NO2)2的纯度,写出计算过程。 【参考答案】 单项选择题 题号 1 2 3 4 5 6 7 8 9 10 答案 B D A C D B A B D D 题号 11 12 13 14 15 16 17 18 19 20 答案 D D B C D D B D D A 题号 21 22 23 24 25 26 答案 D C C B D B 非选择题(本大题共3题,共计22分) 27. (每空1分) (1) ① b ② a ③ c ④ d (2) ① CH3Cl CH2BrCH2Br 28. (每空1分) (1)Ar (2)共价 (3)> < (4)Na 29.(1)提高反应温度,将CaCO3磨碎等. 2分 (2)CaO + H2O = Ca(OH)2 2分 (3)产品Ca(NO2)2中Ca(NO3)2含量升高 2分 (4)解:n(Na2S2O3)=0.1mol·L-1·20.00ml×10-3=2.0×10-3mol 由关系式:Ca(NO2)2~I2~2Na2S2O3 得 n [Ca(NO2)2] =1/2n(Na2S2O3)= 1.0×10-3mol 1分 则原样品中m[Ca(NO2)2]= 1.0×10-3mol××132g· mol-1=1.32g 1分 Ca(NO2)2样品的纯度为:×100%=88% 2分查看更多