- 2021-05-25 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
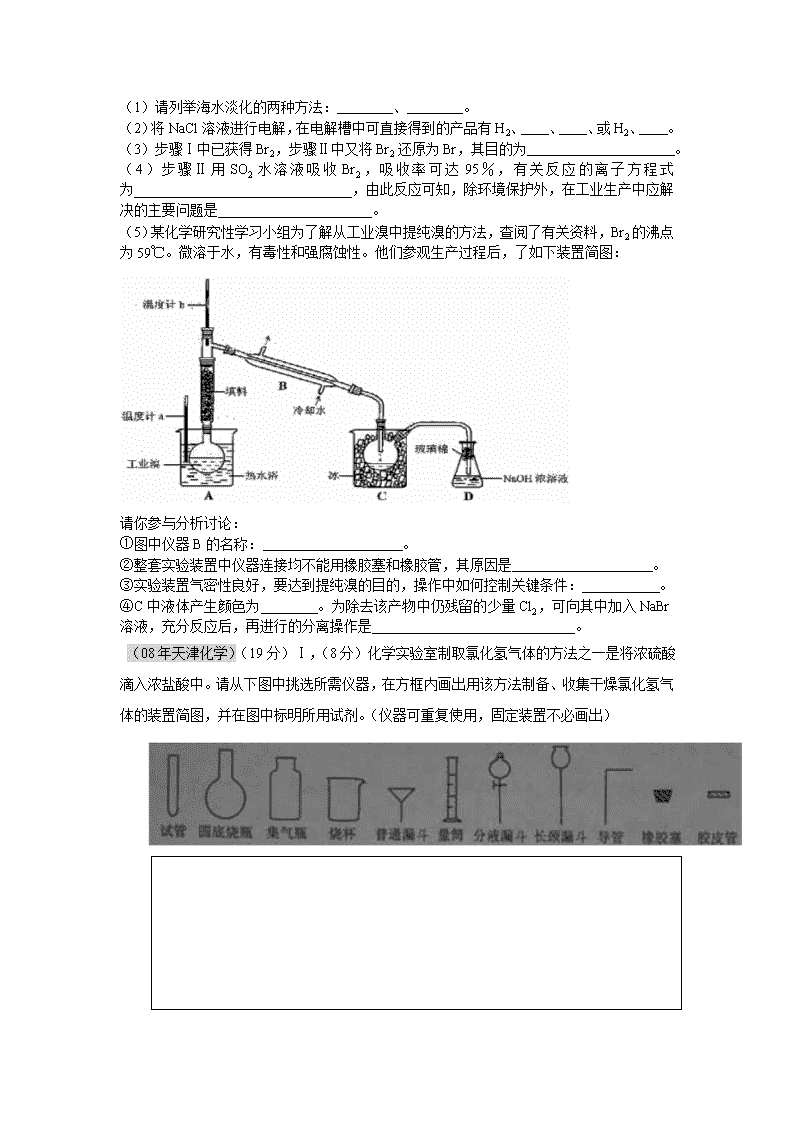
十年天津化学高考实验化学
学员 辅导教师 使用日期 年 月 日 (11年天津化学)1.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是 操作 现象 结论 A 滴加BaCl2溶液 生成白色沉淀 原溶液中有SO42- B 滴加氯水和CCl4,振荡、静置 下层溶液显紫色 原溶液中有I- C 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中有Na+、无K+ D 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无NH4+ (10年天津化学)2.下列实验设计及其对应的离子方程式均正确的是 A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+ B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑ C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO- D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: 2MnO + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O (09年天津化学)3.下列实验设计和结论相符的是 A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 (09年天津化学)4.下列实验方法合理的是 A、 可用水鉴别已烷、四氯化碳、乙醇三种无色液体 B、油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离 C、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量相等 (07年天津化学)5.为达到预期的实验目的,下列操作正确的是 A.欲配制质量分数为10%的ZnSO4溶液,将l0 g ZnSO4·7H2O溶解在90 g水中 B.欲制备F(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 C.为鉴别KCl、AICl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用 (05年天津化学)6.下列除杂质的方法不可行的是 A.用过量氨水除去Al3+溶液中的少量Fe3+ B.将混合气体通过灼热的铜网除去N2中的少量O2 C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 D.用盐酸除去AgCl中少量的Ag2CO3 (05年天津化学)7.下列实验操作或事故处理中,正确的做法是 A.银镜反应实验后附有银的试管,可用稀H2SO4清洗 B.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次 C.不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗 D.在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液 (10年天津化学)(18分) 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。 制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。 用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。 请回答下列问题: ⑴ TiCl4水解生成TiO2·x H2O的化学方程式为__________________ 。 ⑵ 检验TiO2·x H2O中Cl-是否被除净的方法是_________ ______________。 ⑶ 下列可用于测定TiO2粒子大小的方法是________________(填字母代号)。 a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法 ⑷ 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是____________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。 a b c d e ⑸ 滴定终点的现象是__________________________________________。 ⑹ 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。 ⑺ 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”) ① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。 ② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。 (09年天津化学)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下: (1)请列举海水淡化的两种方法: 、 。 (2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。 (3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为 。 (4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图: 请你参与分析讨论: ①图中仪器B的名称: 。 ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。 ③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。 ④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。 (08年天津化学)(19分)Ⅰ,(8分)化学实验室制取氯化氢气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出) Ⅱ,(11分)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。 (1)写出该实验制备硫酸亚铁的化学方程式: 。 (2)硫酸溶液过稀会导致 。 (3)采用水浴加热的原因是 。 (4)反应时铁屑过量的目的是(用离子方程式表示) 。 (5)溶液趁热过滤的原因是 。 塞紧试管口的目的是 。 (6)静置冷却一段时间后,在试管中观察到的现象是 。 (07年天津化学)(19分)二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息: ① 将干燥的氯气在110℃ ~ 140℃与硫反应,即可得S2C12粗品。 ② 有关物质的部分性质如下表: 物质 熔点/℃ 沸点/℃ 化学性质 S 112.8 444.6 略 S2C12 -77 137 遇水生成HCl、SO2、S; 300℃以上完全分解; S2C12 + C12 2SCl2 设计实验装置图如下: ⑴.上图中气体发生和尾气处理装置不够完善,请你提出改进意见____________________________________________________________________________。 利用改进后的正确装置进行实验,请回答下列问题: ⑵.B中反应的离子方程式:_________________________________________________; E中反应的化学方程式:_________________________________________________。 ⑶.C、D中的试剂分别是__________________________、_______________________。 ⑷.仪器A、B的名称分别是____________、____________,F的作用是___________。 ⑸.如果在加热E时温度过高,对实验结果的影响是_____________________________, 在F中可能出现的现象是________________________________________________。 ⑹.S2C12粗品中可能混有的杂质是(填写两种)______________、________________,为了提高S2C12的纯度,关键的操作是控制好温度和______________________________。 (06年天津化学)(19分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤 如下: ① 高温下用碳还原二氧化硅制得粗硅 300℃ ②粗硅与干燥 HCl气体反应制得 SiHCl3:Si +3HCl =====SiHCl3+H2 ③SiHCl3 与过量 H2 在 1000~1100℃反应制得纯硅 已知 SiHCl3,能与 H2O强烈反应,在空气中易自燃。 请回答下列问题: (1)第①步制备粗硅的化学反应方程式为 __________________。 (2)粗硅与HCl反映完全后,经冷凝得到的SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点 57.6℃)和 HCl(沸点-84.7℃),提纯 SiHCl3 采用的方法为__________________。 (3)用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略去): ①装置 B中的试剂是 ______________。 装置 C中的烧瓶需要加热,其目的是 _____________________。 ②反应一段时间后,装置 D中观察到的现象是 _________________,装置 D不能采用普通玻璃管的原因是__________________ ,装置D中发生反应的化学方程式为_______________ 。 ③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以 及____________________ 。 ④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________ 。 a. 碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3 溶液 (05年天津化学)根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是: 将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,得Na2CO3固体。 四种盐在不同温度下的溶解度(g/100g水)表 温度 盐 溶解度 0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 100℃ NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 39.8 NH4HCO3 11.9 15.8 21.0 27.0 —① — — — NaHCO3 6.9 8.1 9.6 11.1 12.7 14.5 16.4 — NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.3 77.3 ①> 35℃NH4HCO3会有分解 请回答: ⑴ 反应温度控制在30—35℃,是因为若高于35℃,则____________________,若低于30℃,则_____________________________,为控制此温度范围,采取的加热方法为_________________。 ⑵ 加料完毕后,继续保温30分钟,目的________________________________________。 静置后只析出NaHCO3晶体的原因是________________________________ 。 用蒸馏水洗涤NaHCO3晶体的目的是除去_______________杂质(以化学式表示) ⑶ 过滤所得的母液中含有______________________ (以化学式表示),需加入_______,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl ⑷ 测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c( mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32—+H+==HCO3—反应的终点),所用HCl溶液的体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式: NaHCO3% = ______________________________。 (04年天津化学)(19分)I. 合成氨工业对化学的国防工业具有重要意义。写出氨的两种重要用途 。 II. 实验室制备氨气,下列方法中适宜选用的是 。 ① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水 ③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热 III. 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。 [实验操作] ① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e ,则A中有氢气发生。在F出口处收集氢气并检验其纯度。 ② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。 ③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。 回答下列问题: (1)检验氢气纯度的目的是 。 (2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。 (3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。 (03年全国化学)(22分)用下面两种方法可以制得白色的沉淀。 方法一:用不含 的 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。 (1)用硫酸亚铁晶体配制上述 FeSO4 溶液时还需加入 。 (2)除去蒸馏水中溶解的 O2 常采用 的方法。 (3)生成白色 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是 。 方法二:在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。 (1)在试管 Ⅰ 里加入的试剂是 。 (2)在试管 Ⅱ 里加入的试剂是 。 (3)为了制得白色 沉淀,在试管 Ⅰ 和 Ⅱ 中加入试剂,打开止水夹,寨紧寨子后的实验步骤是 。 (4)这样生成的 沉淀能较长时间保持白色,其理由是 。 (02年全国化学)(16分)根据下图回答问题: (1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。 答: (2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式: _______________________________________________________________。 (3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用: A中加人的试剂是_______________________作用是_______________________。 B中加入的试剂是_______________________作用是_______________________。 C中加入的试剂是_______________________作用是除尽________________气体。 D中加入的试剂是_______________________作用是_______________________。 (4)实验时,C中应观察到的现象是__________________________________________ ____________________________________________________.查看更多