- 2021-05-24 发布 |
- 37.5 KB |
- 71页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学二轮复习精品课件 专题6 微粒结构与化学键
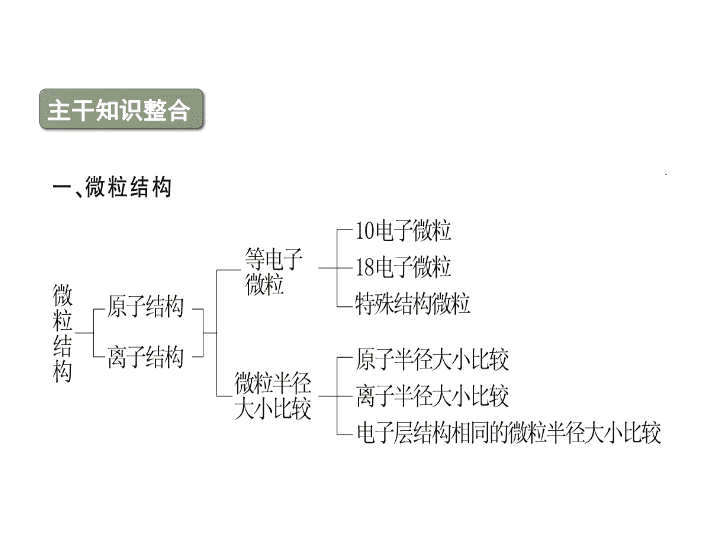
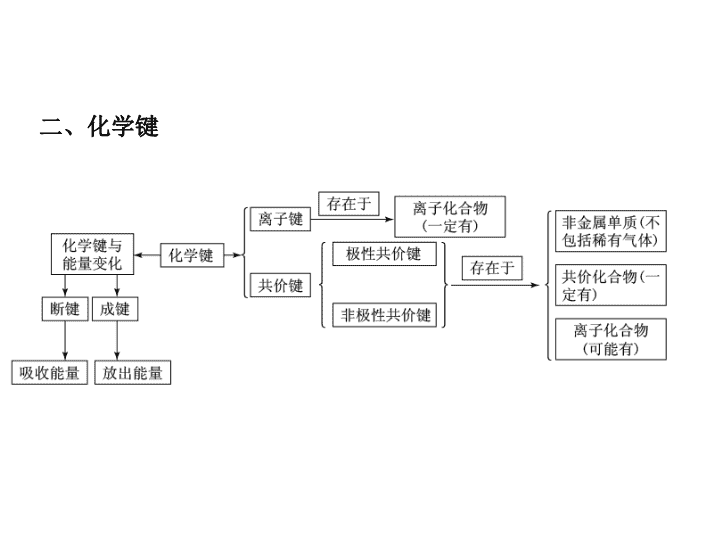
主干知识整合 二、化学键 1.离子化合物与共价化合物的比较 项目 离子化合物 共价化合物 定义 含有离子键的化合物 只含有共价键的化合物 结构粒子 阴、阳离子 原子 化学键 类型 一定含有离子键,可能含有 共价键 只含共价键 项目 离子化合物 共价化合物 与物质类 别的关系 ①强碱 ②绝大多数盐 ③活泼金属氧化物 ①所有的酸 ②弱碱 ③气态氢化物 ④非金属氧化物 ⑤极少数盐 主要物 理性质 ①熔、沸点较高,硬度较大, 通常呈固态 ②固态不导电,熔融态或溶于 水后导电 ①熔、沸点、硬度差异较大 ②熔融态不导电,某些溶于水 后导电 2.判断方法 (1)根据构成化合物的元素种类来判断.一般地,活泼金属(第 ⅠA、ⅡA族)和活泼非金属(第ⅥA、ⅦA族)的元素形成的是 离子键,对应的物质是离子化合物;同种或不同种非金属 原子之间形成的是共价键,对应的物质是共价化合物. (2)根据化合物的类型来判断.大多数碱性氧化物、强碱和盐 属于离子化合物;非金属氢化物、非金属氧化物、含氧酸 属于共价化合物. [例1] 元素X、Y和Z可结合形成化合物XYZ3;X、Y和 Z的原子序数之和为26;Y和Z在同一周期.下列有关推 测正确的是 ( ) A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化 合物XY B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化 合物XZ C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化 合物YZ D.XYZ3是一种离子化合物,且Y与Z可形成离子化合 物YZ2 [名师精析] 由题目可知,XYZ3可能的物质有:NaNO3、 MgCO3、AlBO3,A项错误;若XYZ3为MgCO3微溶于 水,XZ可形成离子化合物MgO,B项正确;若XYZ3为 NaNO3易溶于水的盐,YZ(NO)不是离子化合物,C项错 误;若XYZ3为离子化合物,YZ2为NO2、CO2均不是离 子化合物,D项错误. [答案] B 判断化合物是离子化合物还是共价化合物可以根据 以下两个方面: (1)根据构成化合物的粒子间是以离子键还是以共价键结 合来判断. (2)根据化合物的熔沸点、导电性等性质来判断. 1.下列叙述正确的是 ( ) A.两种非金属原子间不可能形成离子键 B.非金属原子间不可能形成离子化合物 C.离子化合物中不可能有共价键 D.共价化合物中可能有离子键 答案:A 解析:两种非金属原子间不能发生电子转移,不能形成 离子键,A正确;当非金属原子组成原子团时,可以形 成离子化合物,如NH4Cl,B错误;离子化合物中可以 有共价键,如:NaOH中的O—H键,C错误;有离子键 就是离子化合物,D错误. 2.下列物质中,只含有极性键的共价化合物是 ( ) A.Na2O2 B.Ba(OH)2 C.HClO D.H2O2 答案:C 解析:A项,Na2O2是含有非极性共价键和离子键的离 子化合物;B项,Ba(OH)2是含有极性共价键和离子键的 离子化合物;C项,HClO中氢原子和氧原子、氧原子和 氯原子之间形成的都是极性共价键,HClO为共价化合物; D项H2O2既含有极性键又含有非极性键. 1.化学键与物质类别的关系 (1)只含共价键的物质 ①非金属元素构成的单质,如I2、N2、P4、金刚石、晶体 硅等. ②非金属元素构成的共价化合物,如HCl、NH3、SiO2、 CS2等. (2)只含有离子键的物质.活泼非金属元素与活泼金属元 素形成的化合物,如Na2S、CsCl、K2O、NaH等. (3)既含有离子键又含有共价键的物质.如Na2O2、CaC2、 NH4Cl、NaOH、Na2SO4等. (4)无化学键的物质.稀有气体,如氩气、氦气等. 2.化学键对物质性质的影响 (1)对物理性质的影响 金刚石、晶体硅、石英、金刚砂等物质,硬度大、熔点高, 就是因为其中的共价键很强,破坏时需消耗很多的能量. NaCl等部分离子化合物,也有很强的离子键,故熔点也较 高. (2)对化学性质的影响 N2分子中有很强的共价键,故在通常状况下,N2很稳定, H2S、HI等分子中的共价键较弱,故它们受热时易分解. [例2] 下列物质按只含离子键、只含共价键、既含离子键 又含共价键的顺序排列的是 ( ) A.氯气 二氧化碳 氢氧化钠 B.氯化钠 过氧化氢 氯化铵 C.氯化钠 过氧化钠 氯化铵 D.氯化钠 氦气 氢氧化钠 [名师精析] A项,Cl2中只含共价键;C项,Na2O2中既 含离子键,又含共价键;D项,氦气中不含任何化学键. [答案] B (1)有化学键被破坏的变化不一定是化学变化,如HCl 溶于水、NaCl晶体熔化. (2)许多非金属单质和许多共价化合物在熔化时并不破 坏共价键,如O2、HCl、CO2、H2O等. 3.关于离子键、共价键的各种叙述,下列说法中正确的是 ( ) A.在离子化合物里,只存在离子键,没有共价键 B.非极性键只存在于双原子的单质分子(如Cl2)中 C.在共价化合物分子内,一定不存在离子键 D.由多种元素组成的多原子分子里,一定只存在极性 键 解析:A项,如NH4Cl中有共价键.B项,如H2O2中O与 O之间为非极性键.C项,若有离子键,则属于离子化 合物.D项,如H2O2、C2H6中,都存在非极性键. 答案:C 4.在下列变化过程中,既有离子键被破坏又有共价键被 破坏的是 ( ) A.将SO2通入水中 B.烧碱溶于水 C.将HCl通入水中 D.硫酸氢钠溶于水 答案:D (2)主族元素的简单离子中,阳离子的电子式就是离子符号. 如Mg2+既是镁离子符号,也是镁离子的电子式.阴离子的 最外层都是8电子结构(H-最外层是2个电子),要表示出原 子原来的电子与获得的电子的区别,在表示电子的符号外加 方括号,方括号的右上角标明所带电荷.如S2-的电子式 为 ,Cl-的电子式为 . (3)离子化合物中阴阳离子个数比不是1∶ 1时,要注意每 一个离子都与带相反电荷的离子直接相邻的事实. 如MgCl2的电子式为 Mg2+ ,不 能写成Mg2+ 或Mg2+ (4)写双原子分子的非金属单质的电子式时,要注意共用电 子对的数目和表示方法. 如N2的电子式应为 ,不能写 成 ,更不能写成 或 . (5)要注意共价化合物与离子化合物电子式的区别,前者不加 括号,不写表示电荷的符号,后者阴离子加方括号,括号外 写表示电荷的符号.前者的共用电子对一般还要求表示出其 组成电子来源于哪一原子. 如H2O分子的电子式为 ,不能写成 H+.又如H2O2分子的电子式为 ,Na2O2的电 子式为Na+ Na+. 2.原子结构示意图的书写 圆圈内标出核电荷数且一定要带“+”,弧线上标出电子 层上的电子数,要注意区分是原子结构示意图,还是离子 结构示意图. 如: 3.结构式与结构简式的书写 结构式就是把电子式中的共用电子对用短线表示, 未成键电子省略不写,如Cl-Cl,O == C == O, 等.结构简式通常用于有机物中,在 结构式的基础上省略碳氢键.如CH3CH3、CH3 CH2OH. [例] (2010·新课标全国卷)下列各项表达中正确的是( ) A.Na2O2的电子式为 B.106 g的乙醇和丙醇混合液完全燃烧生成的CO2为112 L (标准状况) C.在氮原子中,质子数为7而中子数不一定为7 D.Cl-的结构示意图为 解析:A项中Na2O2是离子化合物,不正确;乙醇和丙醇 的物质的量之比为1∶ 1时,才能生成标准状况下112 L的 CO2;D项写的是氯原子的是结构示意图. 答案:C 要点热点探究 ► 探究点一 常见等电子微粒 1.10电子微粒 2.18电子微粒 【点评】 “根”通常指带有电荷的原子或原子团,如氯离子、 氢氧根离子、铵根离子、硫酸根离子等带电的离子,存在于 离子晶体中或溶液中。“基”是电中性的原子或原子团,如 羟基、硝基、甲基等,主要存在于有机物分子中。但这些有 机分子不能电离出“基”,“基”在一定条件下可以发生取 代反应。所有有机官能团都属于“基”。 a、b、c、d、e、f、g为七种由短周期元素构成的微粒, 它们都有10个电子,其结构特点如下: 微粒代码 a b c d e f g 原子核数 单核 单核 双核 多核 单核 多核 多核 带电荷数(单位 电荷) 0 1+ 1- 0 2+ 1+ 0 其中b的离子半径大于e的离子半径;d是由极性键构成的四 原子极性分子;c与f可形成两个共价型g分子。 试写出: (1)a粒子的原子结构示意图__________。 (2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较 为________>________(用化学式表示)。 (3)d溶于水的电离方程式_____________。 (4)d粒子的电子式________。 (5)c粒子是________,f粒子是______(用化学式表示)。 【答案】 【解析】 由表中信息较易看出:b离子为Na+,e离子为 Mg2+,a为氖原子,双核10电子带一个单位负电荷的微 粒为OH-,根据c与f可形成两个共价型g分子可知f与g分 别为H3O+与H2O。 例2 用A+、B-、C2-、D、E、F、G和H分别表示含有18 个电子的八种微粒(离子或分子),请回答: (1)A元素是___、B元素是___、C元素是___(用元素符号表示)。 (2)D是由两种元素组成的双原子分子,其分子式是________。 (3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子 式是________。 (4)F是由两种元素组成的三原子分子,其分子式是________, 电子式是________。 (5)G分子中含有4个原子,其分子式是________。 (6)H分子中含有8个原子,其分子 ► 探究点二 微粒半径大小比较 例3 A、B、C为三种短周期元素,A、B在同周期,A、C的 最低价离子分别为A2-和C-,B2+和C-具有相同的电子层 结构。下列说法中正确的是( ) A.原子序数:B>A>C B.原子半径:A>B>C C.离子半径:A2->C->B2+ D.原子最外层电子数:A>C>B 【点评】 主族元素的原子形成简单阳离子时减少一个电子层, 而主族元素的原子形成简单阴离子时,电子层数没有变化, 故电子排布相同的阴离子和阳离子所对应的元素在周期表中 必为左下和右上关系。 ► 探究点三 化学键与物质类别的关系 1.当一个化合物中只存在离子键时,该化合物是离子化 合物。 2.当一个化合物中同时存在离子键和共价键时,该化合 物是离子化合物。 3.只有当化合物中只存在共价键时,该化合物才是共价 化合物。 专题六 │ 要点热点探究 4.在离子化合物中一般既含有金属元素又含有非金属元素 (铵盐除外);共价化合物一般只含有非金属元素,但个别含 有金属元素,如AlCl3也是共价化合物;只含有非金属元素 的化合物不一定是共价化合物,如铵盐。 5.非金属单质只有共价键(稀有气体除外)。 6.含共价键的化合物不一定都由非金属元素组成。如 AlCl3属于共价化合物。 [特别注意] (1)氢化物不一定都是共价化合物,如NaH。 (2)NaHSO4熔融时电离成Na+和HSO,而溶于水时电离成 Na+、H+和SO。因为熔融时只能破坏离子键,而溶于水 时既可以破坏离子键又可以破坏共价键。 (3)形成离子键的元素不一定是金属元素和非金属元素。如 仅由非金属元素形成的离子化合物氯化铵中NH和Cl-之间 为离子键。形成共价键的元素也不一定就是非金属元素, 如氯化铝中的化学键为共价键。 专题六 │ 要点热点探究 A 【解析】 氯化铵、硝酸铵均属于离子化合物,没有金 属元素,B项错误;葡萄糖是小分子,其溶液不属于胶体, 而蛋白质、淀粉为大分子,其分子半径介于1~100 nm之间, 其溶液属于胶体,C项错误;D项忽视了含氢共价化合物中 的氢原子最外层只有两个电子,也属于稳定结构,D项错 误。 2.下列事实与氢键有关的是( ) A.水加热到很高的温度都难以分解 B.水结成冰体积膨胀,密度变小 C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而 升高 D.HF、HCl、HBr、HI的热稳定性依次减弱 【解析】 B 氢化物的热稳定性与对应元素的非金属 性强弱有关,而与氢键无关,氢键只影响物质的物理性 质,A、D项错误,B项正确;分子组成结构相似的物质, 相对分子质量越大,熔点越高,与氢键无关,C项错误。查看更多