- 2021-05-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习苏教版离子反应、离子共存和溶液中的离子平衡作业
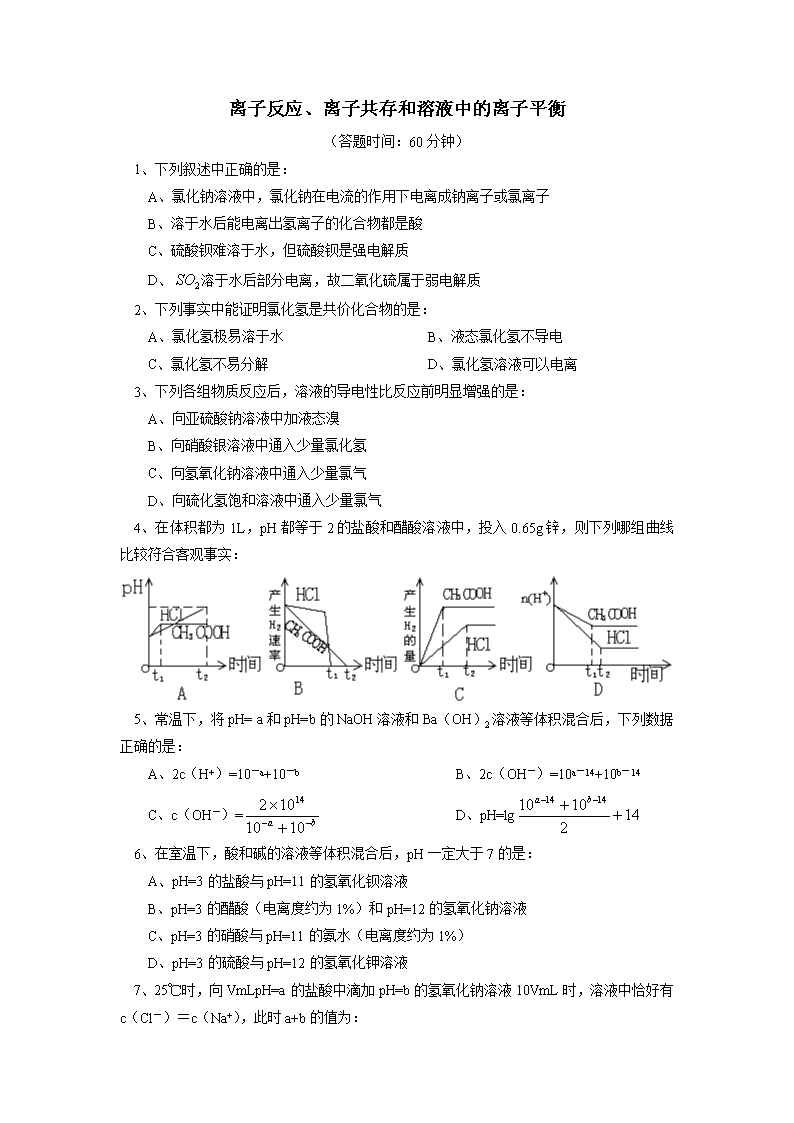
离子反应、离子共存和溶液中的离子平衡 (答题时间:60分钟) 1、下列叙述中正确的是: A、氯化钠溶液中,氯化钠在电流的作用下电离成钠离子或氯离子 B、溶于水后能电离出氢离子的化合物都是酸 C、硫酸钡难溶于水,但硫酸钡是强电解质 D、溶于水后部分电离,故二氧化硫属于弱电解质 2、下列事实中能证明氯化氢是共价化合物的是: A、氯化氢极易溶于水 B、液态氯化氢不导电 C、氯化氢不易分解 D、氯化氢溶液可以电离 3、下列各组物质反应后,溶液的导电性比反应前明显增强的是: A、向亚硫酸钠溶液中加液态溴 B、向硝酸银溶液中通入少量氯化氢 C、向氢氧化钠溶液中通入少量氯气 D、向硫化氢饱和溶液中通入少量氯气 4、在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌,则下列哪组曲线比较符合客观事实: 5、常温下,将pH= a和pH=b的NaOH溶液和Ba(OH)2溶液等体积混合后,下列数据正确的是: A、2c(H+)=10-a+10-b B、2c(OH-)=10a-14+10b-14 C、c(OH-)= D、pH=lg 6、在室温下,酸和碱的溶液等体积混合后,pH一定大于7的是: A、pH=3的盐酸与pH=11的氢氧化钡溶液 B、pH=3的醋酸(电离度约为1%)和pH=12的氢氧化钠溶液 C、pH=3的硝酸与pH=11的氨水(电离度约为1%) D、pH=3的硫酸与pH=12的氢氧化钾溶液 7、25℃时,向VmLpH=a的盐酸中滴加pH=b的氢氧化钠溶液10VmL时,溶液中恰好有 c(Cl-)=c(Na+),此时a+b的值为: A、13 B、15 C、14 D、不能确定 8、若200mLc(H+)=10-3mol/L的某一元酸与100mL c(OH-)=10-3mol/L的某一元碱溶液相混合后,溶液呈碱性,所用的酸和碱应是: A、等浓度的弱酸和强碱 B、稀的弱酸和浓的强碱 C、稀的强酸和稀的强碱 D、稀的强酸和浓的弱碱 9、关于小苏打水溶液的表述正确的是: A、c (Na+)=c (HCO3-) + c (CO32-) + c (H2CO3) B、c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-) C、HCO3- 的电离程度大于HCO3-的水解程度 D、存在的电离有:NaHCO3= Na++HCO3-,HCO3-H++CO32-;H2OH++OH- 10、混合Na2S跟NaHS两溶液,且浓度相等,此混合液中,下列关系一定正确的是: A、c(Na+)+c(H+)=2(S2-)+c(HS-)+c(OH-) B、c(Na+)>c(HS-)>c(S2-)>c(OH-) C、c(Na+)=c(S2-)+c(HS-)+c(H2S) D、c(HS-)>c(H+)>c(OH-)>c(Na+) 11、已知0.1mol/L的HCN溶液pH=4,0.1mol/L的NaCN溶液的pH=12。现将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子浓度关系正确的是: A、c(Na+)>c(CN-)>c(OH-)>c(H+) B、c(Na+)>c(CN-)>c(H+)>c(OH-) C、c(CN-)+c(OH-)>c(Na+)+c(H+) D、c(CN-)>c(Na+)>c(H+)>c(OH-) 12、下列各组离子中在碱性条件下可以共存,而加入盐酸后会产生气体和沉淀的是: A、Na+、NO3-、AlO2-、SO42- B、Na+、NO3-、SiO32-、K+ C、K+、Cl-、AlO2-、CO32- D、Na+、Cl-、HCO3-、Ca2+ 13、20℃,两种一元弱酸的钠盐NaX和NaY,已知往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是: A、酸性HX>HY B、结合H+能力Y->CO32->X->HCO3- C、溶液的碱性NaX>Na2CO3>NaY>NaHCO3 D、HX和HY酸性相同,但比H2CO3弱 14、某无色溶液中加入过量盐酸有沉淀产生,过滤后向溶液中加入过量纯碱溶液有沉淀产生,下列溶液中符合此条件的是: ①Ag+、Fe3+、Na+ ②Ag+、Al3+、K+ ③Ag+、Ba2+、K+ ④SiO32-、AlO2-、K+ ⑤Ag+、NH4+、H+ ⑥SiO32-、K+、Al3+ A、各组均符合 B、②③④⑥ C、①②③④⑤⑥ D、②③④ 15、已知:Cu (OH)2+4NH3=[Cu (NH3)4]2++2OH-,下列各组离子如大量共存于同一溶液中,肯定会发生沉淀的是: A、Al3+、Na+ 、SO42-、OH- B、Ba2+、H 3O+、PO43-、NO3- C、SO42-、OH- 、Cu2+、NH4+ D、K+、AlO2-、Cl-、NH4+ 16、25℃时,有pH=x的盐酸和pH=y 的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问: ①若x+y=14,则a/b=__ __(填数据); ②若x+y=13,则a/b=_ ___(填数据); ③若x+y>14,则a/b=_ ___(填表达式); ④该盐酸与该氢氧化钠溶液完全中和,两溶液的x和y的关系式 (填表达式)。 17、已知25℃时几种物质的电离度(溶液浓度为0.1mol/L)如下表:(已知H2SO4第一步电离是完全的) ①H2SO4溶液中的HSO4- ②NaHSO4溶液中的HSO4- ③CH3COOH ④HCl 10% 29% 1.33% 100% (1)25℃时,0.1mol/L上述几种溶液中c(H+)由大到小的顺序是(填序号,下同)_____________________________。 (2)25℃时,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是_____________________________。 (3)25℃时,将足量的锌粉投入等体积,pH等于1的上述几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是________________。 (4)25℃时,0.1mol/l H2SO4溶液中HSO4-的电离度小于0.1mol/L NaHSO4溶液中HSO4-的电离度的原因是_______________________ 18、⑴取0.2mol·L—1HX溶液与0.2 mol·L—1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题: ①混合溶液中由水电离出的c (OH-) 0.2 mol·L—1HX溶液中由水电离出的c (H+)(填“大于”、“小于”或“等于”)。 ②写出下列算式的精确计算结果(填具体数字): c (Na+) -c (X-)= mol·L-1;c (OH-) -c (HX) = mol·L-1。 ⑵如果取0.2mol·L—1HX溶液与0.1mol·L—1NaOH溶液等体积混合,测得混合溶液的pH>7,则说明HX的电离程度 NaX的水解程度(填“大于”、“小于”或“等于”)。 19、⑴BiCl3水解产物中有BiOCl生成:①写出该水解反应的方程式 , ②医药上将BiOCl称为次氯酸铋,该名称是否正确 ,原因是 , ③如何配制BiCl3溶液 。 ⑵在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有① ② ,用离子方程式表示产生上述现象的原因 ;在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象,这种单质是 A. 磷 B. 硫 C. 镁 D. 铜 20、某工厂排放出的废水,经测定含有0.001mol/L的游离氯和0.008mol/L的c(H+)。现采用Na2SO3除去其中的游离氯,若要处理5L这种废水, ①将Cl2除尽,需加入0.5mol/L的Na2SO3溶液多少mL? ②处理后的废水的pH为____。 21、白色粉末A由Na2S、Na2SO3、 Na2S2O3、Na2SO4、NaCl等物质中的三种混合而成。取一定A样品投入100mL2.2mol/L的盐酸中,充分反应后过滤,最终得到100mLpH为0的溶液。将溶液蒸干,只得到8.19g纯净物B。 ①B的化学式为______; ②请通过计算推断A中是否含有NaCl。 【试题答案】 1、C;2、B;3、D;4、D;5、BD;6、CD;7、A;8、D;9、AD;10、A;11、A; 12、C;13、AB;14、D;15、D 16、①1 ②0.1 ③10(x+y-14) ④x+y=14+1ga/b(应用酸的pH和碱的pH求出c(H+)和c(OH-) ,因为酸碱中和,必然有氢离子的物质的量等于氢氧根离子的物质的量。由此列出等式,再用题中的条件就可求解) 17、(1)①④②③ (2)③②④① (3)③②①④ (4)在稀H2SO4溶液中,由H2SO4电离出H+,能抑制HSO4-的电离,促使HSO4-H++SO42-平衡向左移动,而在NaHSO4溶液中不存在上述的作用 18、(1)①大于②9.9×10—7,10—8 (2)小于 19、(1)①BiCl3+H2OBiOCl+2HCl ②不正确 因BiOCl中的Cl为-1价,而不是+1价。 ③将少量BiCl3固体溶解于适量浓盐酸中,再加蒸馏水稀释。 (2)①气泡产生②红褐色沉淀产生 3CaCO3+2Fe3++3H2O=3Ca2++2Fe(OH)3↓+3CO2↑;C 20、①10mL ②pH=2 21、①NaCl ②有查看更多