2020届一轮复习人教通用版第六章化学反应与能量作业
考案[6]第六章 化学反应与能量
综合过关规范限时检测
(45分钟,100分)
第Ⅰ卷(选择题 共42分)
一、选择题:本题共7小题,每小题6分,共42分。每小题只有一个选项符合题意。
1.(2019·北京朝阳区期中统考)如图为氟利昂(如图CFCl3)破坏臭氧层的反应过程示意图,下列说法不正确的是( C )
A.过程Ⅰ中断裂C—Cl极性键
B.过程Ⅱ可表示为O3+Cl===ClO+O2
C.过程Ⅲ中O+O===O2是吸热过程
D.上述过程说明氟利昂中氯原子是破坏O3的催化剂
[解析] 由图可知,过程Ⅰ中CFCl3在紫外辐射下生成CFCl2和Cl原子,故该过程断裂C—Cl极性键,A正确;过程Ⅱ中Cl原子与O3反应生成O2、ClO,可表示为O3+Cl===ClO+O2,B正确;过程Ⅲ中O与O原子结合生成O2,成键过程放出热量,C错误;综合过程Ⅰ~Ⅲ可知,O3被氟利昂中氯原子破坏的过程可表示为2O33O2,该过程中氯原子起到催化剂作用,D正确。
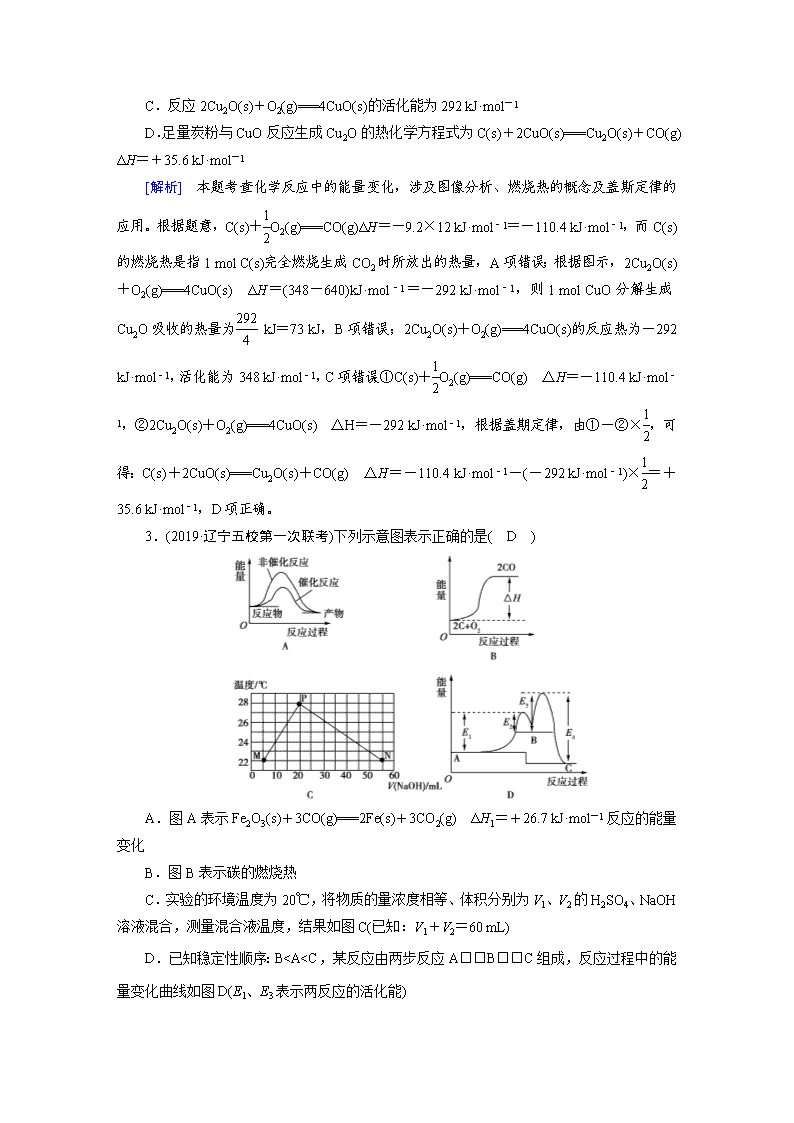
2.(2019·山东潍坊统一考试)已知:1 g C(s)燃烧生成一氧化碳放出9.2 kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( D )
A.碳[C(s)]的燃烧热ΔH为-110.4 kJ·mol-1
B.1 mol CuO分解生成Cu2O放出73 kJ的热量
C.反应2Cu2O(s)+O2(g)===4CuO(s)的活化能为292 kJ·mol-1
D.足量炭粉与CuO反应生成Cu2O的热化学方程式为C(s)+2CuO(s)===Cu2O(s)+CO(g) ΔH=+35.6 kJ·mol-1
[解析] 本题考查化学反应中的能量变化,涉及图像分析、燃烧热的概念及盖斯定律的应用。根据题意,C(s)+O2(g)===CO(g)ΔH=-9.2×12 kJ·mol-1=-110.4 kJ·mol-1,而C(s)的燃烧热是指1 mol C(s)完全燃烧生成CO2时所放出的热量,A项错误;根据图示,2Cu2O(s)+O2(g)===4CuO(s) ΔH=(348-640)kJ·mol-1=-292 kJ·mol-1,则1 mol CuO分解生成Cu2O吸收的热量为 kJ=73 kJ,B项错误;2Cu2O(s)+O2(g)===4CuO(s)的反应热为-292 kJ·mol-1,活化能为348 kJ·mol-1,C项错误;①C(s)+O2(g)===CO(g) △H=-110.4 kJ·mol-1,②2Cu2O(s)+O2(g)===4CuO(s) △H=-292 kJ·mol-1,根据盖期定律,由①-②×,可得:C(s)+2CuO(s)===Cu2O(s)+CO(g) △H=-110.4 kJ·mol-1-(-292 kJ·mol-1)×=+35.6 kJ·mol-1,D项正确。
3.(2019·辽宁五校第一次联考)下列示意图表示正确的是( D )
A.图A表示Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=+26.7 kJ·mol-1反应的能量变化
B.图B表示碳的燃烧热
C.实验的环境温度为20℃,将物质的量浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,测量混合液温度,结果如图C(已知:V1+V2=60 mL)
D.已知稳定性顺序:B
A>C,故分步反应:AB为吸热反应,BC为放热反应,总反应AC为放热反应,D项正确。
4.(2019·河北衡水中学调研)在25℃、1.01×105 Pa下,将22 gCO2通入750 mL 1.0 mol·L-1的NaOH溶液中充分反应,放出x kJ热量。在该条件下,将1 mol CO2通入2 L 1.0 mol·L-1的NaOH溶液中充分反应,放出y kJ热量,则CO2与NaOH反应生成NaHCO3的热化学方程式为( B )
A.CO2(g)+NaOH(aq)===NaHCO3(aq)
ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)===NaHCO3(aq)
ΔH=-(4x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)===NaHCO3(aq)
ΔH=-(2x-y) kJ·mol-1
D.CO2(g)+NaOH(aq)===NaHCO3(aq)
ΔH=-(8x-2y) kJ·mol-1
[解析] 根据题意,将22 g CO2通入750 mL 1.0 mol·L-1的NaOH溶液中充分反应,n(CO2)==0.5 mol,n(NaOH)=1.0 mol·L-1×0.75 L=0.75 mol,反应产物为碳酸钠和碳酸氢钠,反应的化学方程式为2CO2+3NaOH===NaHCO3+Na2CO3+H2O,由0.5 mol CO2参加反应放出热量为x kJ知,2 mol CO2参加反应放出的热量为4x kJ,即热化学方程式为2CO2(g)+3NaOH(aq)===NaHCO3(aq)+Na2CO3(aq)+H2O(l) ΔH=-4x kJ·mol-1①,又将1 mol CO2通入2 L 1.0 mol·L-1 NaOH溶液中充分反应放出y kJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)===Na2CO3(aq)+H2O(l) ΔH=-y kJ·mol-1②,根据盖斯定律,由①-②可得NaOH(aq)+CO2(g)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1。
5.(2019·广东惠州调研)某同学设计如图装置,探究氯碱工业原理,下列说法正确的是( B )
A.石墨电极与直流电源的负极相连
B.铜电极的电极反应式为:
2H++2e-===H2↑
C.氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移
D.用湿润的淀粉KI试纸在铜电极附近检验气体,试纸变蓝色
[解析] 氯碱工业的反应原理为2NaCl+2H2O2NaOH+H2↑+Cl2↑,而Cu为活性电极,故应将Cu电极与电源的负极相连,石墨电极与电源的正极相连,A错误;Cu电极为阴极,电极反应式为2H++2e-===H2↑,B正确;电解池中,电解质溶液中的阳离子向阴极移动,则Na+向Cu电极迁移,在Cu电极上生成H2,C项错误;石墨电极上的反应为2Cl--2e-===Cl2↑,故用湿润的淀粉KI试纸在铜电极附近检验气体,试纸不变色,D错误。
6.(2019·辽宁大连模拟)某科研小组模拟“人工树叶”电化学装置如图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极。已知装置的电流效率等于生成产品所需的电子数与电路中通过总电子数之比。
下列说法不正确的是( C )
A.该装置中Y电极发生氧化反应
B.X电极的电极反应式为:
6CO2+24e-+24H+===C6H12O6+6H2O
C.理论上,每生成22.4 L O2必有4 mol H+由Y极区向X极区迁移
D.当电路中通过3 mol电子时生成18 g C6H12O6,则该装置的电流效率为80%
[解析] 根据装置图可知,Y电极与电源正极相连,Y电极为阳极,发生氧化反应,A项正确,X电极为阴极,发生还原反应,根据X电极上的反应物及产物可写出阴极的电极反应式,B项正确;22.4 L O2没有指明是在标准状况下,C项不正确;n(C6H12O6)==0.1 mol,生成0.1 mol葡萄糖消耗2.4 mol电子,故该装置的电流效率为×100%=80%,D项正确。
7.(2019·湖北七市调研)如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是( A )
A.反应一段时间后,乙装置中生成的氢氧化钠在铁电极区
B.乙装置中铁电极为阴极,电极反应式为Fe-2e-===Fe2+
C.通入氧气的一极为正极,发生的电极反应为O2-4e-+2H2O===4OH-
D.反应一段时间后,丙中硫酸铜溶液浓度保持不变
[解析] 甲装置为甲醚燃料电池,充入氧气的一极发生还原反应,为电极的正极,充入燃料的一极为电极的负极,C项错误;乙装置为电解饱和氯化钠溶液的装置,Fe电极为阴极,C极为阳极,阴极上生成H2,阴极区c(OH-)增大,Na+透过阳离子交换膜移向阴极区,A项正确,B项错误;丙装置为电解精炼铜的装置,精铜为阴极,粗铜为阳极,由于粗铜中的Zn、Fe杂质失电子,故c(CuSO4)减小,D项错误。
第Ⅱ卷(非选择题 共58分)
二、非选择题:本题包括4小题,共58分
8.(14分)(2019·山东滨州检测)过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1是1 mol NO2与1 mol CO恰好反应生成CO2和NO过程中的能量变化示意图。
(1)试写出NO2和CO反应的热化学方程式: NO2(g)+CO(g)===NO(g)+CO2(g) ΔH=-234 kJ·mol-1 ,该反应的活化能是__134___kJ·mol-1。
(2)在密闭容器中进行的上述反应是可逆反应,则其逆反应的热化学方程式为 NO(g)+CO2(g)===NO2(g)+CO(g) ΔH=+234 kJ·mol-1 ,该反应的活化能为__368___kJ·mol-1。
(3)图2是某同学模仿图1画出的NO(g)+CO2(g)===NO2(g)+CO(g)的能量变化示意图。则图中E3=__368___kJ·mol-1,E4=__234___kJ·mol-1。
[解析] (1)图中E1是正反应的活化能,即该反应的活化能为134 kJ·mol-1。正反应的活化能和逆反应的活化能之间的能量差即为反应热。
(2)可逆反应中逆反应的反应热与正反应的反应热的数值相等,符号相反。
(3)E3即该反应的活化能,与E2相等,E4是反应物与生成物的能量之差,即反应热。
9.(14分)(2019·重庆三峡名校联考)氢气的制取是氢能源利用领域的研究热点。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气发生反应:2H2O(g)2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时段产生O2的量见下表:
时间/min
20
40
60
80
n(O2)/mol
0.0010
0.0016
0.0020
0.0020
上述反应过程中能量转化形式为光能转化为__化学___能,达平衡过程中至少需要吸收光能__0.968___kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2 mol NH3,放出92.2 kJ热量。已知:
则1 mol N—H键断裂吸收的能量约等于__391_kJ___。
(3)已知:①2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1
②N2(g)+2O2(g)=2NO2(g)
ΔH=+67.7 kJ·mol-1
则H2还原NO2生成水蒸气和氮气的热化学方程式是
4H2(g)+2NO2(g)===N2(g)+4H2O(g)
ΔH=-1034.9 kg·mol-1 。
[解析] (1)题述反应过程中,能量转化形式为光能转化为化学能。达平衡时,生成氧气0.002 mol,至少需耍吸收的光能为0.002 mol×484 kJ·mol-1=0.968 kJ。
(2)3H2(g)+N2(g)2NH3(g),反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436 kJ·mol-1+945.8 kJ·mol-1-6×E(N-H)=-92.2 kJ·mol-1,E(N—H)=391 kJ·mol-1。
(3)反应4H2(g)+2NO2(g)===N2(g)+4H2O(g)可以由①×2-②得到,故ΔH=-(483.6 kJ·mol-1)×2-67.7 kJ·mol-1=-1034.9 kJ·mol-1。
10.(14分)(2019·山东日照教学质量联合检测)某实验小组同学利用如图装置对电化学原理进行了一系列探究活动。
(1)甲池为__原电池___(填“原电池”或“电解池”)装置。
(2)甲池反应前,两电极质量相等,一段时间后,两电极质量相差28 g,则导线中通过
__0.2___mol电子。
(3)实验过程中,甲池左侧烧杯中NO的浓度__变大___(填“变大”“变小”或“不变”)。
(4)其他条件不变,若用U形铜棒代替“盐桥”,工作一段时间后取出U形铜棒称量,质量__不变___(填“变大”“变小”或“不变”)。若乙池中的某盐溶液是足量AgNO3溶液,则乙池中左侧Pt电极的电极反应式为 4OH--4e-===O2↑+2H2O ,工作一段时间后,若要使乙池溶液恢复到原来的浓度,则可向溶液中加入__Ag2O或Ag2CO3___(填化学式)。
[解析] 本题考查电化学原理的应用,涉及简单计算、电极反应式的书写等,考查的化学核心素养是科学探究与创新意识、证据推理与模型认知。(1)由题图可知,甲池是一个把化学能转化为电能的装置,是原电池;乙池与原电池相连,是电解池。(2)甲池中的总反应为Cu+2Ag+===Cu2++2Ag,设两电极质量相差28 g时,导线中通过x mol电子,则有=,解得x=0.2。(3)实验过程中,Cu放电生成Cu2+,为了保持溶液为电中性,盐桥中的阴离子NO向左侧烧杯移动,所以左侧烧杯中NO浓度变大。(4)若用U形铜棒代替“盐桥”,则甲池右侧烧杯中U形铜棒的质量减小,而左侧烧杯中U形铜棒的质量增加,因各电极上转移的电子数相等,所以U形铜棒减小的质量与增加的质量相等,工作一段时间后取出U形铜棒称量,质量不变。若乙池中的某盐溶液是足量AgNO3溶液,因乙池中左侧Pt电极连接的是原电池的正极,所以为电解池的阳极,其电极反应式为4OH--4e-===O2↑+2H2O;两个电极均为Pt电极,该电解池的总反应为4AgNO3+2H2O4Ag+O2↑+4HNO3,若要使乙池溶液恢复到原来的浓度,则可向溶液中加入Ag2O或Ag2CO3。
11.(16分)(2019·河北衡水检测)某小组模拟化工生产设计多池串联装置,如图所示。
已知:①有种电池虽然也经历了氧化还原过程,但电池的总反应中并没有反映出这种变化,其净的作用仅仅是一种物质从高浓度状态向低浓度状态的转移,这一类电池被称为浓差电池。
②甲池左侧为100 mL的5 mol·L-1CuSO4溶液,右侧为100 mL的1 mol·L-1 CuSO4溶液。
③丁池盛装200 mL CuSO4溶液。
回答下列问题:
(1)甲池中,SO迁移方向是__从左侧向右侧迁移___,丙池中粗铜为__阳___(填“正”“负”“阴”或“阳”)极。
(2)乙池中,铁电极的电极反应式为 Ag++e-===Ag ,一段时间后,电解质溶液中c(Ag+)__不变___(填“增大”“减小”或“不变”)。
(3)一段时间后,丙池中纯铜电极质量变化量__不等于___(填“等于”或“不等于”)粗铜电极质量变化量,理由是__粗铜中较活泼的铁、锌等杂质先溶解___。
(4)当甲池停止放电时,丁池中两电极收集的气休体积恰好相等。写出丁池中石墨电极的电极反应式: 4OH--4e-===2H2O+O2↑ ,开始时c(CuSO4)=__0.5___ mol·L-1。
(5)若丙池中CuSO4溶液换成100 mL饱和食盐水,粗铜换成石墨。上述装置工作时氯化钠恰好完全电解。两电极收集的气体体积之和为__8.96___L(标准状况),若溶液体积变化忽略不计,温度恢复至常温,将电解后的溶液稀释至4 L,此时溶液的pH为__13___。
[解析] 根据浓差电池定义,甲池左侧CuSO4溶液浓度较大,为正极,Cu(1)电极上析出铜,右侧CuSO4溶液浓度较小,Cu(2)电极铜失去电子变为Cu2+,为负极,由此推知,乙池中铁为阴极,银为阳极;丙池中,纯铜为阴极,粗铜为阳极;丁池中,铂为阴极,石墨为阳极。(1)甲池中,Cu(1)电极的电极反应式为Cu2++2e-===Cu,Cu(2)电极的电极反应式为Cu-2e-===Cu2+,为了维持电荷平衡,SO向负极迁移。(2)乙池为电镀池,铁电极的电极反应式为Ag++e-===Ag,银电极的电极反应式为Ag-e-===Ag+,理论上电解质溶液浓度保持不变。(3)丙池为精炼铜装置,粗铜中含有较活泼铁、锌等杂质,铁、锌比铜先溶解,所以纯铜电极质量的增加量不等于粗铜电极质量的减少量。(4)当甲池停止放电时,甲池两侧电解质溶液浓度c(CuSO4)= mol·L-1=3 mol·L-1,正极电极反应式为Cu2++2e-===Cu,负极电极反应式为Cu-2e-===Cu2+,析出铜的物质的量n(Cu)=(5-3)mol·L-1×0.1 L=0.2 mol,转移电子的物质的量n(e-)=0.4 mol。丁池中,石墨为阳极,电极反应式为4OH--4e-===2H2O+O2↑,多池串联中,通过各电极上的电量相等,n(O2)=0.1 mol。阴极上收集的H2的物质的量n(H2)=0.1 mol,阴极上先发生反应Cu2++2e-===Cu,后发生反应2H++2e-===H2↑,硫酸铜溶液中n(CuSO4)=0.1 mol,则开始时c(CuSO4)=0.5 mol·L-1。(5)电解质溶液为饱和食盐水,阳极为石墨时相当于氯碱工业,阳极电极反应式为2Cl--2e-===Cl2↑,阴极电极反应式为2H++2e-===H2↑,电解反应为2NaCl+2H2O2NaOH+H2↑+Cl2↑,n(H2)+n(Cl2)=0.4 mol,V(H2)+V(Cl2)=0.4 mol×22.4 L·mol-1=8.96 L。n(NaOH)=0.4 mol,稀释后c(NaOH)=0.1 mol·L-1,c(H+)=1.0×10-13mol·L-1,pH=-lgc(H+)=13。