- 2021-05-24 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021 中考科学 精讲精练 专题36 元素的循环和物质的转化(学生版)
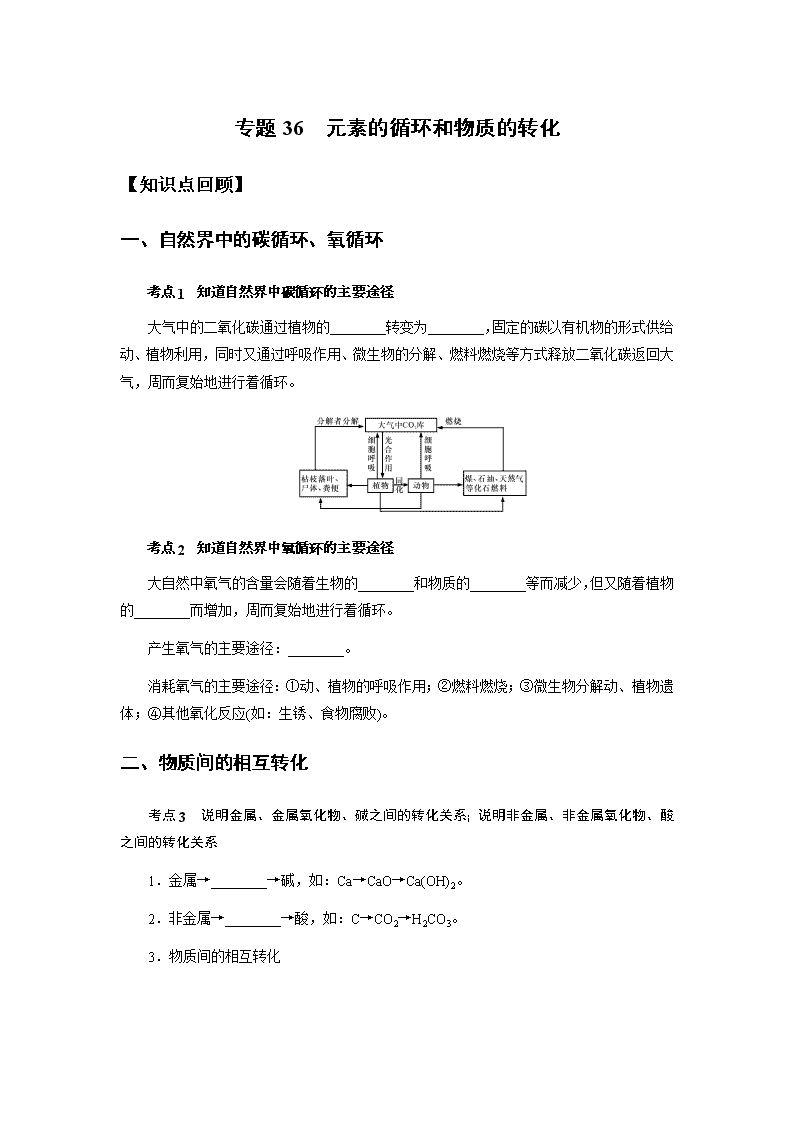
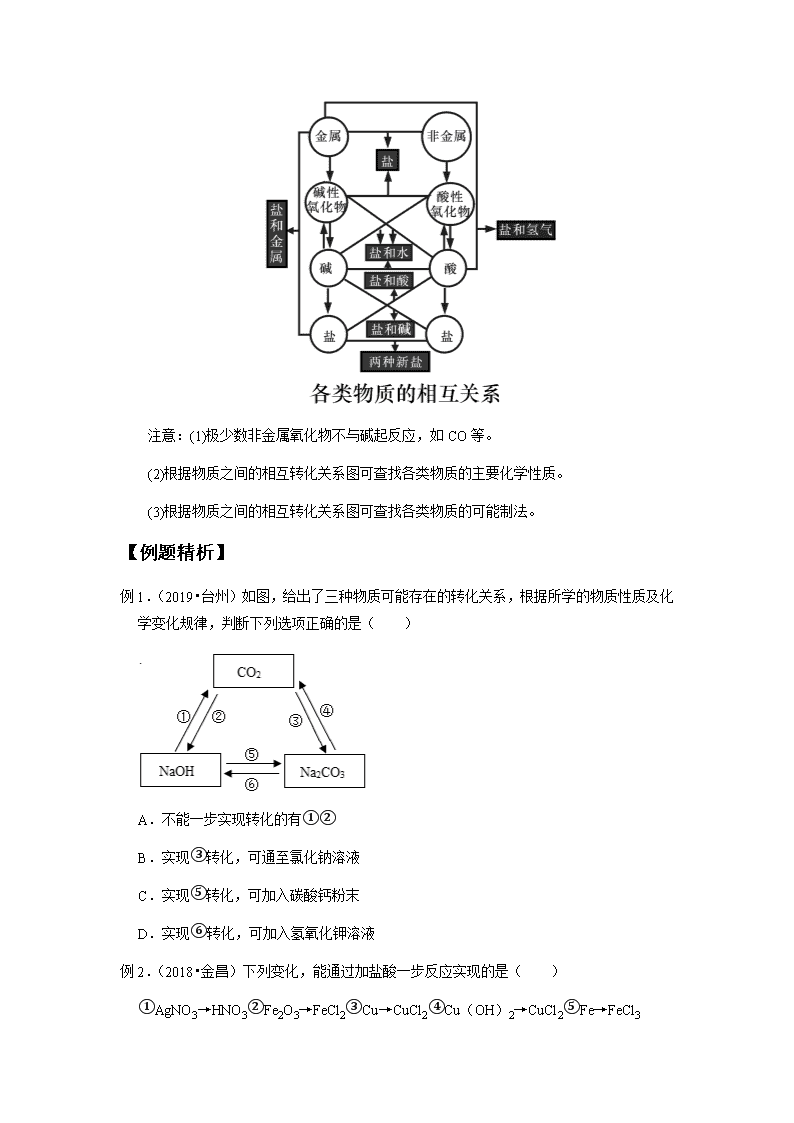
专题 36 元素的循环和物质的转化 【知识点回顾】 一、自然界中的碳循环、氧循环 考点 1 知道自然界中碳循环的主要途径 大气中的二氧化碳通过植物的________转变为________,固定的碳以有机物的形式供给 动、植物利用,同时又通过呼吸作用、微生物的分解、燃料燃烧等方式释放二氧化碳返回大 气,周而复始地进行着循环。 考点 2 知道自然界中氧循环的主要途径 大自然中氧气的含量会随着生物的________和物质的________等而减少,但又随着植物 的________而增加,周而复始地进行着循环。 产生氧气的主要途径:________。 消耗氧气的主要途径:①动、植物的呼吸作用;②燃料燃烧;③微生物分解动、植物遗 体;④其他氧化反应(如:生锈、食物腐败)。 二、物质间的相互转化 考点 3 说明金属、金属氧化物、碱之间的转化关系;说明非金属、非金属氧化物、酸 之间的转化关系 1.金属→________→碱,如:Ca→CaO→Ca(OH)2。 2.非金属→________→酸,如:C→CO2→H2CO3。 3.物质间的相互转化 注意:(1)极少数非金属氧化物不与碱起反应,如 CO 等。 (2)根据物质之间的相互转化关系图可查找各类物质的主要化学性质。 (3)根据物质之间的相互转化关系图可查找各类物质的可能制法。 【例题精析】 例 1.(2019•台州)如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化 学变化规律,判断下列选项正确的是( ) A.不能一步实现转化的有 ①②B.实现 ③ 转化,可通至氯化钠溶液 C.实现 ⑤ 转化,可加入碳酸钙粉末 D.实现 ⑥ 转化,可加入氢氧化钾溶液 例 2.(2018•金昌)下列变化,能通过加盐酸一步反应实现的是( ) ① AgNO3→HNO3 ② Fe2O3→FeCl2 ③ Cu→CuCl2 ④ Cu(OH)2→CuCl2 ⑤ Fe→FeCl3 A. ①② B. ②④ C. ①④ D. ③⑤例 3.(2018•杭州)如图为氢气还原氧化铜的实验装置图,下列有关分析正确的是( ) A.装置中试管口需略向下倾斜,主要是为了利于通入氢气 B.在给试管内药品加热前,需先通氢气排尽试管内的空气 C.待药品完全反应后,需同时撤去酒精灯和通氢气的导管 D.该实验装置也可直接用于一氧化碳还原氧化铜的实验 例 4.(2018•台州)电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主要成分是 SiO2)为原料制取,其中一步反应为:SiO2+2C 高温 � Si+2CO↑.对该反应分析正确的是 ( ) A.该反应属于置换反应 B.碳发生了还原反应 C.碳元素化合价由 0 价变为+4 价 D.该反应利用了 CO 的还原性 例 5.(2018•台州)下列选项所示的物质转化均能一步实现的是( ) A.Fe→�� Fe2O3 →���Fe(OH)3 B.CuO →�����CuSO4 → 稀 ���CuCl2 C.S→�� SO2 →���H2SO4 D.CO2 →�橨��Na2CO3 →�橨�����NaOH 例 6.(2020•宁波)铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补血剂。某硫酸厂 产生的炉渣中除了有Fe2O3、FeO,还有一定量的SiO2.兴趣小组利用炉渣尝试制备FeCO3, 其 流 程 如 图 : 【已知:Fe+Fe2(SO4)3═3FeSO4;SiO2 不溶于水,也不与稀硫酸反应】 (1)操作 ① 的名称是 。 (2)溶液 A 中的溶质除 H2SO4 外,还存在 。 (3)上述流程中生成固体 c 的化学方程式 。 例 7.(2020•杭州)医用消毒酒精为 75%的乙醇溶液,化工生产中可用 A(主要成分的化学 式为 C8H18)作原料,经以下流程制取乙醇: (1)步骤 ① 的转化属于 (选填“化或“物理”)变化。 (2)步骤 ② 是乙烯和含两种元素的化合物 B 发生化合反应,则 B 中所含元素是 。 例 8.(2020•金华)“飞花令”是中国诗词的一种接龙游戏。科学兴趣小组模仿“飞花令” 游戏规则,进行物质间转化的接龙比赛,其比赛规则是:从同一物质开始进行转化,接 龙物质不能重复且必须含有指定元素,以转化路径长且正确者为比赛胜者。某两场比赛 的过程记录如下(“→”表示某一种物质经一步反应可转化为另一种物质)。 (1)指定元素:氢元素 起始物质:HCl 比赛胜者:乙同学 甲同学:HCl→H2O 乙同学:HCl→H2O→□ 乙同学在方框中应填物质的化学式是 (写一种即可)。 (2)指定元素:钡元素 起始物质:BaO 比赛胜者:丁同学 丙同学:BaO→Ba(OH)2→BaSO4 下列能使丁同学获胜的方案有 (填字母)。 A.BaO→BaSO4→Ba(OH)2→BaCO3 B.BaO→BaCl2→Ba(NO3)2→BaSO4 C.BaO→Ba(OH)2→BaCO3→BaCl2→Ba(NO3)2→BaSO4 D.BaO→BaCl2→BaCO3→Ba(NO3)2→Ba(OH)2→BaSO4 例 9.(2020•衢州)如图所示,是小科建构的铜及其化合物之间相互转化的关系图。 (1)写出图中“?”处物质的化学式 。 (2)要一步实现图中“Cu→Cu2+”的转化,可将铜加入适量的某种盐溶液中,则该溶液 的溶质是 。 (3)根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。请设计一个实验方 案,要求写出主要操 作步骤及所需要的试剂 。 例 10.(2020•杭州)一种制备氢氧化镁的生产流程如图所示,MgCl2 和 NaOH 按恰好完全 反 应 的 比 例 加 料 。 (1)写出步骤 c 中发生反应的化学方程式: 。 (2)x= 。 (3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是 。 (4)如图流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是 。 ① 盐酸 ② 氯化钙 ③ 氨水 ④ 硫酸镁 li11.(2020•湖州)一水硫酸四氨合铜的化学式为[Cu(NH3)4]SO4•H2O,是一种高效、安 全的杀菌剂。它在乙醇﹣﹣水混合溶剂中的溶解度随乙醇体积分数的变化曲线如图甲所 示。小明在实验室以氧化铜为主要原料合成该物质,他设计的合成路线如图乙所示: (1)溶液 A 中一定存在的溶质为 。 (2)溶液 B 中含硫酸四氨合铜,“一系列操作”是指向溶液 B 中加入适量 、过 滤、洗涤、干燥等。 例 12.(2019•衢州)某 KCl 固体样品中含有少量 CaCl2 杂质,实验室提纯氯化钾的流程如 图。(氯化钾溶解度受温度影响较小) (1)沉淀 a 是 。 (2)操作Ⅰ是 。 ① 冷却热饱和溶液 ② 蒸发结晶 (3)若 KCl 固体样品中还含有少量杂质 K2SO4,小科认为提纯该样品只要在上述方案基 础上增加一步实验:在“加入过量 K2CO3 溶液”与“过滤”操作之间,加过量的硝酸钡 溶液。小江认为这种方案不合理,会导致所得 KCl 固体中含有新的杂质,新杂质 是 。 【习题巩固】 一.选择题(共 10 小题) 1.“五水共治”大大美化了河道环境,某学校实验室排出的废水中含有 Ag+、Ba2+和 NO3 ﹣ 三种离子,该校实验小组设计实验从该废水中回收银,并得到副产品碳酸钡固体,操作 步 骤 和 实 验 结 果 如 图 : 已知滤液 B 中只含有一种溶质,则下列说法不正确的是( ) A.蓝色沉淀是 Cu(OH)2 B.乙一定是氢氧化钡 C.若丙是 K2CO3,滤液 C 结晶后可以作为化学肥料 D.若得到 19.7g 碳酸钡,则证明原废水中含有 13.7g 钡 2.下列各组所示的化学变化中,不可能实现的是( ) A.Cu → 加硫酸钠溶液 E → 加烧碱溶液 F→� CuO B.Fe2(SO4)3 → 加氯化钡溶液 滤液 X → 加烧碱溶液 沉淀 Y → 加硫酸 Fe2(SO4)3 C.CuO → 通氢气 �R → 加硝酸银溶液 滤液 J → 加烧碱溶液 Cu(OH)2 D.BaCO3 → 加盐酸 M → 加硝酸银溶液 滤液 Q → 加碳酸钠溶液 BaCO3 3.火柴头原本是一种不被磁铁吸引的物体,但火柴烧过后,却能被磁铁吸引,原因是很多 火柴头用氧化铁着色,点燃后会与木棒中的碳反应产生四氧化三铁和二氧化碳,由此作 出的推断不合理的是( ) A.Fe3O4 与 Fe2O3 磁性不同,体现他们物理性质不同 B.Fe3O4 中铁的质量分数大于 Fe2O3 C.火柴头燃烧的方程式为 C+O2+6Fe2O3 点燃 � 4Fe3O4+CO2 D.火柴头不被磁铁吸引的是因为不易被磁化 4.甲乙丙有如图所示的转化关系(“→”表示反应一步实现,部分反应物和反应条件略去), 下列各组物质按照甲乙丙的顺序不符合要求的是( ) A.C、CO2、CO B.H2O2、O2、H2O C.CuO、Cu、Cu(NO3)2 D.NaOH、NaCl、NaNO3 5.下列表中各组物质不能按照图中关系(“→”表示反应一步完成)转化的是( ) 物质 选项 A B C D X Na2SO4 BaCl2 Cu CaO Y NaCl Ba(NO3)2 CuO CaCl2 Z NaNO3 BaCO3 CuSO4 CaCO3 6.三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列符合要求的组合是 ( ) A. ①② B. ①③ C. ②③ D. ①②③7.下列物质的转化能实现的是( ) A.H2SO4→HCl B.CO→Na2CO3 C.Cu(OH)2→NaOH D.NaNO3→Ba(NO3)2 8.小科总结了三幅无机物之间的相互转化关系图。图中的每个转化在一定条件下均能一步 实现的是( ) A. ①② B. ① C. ②③ D. ①②③9.如下无机物转化关系图中,每个转化在一定条件下均能按箭头方向一步实现的是( ) A.只有 ①② B.只有 ①③ C.只有 ②③ D. ①②③ 都是 10.如图是以“铁氧化物”为催化剂,利用太阳能将 CO2 资源化利用的方法之一,在此转 化过程中包含化学反应 ① 和 ② ,则下列说法正确的是( ) A. ① 中 Fe(1﹣y)O 体现出氧化性,做氧化剂 B. ② 中的能量转化为:化学能转化为太阳能 C.此转化过程总的化学方程式为:CO2 铁氧化物 �太阳能 C+O2 D.做催化剂的“铁氧化物”是 Fe3O4 二.填空题(共 4 小题) 11.用某工业废弃固体(成分为 Cu2S 和 FeS2)制备硫酸铜溶液和硫酸亚铁晶体的流程如图 所示。(已知: ① 固体 B 含有氧化铜、氧化铁, ② 铁能与硫酸铁反应,生成硫酸亚铁)。 (1)操作Ⅱ的名称是 。 (2)固体 D 中含有 (用化学式表示)。 (3)加入过量 x 的作用是 。 (4)写出固体 D 中加入过量 y 时发生反应的化学方程式 。 12.2020 年奥运会奖牌制作原料来自于电子垃圾中提炼出来的金属。从废线路板中提炼贵 重金属和制备硫酸铜晶体的一种工艺流程如图: 已知:在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。 (1)操作 ① 的名称是 ; (2)调节 pH 的主要目的是除去滤液中 (填离子符号); (3)写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式: 。 13.Ba(NO3)2 可用于生产信号弹、炸药等。利用钡泥(主要含有 BaCO3、BaSO3、Fe2O3) 可制取 Ba(NO3)2,其部分流程如图: (1)写出 Fe2O3 与稀 HNO3 反应的化学方程式: 。 (2)试剂 Y 为 。 14.小乐用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4•7H2O)相关信息如下: ① 金属离子形成氢氧化物沉淀的相关 pH 范围 金属离子 pH 开始沉淀 完全沉淀 Fe3+ 1.5 2.8 Fe2+ 5.5 8.3 Zn2+ 5.4 8.2 ② ZnSO4 的溶解度随温度变化曲线。 (1)步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是 。 (2)步骤Ⅱ,需加入过量 H2O2,理由是 。 (3)步骤Ⅲ,合适的 pH 范围是 。 三.实验探究题(共 4 小题) 15.二氧化氯 ClO2 是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体, 易溶于水。实验室可用 NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备 ClO2,其流程如 图: (1)写出电解时发生反应的化学方程式: 。 (2)除去 ClO2 中的 NH3 可选用的试剂是 (填序号)。 A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水 (3)测定 ClO2(如图 2)的过程如下:在锥形瓶中加入足量的碘化钾,用 100mL 水溶 解后,再加 3mL 硫酸溶液;在玻璃液封管中加入水;将生成的 ClO2 气体通过导管在锥 形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液用 c mol•L﹣ 1Na2S2O3 标准溶液滴定(I2+2Na2S2O3═2NaI+Na2S4O6),共用去 VmL Na2S2O3 溶液。 ④ 装置中玻璃液封管的作用是吸收残余的二氧化氯气体,并使 。 ② 请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式: 。 ③ 滴定终点的现象是 。 ④ 测得通入的 ClO2 质量 。 16.氢氧化铜化学性质不稳定,易在空气中分解成水和氧化铜,另外氢氧化铜还易与二氧化 碳和水蒸气发生化合反应,生成碱式碳酸铜(Cu2(OH)2CO3),为此实验室经常需要新 制氢氧化铜。小科同学在实验室用氧化铜、稀硫酸和氢氧化钠溶液制备氢氧化铜。 【查阅资料】不溶性碱受热易分解:Cu(OH)2 �� CuO+H2O;Cu2(OH)2CO3 为不溶于 水的绿色固体。 【实验原理】CuO+H2SO4═CuSO4+H2O,CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 【实验及现象】 实验步骤 实验现象 ① 取少量氧化铜放于试管中,加入一定量的 , 并用酒精灯对试管进行加热。 试管中黑色全部溶解,得到蓝色溶 液。 ② 向试管中加入氢氧化钠溶液。 有蓝色沉淀但一会儿部分蓝色沉淀 变成黑色 【实验分析】小科的实验最终没有得到蓝色的氢氧化铜,却意外得到了黑色固体。 【实验反思】(1)实验中得到黑色固体是 (写化学式)为了新制氢氧化铜,小科 又设计了实验步骤 ② 的方案: 方案一:在步骤 ① 结束后,趁热加入氢氧化钠溶液。 方案二:在步骤 ① 结束后,等试管冷却后加入氢氧化钠溶液。请从两个方案中选出合理 的方案,并说明理由 。 (2)小科同学改进实验方案后,当往试管中滴加氢氧化钠溶液的步骤中,产生蓝色沉淀 与滴加氢氧化钠溶液的体积关系如图所示。 由此可以判断步骤 ① 结束后,试管中含有的溶质是 。对于“没有立即产生沉淀”, 小科又开始新的实验改进方案…… 17.Fe(OH)2 是白色难溶于水的物质,可用于制颜料、药物等,但很容易被空气中的氧气 氧化为 Fe(OH)3,氧化过程中白色沉淀转化为灰绿色沉淀,最后变为红褐色沉淀。现 用铁片、稀盐酸、氢氧化钠溶液、水等试剂制取少量的 Fe(OH)2,装置如图。 (1)检查气密性。关闭阀门 A 和 B,让 1 中液体进入到容器 2 中。虚线框所在装置,发 生的反应的化学方程式是 。 (2)容器 2 中充满氢气后,打开阀门 A,关闭阀门 B,应出现的现象是 。 (3)实验完毕,关闭阀门 A 和 B,制得的 Fe(OH)2 在容器 (选填“3”或“4”) 中。 (4)本实验中所有配制溶液的水需煮沸,容器 2、3 均密闭,其主要原因是 。 18.黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质.处理黄铜渣可得到 硫酸锌,其主要流程如下(杂质不溶于水、不参与反应): 已知:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O (1)Ⅱ中反应的化学方程式为 、 ; (2)下列说法正确的是 . a.Ⅰ、Ⅱ中的操作均包含过滤 b.溶液 A 中 ZnSO4 的质量大于 CuSO4 c.溶液 A 的质量小于溶液 B d.溶液 C 中溶质的质量分数小于溶液 B. 四.解答题(共 2 小题) 19.氢氧化镁是一种重要的化工原料,某矿石由 MgO、Fe2O3、CuO 和 SiO2 组成,用它制 备氢氧化镁的流程示意图如图。 (1)溶液 A 中所含的阳离子有 (填离子符号)。 (2)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的 pH 见表: 沉淀物 Fe(OH)3 Cu(OH)2 Mg(OH)2 开始沉淀 1.9 4.2 9.1 完全沉淀 3.2 6.7 11.1 步骤二中加入熟石灰,调节溶液的 pH 范围为 7﹣9,其目的是为了防止沉淀 C 中出 现 。 (3)3 个步骤中均用到的操作是 。 (4)步骤三中生成产品的化学方程式为 。 20.以镁矿石(主要成分为 MgCO3 和 SiO2,其中 SiO2 难溶于水和常见的酸)为原料生产 MgO 的工艺流程如图,回答问题: (1)“沉镁”时 MgSO4 与 NH3•H2O 发生复分解反应。写出该反应的化学方程式 。 (2)对过滤 II 所得沉淀进行洗涤,判断沉淀已洗涤干净的方法是 。查看更多