- 2021-05-24 发布 |
- 37.5 KB |
- 67页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解1弱电解质的电离平衡课件鲁科版选择性必修1
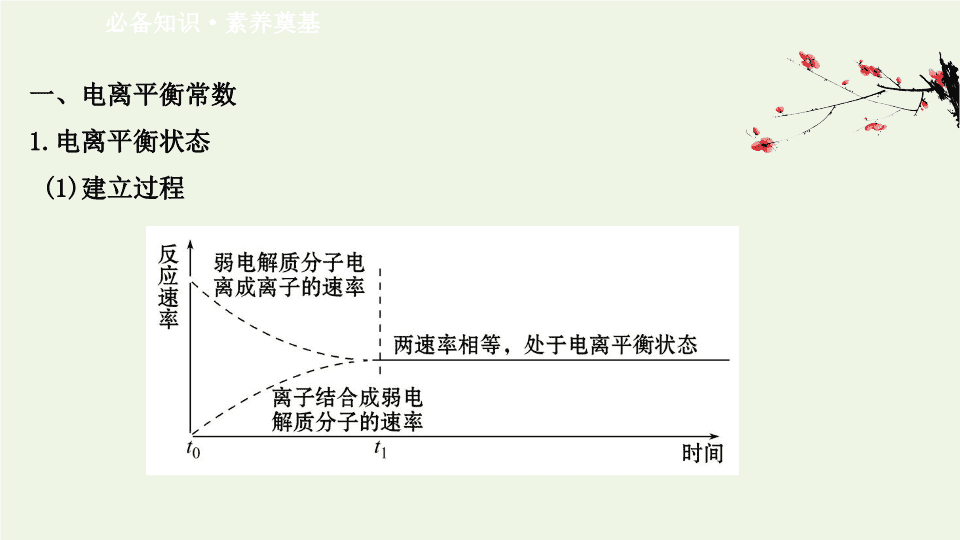
第 2 节 弱电解质的电离 盐类的水解 第 1 课时 弱电解质的电离平衡 一、电离平衡常数 1. 电离平衡状态 (1) 建立过程 必备知识 · 素养奠基 (2) 电离平衡 : 弱电解质的电离平衡指在一定条件下 ( 温度、浓度 ), 弱电解质分子电离成离子的速率和离子结合成分子的速率相等时的状态。电离平衡是化学平衡的一种 , 同样具有化学平衡的特征 , 条件改变时平衡移动的规律符合勒 · 夏特列原理。 (3) 特点 : 电离平衡是动态平衡 , 弱电解质分子电离成离子过程和离子结合成弱电解质分子过程仍在进行且速率相等。 【 微思考 】 如何判断一个弱电解质在水溶液中达到了电离平衡状态 ? 提示 : 一是电离的速率和离子结合成分子的速率相等 ; 二是各种离子和分子的浓度保持不变。 2. 电离平衡常数 (1) 概念 在一定条件下达到 _________ 时 , 弱电解质电离形成的各种 _____ 的浓度 _____ 与溶液中未电离的 _____ 的浓度之比。电离平衡常数简称电离常数。 (2) 影响因素 电离常数服从化学平衡常数的一般规律 , 它只与 _____ 有关 , 由于电离过程是 _____ 过程 , 升温 ,K 值 _____ 。 电离平衡 离子 乘积 分子 温度 吸热 增大 (3) 应用 电离常数表征了弱电解质的 _________, 根据相同温度下电离常数的大小可以判 断弱电解质电离能力的 _________,K 越大 , 表示弱电解质的电离程度 _____, 弱酸 的酸性或弱碱的碱性相对 _____ 。 电离能力 相对强弱 越大 越强 (4) 表达式 ①弱酸在水中的电离常数通常用 K a 表示。例如 CH 3 COOH H + +CH 3 COO - , K a =____________________ 。 多元弱酸的电离是 _____ 进行的 , 每一步电离都有各自的电离常数 , 如 H 2 CO 3 电离 : H 2 CO 3 +H + K a1 =________________ +H + K a2 =______________ 且 K a1 __K a2 。 分步 > ② 弱碱在水中的电离常数通常用 K b 表示 , 例如 NH 3 ·H 2 O +OH - , K b =________________ 。 【 情境 · 思考 】 硼酸 (H 3 BO 3 ) 是一种重要的化工原料 , 广泛应用 于玻璃、医药、肥料等工艺。硼酸是一种白 色粉末状结晶 , 有滑腻的手感 , 没有臭味 , 是一 种外用杀菌剂、消毒剂和防腐剂。对多种细 菌 , 霉菌都有抑制作用。可用于皮肤、粘膜、伤口、口腔、阴道、膀胱等冲洗 消毒 , 也可用于耳炎 , 烧伤 , 烫伤 , 湿疹等。在临床上常常用于止血和防腐 , 如果 不慎食用了 , 就会出现恶心、呕吐、腹痛、腹泻等胃肠道症状。 已知 ,H 3 BO 3 的解离反应为 H 3 BO 3 +H 2 O H + + ,K a =5.81×10 -10 , 据此回 答 : (1) 判断 H 3 BO 3 是什么酸 ? 提示 : 由硼酸的解离反应式知 , 硼酸在水溶液中只能电离出一个 H + , 且不能完全解 离 , 所以硼酸为一元弱酸。 (2) 写出 H 3 BO 3 的电离平衡常数的表达式。 提示 : K a = 3. 电离度 (1) 概念 : 弱电解质在水中的电离达到平衡状态时 ,___________________ 占原有 溶质分子数 ( 包括已电离的和未电离的 ) 的百分率。 (2) 表达式 :α= ________________×100% 。 已电离的溶质分子数 【 微思考 】 对于同一种弱电解质来说 , 电离度越大 , 电离平衡常数就越大吗 ? 提示 : 不一定。电离平衡常数只与温度有关 , 电离度与物质的浓度、温度等有关 , 所以二者没有直接的必然联系。 二、影响电离平衡的因素 1. 弱电解质电离程度的大小是由电解质 ___________ 决定的。 2. 外界条件对弱电解质的电离平衡的影响 : 因素 影响结果 温度 升高温度 , 电离平衡 _____ 移动 浓度 加水稀释 , 电离平衡 _____ 移动 外加 物质 加入与弱电解质电离出的离子相同的离子 , 电离平衡 _____ 移 动 ( 同离子效应 ) 加入与弱电解质电离出的离子反应的离子 , 电离平衡 _____ 移动 正向 正向 逆向 正向 本身的性质 【 巧判断 】 (1) 相同温度下 ,0.3 mol·L -1 的醋酸溶液与 0.1 mol·L -1 的醋酸溶液的电离度相等。 ( ) 提示 : × 。随着溶液浓度的增加 , 弱电解质的电离平衡正向移动 , 所以二者的电离度不一样。 (2) 在醋酸溶液中加入 NaOH 溶液 , 可以使其电离平衡正向移动。 ( ) 提示 : √ 。在醋酸溶液中加入 NaOH 溶液 , 可以中和氢离子 , 导致氢离子的浓度减小 , 使醋酸的电离平衡正向移动。 关键能力 · 素养形成 知识点一 弱电解质电离平衡的特点及影响因素 【 重点释疑 】 1. 弱电解质的电离平衡 弱电解质部分电离 , 书写电离方程式时 , 用“ ”。 类型 实例 一元弱酸 HF H + +F - 一元弱碱 NH 3 ·H 2 O +OH - 多元弱酸 分步电离 , 分步写出 :H 2 CO 3 H + + H + + 多元弱碱 分步电离 , 一步写出 :Cu(OH) 2 Cu 2+ +2OH - 2. 影响因素 (1) 内因 弱电解质本身的性质 , 如相同条件下 CH 3 COOH 电离程度大于 H 2 CO 3 。 (2) 外因 以 CH 3 COOH CH 3 COO - +H + ΔH>0 为例 : 影响因素 移 动 方 向 n(H + ) c 平 (H + ) c 平 (CH 3 COO - ) K a pH 导 电 能 力 升温 ( 不考虑 挥发 ) 右 增 大 增 大 增大 增 大 减 小 增 强 加冰醋酸 右 增 大 增 大 增大 不 变 减 小 增 强 影响因素 移动 方向 n(H + ) c 平 (H + ) c 平 (CH 3 COO - ) K a pH 导电 能力 加 入 其 他 物 质 CH 3 COONa 固体 左 减小 减小 增大 不 变 增 大 增 强 通入 HCl 气体 左 增大 增大 减小 不 变 减 小 增 强 NaOH 固体 右 减小 减小 增大 不 变 增 大 增 强 加水稀释 右 增大 减小 减小 不 变 增 大 减 弱 【 思考 · 讨论 】 (1) 增大弱电解质的浓度时 , 其平衡移动的方向和电离度以及电离平衡常数如何变化 ? 提示 : 增大弱电解质溶液的浓度时 , 虽然平衡正向移动 , 但电离程度减小 , 电离度减小 , 电离常数不变。 (2) 在 0.1 mol·L -1 的 CH 3 COOH 溶液中 , 要促进醋酸电离且使 H + 浓度增大 , 应采取的措施有哪些 ? 提示 : 醋酸的电离是吸热过程 , 升高温度能促进醋酸的电离 , 且 H + 浓度增大。 【 拓展深化 】 弱酸或弱碱电离平衡移动中离子浓度的变化 (1) 弱酸或弱碱的电离平衡向右移动 , 其电离程度不一定增大 , 电解质分子的浓度不一定减小 , 离子的浓度不一定增大。 (2) 弱酸或弱碱加水稀释时 , 溶液中不一定所有离子浓度都减小。如稀醋酸加水稀释时 ,c 平 (OH - ) 增大 , 其他离子浓度均减小。 (3) 对于浓的弱电解质溶液 , 如冰醋酸加水稀释的过程弱电解质的电离程度逐渐增大 , 但离子浓度先增大后减小。 (4) 分析弱电解质微粒浓度变化时 , 要注意平衡移动时相关量的变化程度与溶液体积变化程度的相对大小。 【 案例示范 】 【 典例 】 (2020· 双鸭山高二检测 ) 室温下向 10 mL 0.1 mol·L -1 的醋酸溶液中 加水稀释后 , 下列说法正确的是 ( ) A. 溶液中导电离子的数目减小 B. 溶液中 不变 C. 醋酸的电离程度增大 ,c 平 (H + ) 也增大 D. 醋酸的电离常数 K 随醋酸浓度减小而减小 【 解题指南 】 解答本题时要注意以下两点 : (1) 弱电解质电离平衡的影响因素。 (2) 电离平衡常数的表达方式以及影响因素。 【 解析 】 选 B 。加水稀释 , 醋酸的电离平衡正向移动 , 溶液中离子数目增多 , 因 此溶液中导电离子的数目增多 ,A 错误 ; 表示醋酸的电离平 衡常数 , 温度不变 , 则常数不变 ,B 正确 ; 加水稀释 , 醋酸的电离平衡正向移动 , 醋 酸的电离程度增大 , 溶液酸性减弱 , 所以 c 平 (H + ) 减小 ,C 错误 ; 醋酸的电离常数 K 只与温度有关系 , 温度不变 , 常数不变 ,D 错误。 【 母题追问 】 (1)A 项改为溶液中导电离子的浓度都减小 , 对吗 ? 提示 : 不对。加水稀释 ,c 平 (H + ) 减小 ,K w 不变 ,c 平 (OH - ) 增大。 (2)10 mL 0.1 mol·L -1 的醋酸溶液升高温度 , 溶液中 不变 , 对吗 ? 提示 : 不对。升温电离程度增大 , 电离常数 K 增大。 【 迁移 · 应用 】 1.(2020· 苏州高二检测 )0.1 mol·L -1 CH 3 COOH 溶液中存在电离平衡 :CH 3 COOH CH 3 COO - +H + , 加水稀释或加入少量 CH 3 COONa 晶体时 , 都会引起 ( ) A. 溶液的 pH 增大 B.CH 3 COOH 电离程度变大 C. 溶液的导电能力减弱 D. 溶液中 c 平 (OH - ) 减小 【 解析 】 选 A 。 CH 3 COOH 溶液中存在平衡 CH 3 COOH CH 3 COO - +H + 。当加入水时 , 溶液中 CH 3 COOH 、 CH 3 COO - 、 H + 的浓度都减小 ,c 平 (OH - ) 变大 , 溶液的 pH 增大。因为 溶液变稀 , 所以 CH 3 COOH 电离程度变大。当加入 CH 3 COONa 晶体时 , 发生 CH 3 COONa ==== CH 3 COO - +Na + , 使得溶液中 c 平 (CH 3 COO - ) 变大 , 平衡 CH 3 COOH CH 3 COO - +H + 左移 ,CH 3 COOH 电离程度变小 ,c 平 (H + ) 减小 , 由于加入了 Na + , 导电能力增强。 2.(2020· 武昌高二检测 ) 可促进 HClO 的电离 , 并使 pH 增大的是 ( ) ① 加入 HCl ②加入 NaClO ③加入 NaOH ④加入 Zn A.①②③④ B.②③④ C.③④ D.②④ 【 解析 】 选 C 。向 HClO H + +ClO - 平衡体系中加 HCl,c 平 (H + ) 增大 , 使 pH 减小 ; 加 NaClO,c 平 (ClO - ) 增大 , 使平衡左移 ; 加 NaOH, 消耗 H + , 使平衡右移 ,pH 增大 ; 加 Zn,Zn 与 H + 反应生成 H 2 , 使平衡右移 ,pH 增大。 知识点二 弱电解质的判断方法以及一元强酸、一元弱酸的比较 【 重点释疑 】 1. 弱电解质的判断方法 (1) 在相同浓度、相同温度下 , 与强电解质做导电性对比实验 , 导电性弱的为弱电解质。 (2) 浓度与 pH 的关系。如 0.1 mol·L -1 CH 3 COOH 溶液 , 其 pH>1, 则可证明 CH 3 COOH 是弱电解质。 (3) 稀释前后的 pH 与稀释倍数的关系。例如 , 将 pH=2 的酸溶液稀释至原体积的 1 000 倍 , 若 pH 小于 5, 则证明该酸为弱酸 ; 若 pH 为 5, 则证明该酸为强酸。 (4) 利用实验证明存在电离平衡。如醋酸溶液中滴入紫色石蕊溶液变红 , 再加 CH 3 COONa 固体 , 颜色变浅 , 证明 CH 3 COOH 是弱电解质。 (5) 在相同浓度、相同温度下 , 比较与金属反应的速率的快慢。如将锌粒投入等浓度的盐酸和醋酸溶液中 , 起始速率前者比后者快。 2. 一元强酸与一元弱酸的比较 (1) 相同物质的量浓度、相同体积时。 c 平 (H + ) pH 中和碱 的能力 与足量金属反 应产生 H 2 的量 与金属反应 开始时速率 一元 强酸 大 小 相同 相同 大 一元 弱酸 小 大 小 (2) 相同 pH 、相同体积时。 c 平 (H + ) c 平 ( 酸 ) 中和碱 的能力 与足量金属 反应产生 H 2 的量 与金属反应 开始时的速率 一元 强酸 相同 小 小 少 相同 一元 弱酸 大 大 多 【 思考 · 讨论 】 若 1 mol·L -1 的某酸溶液的 c 平 (H + ) 约为 0.01 mol·L -1 , 可以证明该酸是弱酸吗 ? 为什么 ? 提示 : 可以。如果某酸为强酸 , 将完全电离 , 则在 1 mol·L -1 溶液中 c 平 (H + )= 1 mol·L -1 , 而题目中的 c 平 (H + ) 约为 0.01 mol·L -1 远小于 1 mol·L -1 , 说明该酸只部分电离 , 是弱电解质。 【 案例示范 】 【 典例 】 用实验确定某酸 HA 是弱电解质 , 两同学的方案如下 : 甲 :① 称取一定质量的 HA 配制 0.1 mol·L -1 的溶液 100 mL;② 用 pH 试纸测出该溶液的 pH, 即可证明 HA 是弱电解质。 乙 :① 用已知物质的量浓度的 HA 溶液、盐酸 , 分别配制 pH=1 的两种酸溶液各 100 mL;② 分别取这两种溶液各 10 mL, 加水稀释为 100 mL;③ 各取相同体积的两种稀释液装入两个试管 , 同时加入纯度和质量相同的锌粒 , 观察现象 , 即可证明 HA 是弱电解质。 【 思考交流 】 (1) 甲方案中说明 HA 是弱电解质的理由是测得溶液的 pH 与 1 的关系是什么 ? (2) 乙方案中说明 HA 是弱电解质的现象是什么 ? (3) 请你评价 : 乙方案中难以实现之处和不妥之处。 (4) 请你提出一个合理而比较容易进行的方案 ( 药品可任取 ), 作简明扼要表述。 【 解析 】 (1) 弱电解质存在电离平衡 , 不能完全电离。所以如果 HA 是弱电解质 , 则 0.1 mol · L -1 溶液的 pH 就一定大于 1 。 (2) 弱酸在稀释过程中会继续电离出阴阳离子 , 因此稀释相同的倍数后 ,HA 溶液中氢离子的浓度大于盐酸中氢离子的浓度 , 所以装 HA 溶液的试管中放出 H 2 的速率快。 (3) 弱酸在稀释过程中会继续电离出氢离子 , 所以配制 pH=1 的 HA 溶液难以实现 ; 又因为固体的表面积也影响反应速率 , 因此不妥之处在于加入的锌粒表面积难以做到相同。 (4) 如果 HA 是弱酸 , 则相应的 NaA 就会水解 , 溶液显碱性。所以配制 NaA 溶液 , 测其 pH>7, 即证明 HA 是弱电解质。 答案 : (1) 大于 1 。 (2) 装 HA 溶液的试管中放出 H 2 的速率快。 (3) 配制 pH=1 的 HA 溶液难以实现 , 加入的锌粒表面积难以做到相同。 (4) 配制 NaA 溶液 , 测其 pH 大于 7, 证明 HA 是弱电解质。 【 迁移 · 应用 】 1.(2020· 青岛高二检测 ) 室温下对 pH 相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施 , 有关叙述正确的是 ( ) A. 加适量的醋酸钠晶体后 , 两溶液的 c 平 (H + ) 都变小 B. 使温度都升高 20 ℃, 两溶液的 c 平 (H + ) 都不变 C. 加水稀释 2 倍后 , 两溶液的 c 平 (H + ) 都变大 D. 加足量的锌粉反应后 , 两溶液产生的氢气一样多 【 解析 】 选 A 。 CH 3 COOH 溶液中存在 CH 3 COOH CH 3 COO - +H + 的电离平衡 , 当加 入醋酸钠晶体后 , 上述电离平衡向左移动 ,CH 3 COOH 溶液中 c 平 (H + ) 变小 ; 向盐酸中 加入醋酸钠晶体后 , 会发生反应 CH 3 COO - +H + CH 3 COOH, 使盐酸中 c 平 (H + ) 变小 ; 温度升高 , 使 CH 3 COOH CH 3 COO - +H + 的电离平衡向右移动 ,c 平 (H + ) 变大 ; 加水 稀释时 , 两溶液的 c 平 (H + ) 都变小 ;c 平 (H + ) 相同、体积相同的醋酸溶液和盐酸 , 其 溶质的物质的量并不相等 , 所以 , 分别与足量的锌粉反应 , 醋酸产生的氢气多。 2. 能证明乙酸是弱酸的实验事实是 ( ) A.CH 3 COOH 溶液与 Zn 反应放出 H 2 B.0.01 mol·L -1 CH 3 COOH 溶液的 pH 大于 2 C.CH 3 COOH 溶液与 Na 2 CO 3 反应生成 CO 2 D.0.1 mol·L -1 CH 3 COOH 溶液可使紫色石蕊变红 【 解析 】 选 B 。 CH 3 COOH 溶液与 Zn 反应放出 H 2 只能证明乙酸是酸 , 不能证明是弱酸 ,A 错误 ; 0.01mol·L -1 CH 3 COOH 溶液的 pH 大于 2, 证明 CH 3 COOH 部分电离 , 从而可以证明乙酸是弱酸 ,B 正确 ;CH 3 COOH 溶液与 Na 2 CO 3 反应生成 CO 2 只能证明乙酸的酸性比碳酸强 , 不能证明乙酸是弱酸 ,C 错误 ;0.1 mol·L -1 CH 3 COOH 溶液可使紫色石蕊变红只能证明乙酸是酸 , 不能证明乙酸是弱酸 ,D 错误。 知识点三 电离平衡常数与电离度 【 重点释疑 】 1. 电离平衡常数的应用 (1) 比较弱酸的酸性强弱。 相同条件下 ,K 值越大 , 电离程度越大 , 酸性越强。 如 :25 ℃ 时部分弱酸的电离常数如下表 : 则酸性由强到弱的顺序为 CH 3 COOH>H 2 CO 3 >HClO> 化学式 CH 3 COOH H 2 CO 3 HClO 电离平衡常数 /(mol·L -1 ) 1.7×10 -5 K a1 =4.2×10 -7 K a2 =5.6×10 -11 4.7×10 -8 (2) 判断反应能否进行。 先依据电离常数 K 判断出酸的相对强弱 , 再利用相对强的酸制取相对弱的酸的 反应原理 , 判断反应能否进行以及反应产物。 如 : 利用 (1) 中表格中的电离常数可判断出 H 2 CO 3 、 HClO 、 的酸性强弱顺序 为 H 2 CO 3 >HClO> 。 因此 , 向 Na 2 CO 3 溶液中加入次氯酸 , 会生成 NaHCO 3 和 NaClO, 而不会生成 H 2 CO 3 。 (3) 比较溶液稀释时粒子浓度比值的变化。 弱酸 ( 如 HA) 溶液中 , 存在的粒子有 :H + 、 OH - 、 A - 、 HA 。加水稀释时 c 平 (H + ) 、 c 平 (A - ) 、 c 平 (HA) 减小 ,c 平 (OH - ) 增大 , 但 的变化可借助电离常 数进行比较 , 即 , 加水稀释 ,K a 不变 ,c 平 (A - ) 减小 , 则 增大。 2. 电离平衡常数 (K) 、电离度 (α) 与 c(H + ) 的关系 依照化学平衡计算中“列三行” ( 或“列两行” ) 的方法 , 通过起始浓度、消耗浓 度、平衡浓度 , 结合 K a (K b ) 、 α( 电离度 ) 等条件便可以轻松地进行电离平衡的有关 计算。以一元弱酸为例 , 酸的起始浓度为 c, HA H + + A - 起始 : c 0 0 变化 : cα cα cα 平衡 : c-cα≈c cα cα 则 c 平 (H + )=cα K a = 即 c 平 (H + )= α 与 K a 的关系为 α= 。同样 , 对于一元弱碱来说 ,c 平 (OH - )=cα= 。 【 思考 · 讨论 】 (1) 同一多元弱酸的 K a1 、 K a2 、 K a3 之间存在着数量上的规律 , 此规律是什么 ? 产生此规律的原因是什么 ? 提示 : 同一弱酸 ,K a1 ≫ K a2 ≫ K a3 。由于上一级电离产生大量的 H + , 会对下一级的电离产生抑制 , 所以电离程度越来越小 , 电离平衡常数越来越小。 (2) 在相同温度下 , 弱电解质的电离常数越大 , 则某溶液中的离子浓度越大吗 ? 提示 : 不是。弱电解质的电离常数越大 , 只能说明其分子电离程度越大。离子的浓度不仅与电离程度有关 , 还与弱电解质的浓度有关。 【 案例示范 】 【 典例 】 (2020· 三明高二检测 ) 常温时 ,0.1 mol·L -1 HF 溶液的 pH=2, 则 K a 的数值大约是 ( ) A.2 mol·L -1 B.0.1 mol·L -1 C.0.01 mol·L -1 D.0.001 mol·L -1 【 思维建模 】 解答本类试题的思维流程如下 : 【 解析 】 选 D 。由 HF H + +F - 可知 K(HF)= 0.001 mol·L -1 。 【 迁移 · 应用 】 1. 已知室温时 ,0.1 mol·L -1 某一元酸 HA 在水中的电离度 α=0.1%, 下列叙述错误的是 ( ) A. 该溶液的 pH=4 B. 升高温度 , 溶液的 pH 增大 C. 此酸的电离常数约为 1×10 -7 mol·L -1 D. 由 HA 电离出的 c 平 (H + ) 约为水电离出的 c 平 (H + ) 的 10 6 倍 【 解析 】 选 B 。 c 平 (H + )=0.1%×0.1 mol · L -1 =10 -4 mol · L -1 ,pH=4; 因 HA 在水中 有电离平衡 , 升高温度促进平衡向电离的方向移动 ,c 平 (H + ) 将增大 ,pH 会减小 ; C 选项可由电离常数表达式算出 K a = ≈1×10 -7 mol · L -1 ;c 平 (H + )= 10 -4 mol · L -1 , 所以水电离出的 c 平 (H + )=10 -10 mol · L -1 , 前者是后者的 10 6 倍。 2.(2020· 镇江高二检测 ) 已知 7.2×10 -4 mol·L -1 、 4.6×10 -4 mol·L -1 、 4.9× 10 -10 mol·L -1 分别是三种酸的电离平衡常数的值。若这三种酸可发生如下反应 : ①NaCN+HNO 2 ==== HCN+NaNO 2 ②NaCN+HF ==== HCN+NaF ③NaNO 2 +HF ==== HNO 2 +NaF 则下列叙述中不正确的是 ( ) A.HF 的电离平衡常数为 7.2×10 -4 mol·L -1 B.HNO 2 的电离平衡常数为 4.9×10 -10 mol·L -1 C. 根据①③两个反应即可知三种酸的相对强弱 D.HNO 2 的电离平衡常数比 HCN 的大 , 比 HF 的小 【 解析 】 选 B 。根据强酸制弱酸的原理 , 题给三个反应中 , 第①个反应说明酸性 HNO 2 >HCN, 第③个反应说明酸性 HF>HNO 2 , 故 HF 、 HNO 2 、 HCN 的酸性依次减弱。相同条件下 , 酸的酸性越强 , 电离平衡常数越大 , 据此可以将三个电离平衡常数与酸对应起来。 【 补偿训练 】 (2020· 承德高二检测 )25 ℃ 时 , 几种弱酸的电离平衡常数如表所示 , 下列说法正确的是 ( ) 化学式 HCOOH H 2 CO 3 HCN 电离平 衡常数 / (mol·L -1 ) K= 1.8×10 -4 K a1 =4.2×10 -7 K a2 =5.6×10 -11 K=6.2 ×10 -10 A.H 2 CO 3 溶液和 NaCN 溶液反应的离子方程式为 H 2 CO 3 +CN - ==== +HCN B.HCOOH 的电离平衡常数表达式为 K= C.Na 2 CO 3 溶液与足量 HCOOH 溶液反应的离子方程式为 +HCOOH ==== +HCOO - D. 酸性强弱顺序是 HCOOH>HCN>H 2 CO 3 【 解析 】 选 A 。酸的电离平衡常数越大 , 酸的酸性越强 , 强酸能和弱酸盐反应生 成弱酸 , 由电离平衡常数知 , 酸性 H 2 CO 3 >HCN> , 则 H 2 CO 3 +NaCN ==== NaHCO 3 +HCN, 离子方程式为 H 2 CO 3 +CN - ==== +HCN,A 正确 ; HCOOH 的电离平衡常数表达式为 K= ,B 错误 , 根据电离平衡常数数值可知酸性 HCOOH>H 2 CO 3 > , 则 Na 2 CO 3 溶液与足量 HCOOH 溶液反应的离子方程式为 +2HCOOH ==== 2HCOO - +H 2 O+CO 2 ↑,C 错误 ; 酸的电离平衡常数越大其酸性越强 , 根据电离 平衡常数知 , 这几种酸酸性强弱关系是 HCOOH>H 2 CO 3 >HCN,D 错误。 【 素养提升 】 下表是几种常见弱酸的电离平衡常数 (25 ℃) 酸 电离方程式 电离平衡常数 K a /mol·L -1 CH 3 COOH CH 3 COOH CH 3 COO - +H + 1.7×10 -5 H 2 CO 3 H 2 CO 3 H + + H + + K a1 =4.2×10 -7 K a2 =5.6×10 -11 H 3 PO 4 H 3 PO 4 H + + H + + H + + K a1 =7.1×10 -3 K a2 =6.2×10 -8 K a3 =4.5×10 -13 【 思考交流 】 (1)CH 3 COOH 、 H 2 CO 3 、 H 3 PO 4 的酸性强弱如何排序 ? 提示 : H 3 PO 4 >CH 3 COOH>H 2 CO 3 。 (2)“CH 3 COONa+H 2 CO 3 ==== NaHCO 3 +CH 3 COOH” 该反应能否发生 ? 说明理由。 提示 : 不能发生。 K(CH 3 COOH)>K a1 (H 2 CO 3 ), 则酸性 :CH 3 COOH>H 2 CO 3 , 据“强酸制弱 酸”的规律可知题给反应不能发生。 (3)25 ℃ 时 , 相同浓度的 CH 3 COOH 溶液 ,H 2 CO 3 溶液 ,H 3 PO 4 溶液的电离度大小关系 是怎样的 ? 提示 : α(H 3 PO 4 )>α(CH 3 COOH)>α(H 2 CO 3 ) 。 (4) 若把 CH 3 COOH 、 H 2 CO 3 、 、 H 3 PO 4 、 、 都看作是酸 , 其中酸 性最强的是什么 ? 最弱的是什么 ? 提示 : 酸性最强的是 K a 值最大的 , 即 H 3 PO 4 , 酸性最弱的是 K a 值最小的 , 即 。 【 课堂回眸 】 课堂检测 · 素养达标 1.(2020· 泰安高二检测 ) 在下列的各种叙述中 , 正确的是 ( ) A. 任何酸都有电离平衡常数 B. 任何条件下 , 酸的电离平衡常数都不变 C. 多元弱酸各步电离平衡常数相互关系为 K a1查看更多