- 2021-05-24 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省江阴市璜塘、马镇、月城、峭岐中学2019届九年级下学期第一次调研化学试题
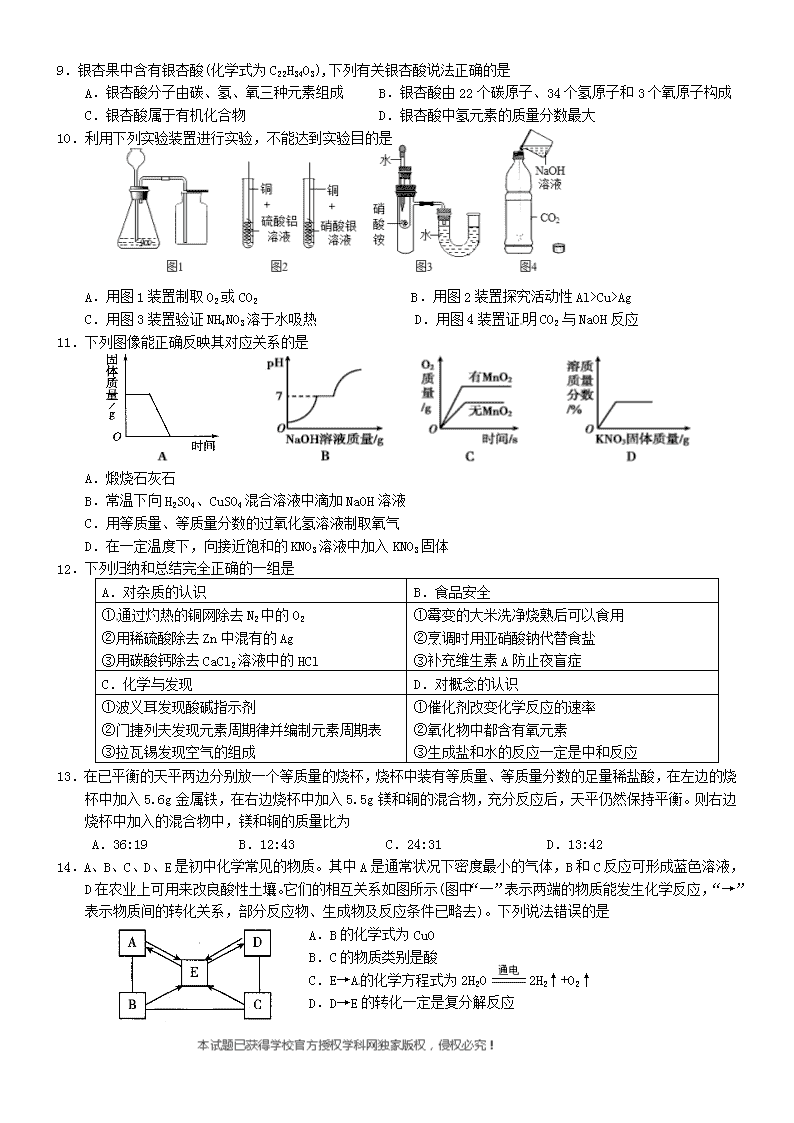
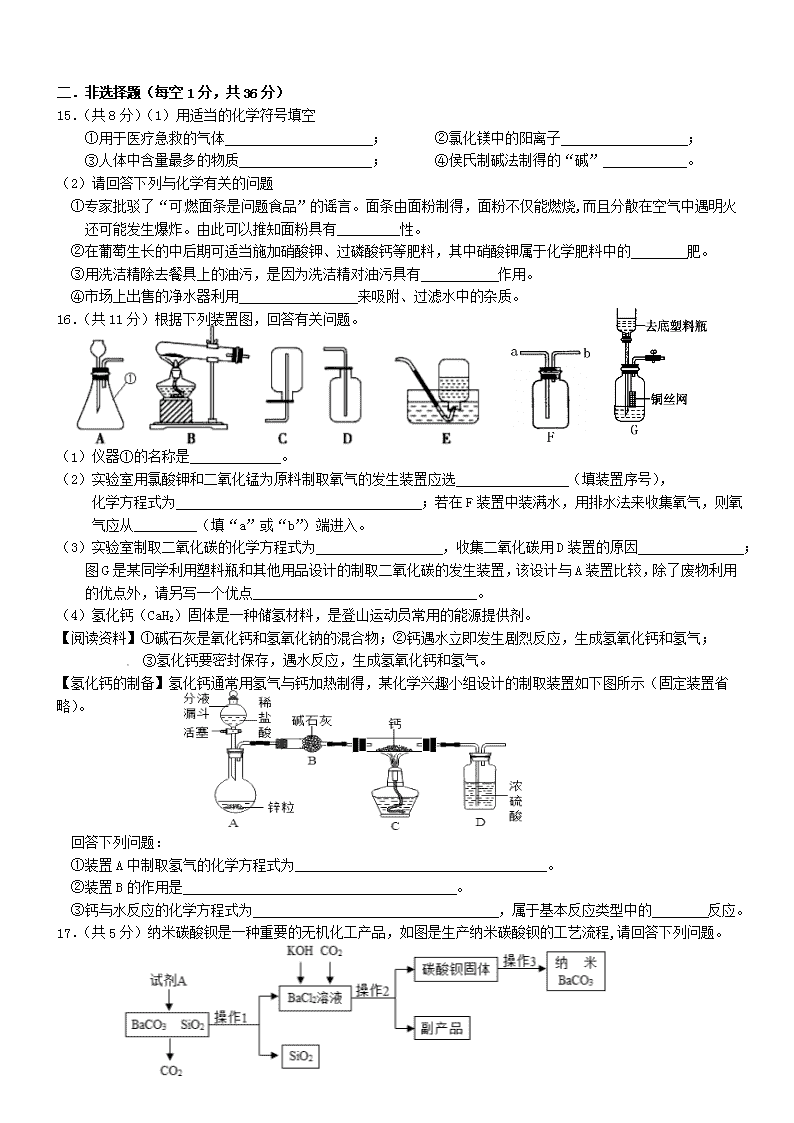
初三年级化学学科阶段性检测(一) 一.选择题(每小题只有一个选项符合题意,每题1分,共14分) 1.“绿水青山就是金山银山”,下列做法不符合环保倡议的是 A.使用一次性木筷 B.合理使用农药和化肥 C.自带购物篮购物 D.开发新能源汽车 2.下列标志属于中国节能标志的是 A. B. C. D. 3.下列实验现象,描述错误的是 A.铁丝在氧气中剧烈燃烧,火星四射 B.向氯化钡溶液中滴加稀硫酸,产生白色沉淀 C.将二氧化碳通入紫色石蕊溶液中,溶液变成蓝色 D.灼烧羊毛,产生烧焦羽毛的特殊气味 4.下列物质的用途仅与其物理性质有关的是 A.用金刚石切割玻璃 B.用小苏打治疗胃酸过多 C.用生石灰作干燥剂 D.用压缩天然气作燃料 5.下列操作正确的是 A.过滤 B.稀释浓硫酸 C.闻气味 D.倾倒液体 6.如图所示,甲是溴(Br)的原子结构示意图,乙摘自元素周期表。下列说法正确的是 A.甲元素属于金属元素 B.甲、乙两种元素形成化合物的化学式是NaBr C.乙原子的核内中子数为11 D.甲原子核外共有5个电子层 7.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是 A.参加反应的甲和乙质量比为2:7 B.丙可能是该反应的催化剂 C.X的值是7 [来源:学科网] D.丁一定是化合物 8.如图是甲、乙、两三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是 A.甲和丙的溶解度相等 B.在t2℃时,将28g甲物质加入到50g水中,充分溶解后所得溶液的质量为78g C.将t2℃时,甲的溶液降温到t1℃,一定有晶体析出 D.将t1℃时,甲、乙、丙三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是乙>甲>丙 9.银杏果中含有银杏酸(化学式为C22H34O3),下列有关银杏酸说法正确的是 A.银杏酸分子由碳、氢、氧三种元素组成 B.银杏酸由22个碳原子、34个氢原子和3个氧原子构成 C.银杏酸属于有机化合物 D.银杏酸中氢元素的质量分数最大 10.利用下列实验装置进行实验,不能达到实验目的是 A.用图1装置制取O2或CO2 B.用图2装置探究活动性Al>Cu>Ag[来源:学#科#网] C.用图3装置验证NH4NO3溶于水吸热 D.用图4装置证明CO2与NaOH反应 11.下列图像能正确反映其对应关系的是 A.煅烧石灰石 B.常温下向H2SO4、CuSO4混合溶液中滴加NaOH溶液 C.用等质量、等质量分数的过氧化氢溶液制取氧气 D.在一定温度下,向接近饱和的KNO3溶液中加入KNO3固体 12.下列归纳和总结完全正确的一组是 A.对杂质的认识 B.食品安全 ①通过灼热的铜网除去N2中的O2 ②用稀硫酸除去Zn中混有的Ag ③用碳酸钙除去CaCl2溶液中的HCl ①霉变的大米洗净烧熟后可以食用 ②烹调时用亚硝酸钠代替食盐 ③补充维生素A防止夜盲症 C.化学与发现 D.对概念的认识 ①波义耳发现酸碱指示剂 ②门捷列夫发现元素周期律并编制元素周期表 ③拉瓦锡发现空气的组成 ①催化剂改变化学反应的速率 ②氧化物中都含有氧元素 ③生成盐和水的反应一定是中和反应 13.在已平衡的天平两边分别放一个等质量的烧杯,烧杯中装有等质量、等质量分数的足量稀盐酸,在左边的烧杯中加入5.6g金属铁,在右边烧杯中加入5.5g镁和铜的混合物,充分反应后,天平仍然保持平衡。则右边烧杯中加入的混合物中,镁和铜的质量比为 A.36:19 B.12:43 C.24:31 D.13:42 14.A、B、C、D、E是初中化学常见的物质。其中A是通常状况下密度最小的气体,B和C反应可形成蓝色溶液,D在农业上可用来改良酸性土壤。它们的相互关系如图所示(图中“一”表示两端的物质能发生化学反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件已略去)。下列说法错误的是 A.B的化学式为CuO B.C的物质类别是酸 C.E→A的化学方程式为2H2O 2H2↑+O2↑ D.D→E的转化一定是复分解反应 [来源:Zxxk.Com] 二.非选择题(每空1分,共36分) 15.(共8分)(1)用适当的化学符号填空 [来源:学科网ZXXK] ①用于医疗急救的气体 ; ②氯化镁中的阳离子 ; ③人体中含量最多的物质 ; ④侯氏制碱法制得的“碱” 。 (2)请回答下列与化学有关的问题 ①专家批驳了“可燃面条是问题食品”的谣言。面条由面粉制得,面粉不仅能燃烧,而且分散在空气中遇明火还可能发生爆炸。由此可以推知面粉具有_________性。 ②在葡萄生长的中后期可适当施加硝酸钾、过磷酸钙等肥料,其中硝酸钾属于化学肥料中的 肥。 ③用洗洁精除去餐具上的油污,是因为洗洁精对油污具有 作用。 ④市场上出售的净水器利用 来吸附、过滤水中的杂质。 16.(共11分)根据下列装置图,回答有关问题。 (1)仪器①的名称是 。 (2)实验室用氯酸钾和二氧化锰为原料制取氧气的发生装置应选 (填装置序号), 化学方程式为 ;若在F装置中装满水,用排水法来收集氧气,则氧气应从 (填“a”或“b”)端进入。 (3)实验室制取二氧化碳的化学方程式为 ,收集二氧化碳用D装置的原因 ; 图G是某同学利用塑料瓶和其他用品设计的制取二氧化碳的发生装置,该设计与A装置比较,除了废物利用的优点外,请另写一个优点 。 (4)氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。 【阅读资料】①碱石灰是氧化钙和氢氧化钠的混合物;②钙遇水立即发生剧烈反应,生成氢氧化钙和氢气; ③氢化钙要密封保存,遇水反应,生成氢氧化钙和氢气。 【氢化钙的制备】氢化钙通常用氢气与钙加热制得,某化学兴趣小组设计的制取装置如下图所示(固定装置省略)。 [来源:学*科*网Z*X*X*K] 回答下列问题: ①装置A中制取氢气的化学方程式为 。 ②装置B的作用是 。 ③钙与水反应的化学方程式为 ,属于基本反应类型中的 反应。 17.(共5分)纳米碳酸钡是一种重要的无机化工产品,如图是生产纳米碳酸钡的工艺流程,请回答下列问题。 (1)操作1的名称为 ;试写出试剂A与BaCO3反应的化学方程式 。 (2)操作2得到的副产品主要是 (填化学式)。 (3)上述流程中可循环利用的物质是 。 (4)资料:二氧化硅难溶于水,但可以和氢氧化钠、氢氟酸等物质反应。某同学根据资料重新设计方案提纯碳酸钡:取碳酸钡和二氧化硅混合物,滴加足量的 (从下列选项中选择)过滤、洗涤、烘干得碳酸钡固体。 A.蒸馏水 B.氢氧化钠溶液 C.氢氟酸溶液 18.(共12分)铜、铁是人类使用最早、应用广泛的金属。 【探究一】 (1)铁生锈主要跟空气中的 有关,用稀硫酸除铁锈的化学方程式为 。 (2)小茜同学发现自己的铜制眼镜框表面出现了绿色物质,通过化学学习知道该物质为铜锈,俗称“铜绿”,主 要成分为Cu2(OH)2CO3,该反应的化学方程式为:2Cu+O2+H2O+X ===== Cu2(OH)2CO3,则X的化学式为 。 【探究二】 以黄铜矿(CuFeS2)为原料,采用生物炼铜是现代炼铜的新工艺,原理为: 4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+2H2O, 向上述反应后的溶液中加入Fe粉,得到FeSO4溶液和Cu。 (3)CuFeS2为二硫化亚铁铜,也可以表示为CuS•FeS,其中S元素的化合价为 。 (4)发生主要反应的两个化学方程式为:①Fe+Fe2(SO4)3=3FeSO4; ② 。 (5)FeSO4溶液经蒸发浓缩、 、过滤等操作得到硫酸亚铁晶体(FeSO4•xH2O)。 【探究三】 硫酸亚铁晶体(FeSO4•xH2O)是一种重要的食品和饲料添加剂,对其进行热分解研究。 【查阅资料】①硫酸铜粉末为白色,吸水后变成蓝色晶体。 ②二氧化硫能使高锰酸钾溶液褪色 ③硫酸亚铁晶体加热会先失去结晶水,高温会继续分解产生一种金属氧化物和两种非金属氧化物。 称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B的质量测出x的值。 (6)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有 ,装置C中高锰酸钾溶液褪色,说明产物中还有______ ;装置D球形干燥管的作用______ ;实验中要持续通入氮气,否则测出的x会_____ (填“偏大”、“偏小”或“不变”)。 (7)硫酸亚铁晶体完全分解后,装置A中残留红棕色固体,另从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式____ 。 (8)某研究所利用热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成 固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x=______。 初三年级化学学科阶段性检测(一)答案 一.选择题(每小题只有一个选项符合题意,每题1分,共14分) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 A D C A C B A D C D B C B D 二.非选择题(每空1分,共36分) 15.(共8分)(1)① O2 ;② Mg2+ ;③ H2O ;④ Na2CO3 。 (2)① 可燃 ;② 复合 ;③ 乳化 ;④ 活性炭 。 MnO2 △ 16.(共11分)(1) 锥形瓶 。 (2) B , 2KClO3=======2KCl+3O2↑ ; b 。 (3) CaCO3+2HCl ======= CaCl2+ H2O+ CO2↑ , 二氧化碳密度比空气大 ; 控制反应的发生与停止 。 (4)① Zn+2HCl ======= ZnCl2+ H2↑。② 吸收水蒸气和氯化氢气体 。 ③ Ca+2H2O===Ca(OH)2+2H2↑, 置换 。 17.(共5分)(1) 过滤 ; BaCO3+2HCl=== BaCl2+H2O+CO2↑ 。 (2)_ KCl _。 (3)___ CO2 。 (4)__B 。 18.(共12分)【探究一】(1) 水和氧气 , Fe2O3+ 3H2SO4==△== Fe2(SO4)3+3H2O 。(2)CO2 【探究二】(3) -2 (4) Fe+CuSO4=== CuSO4+ Fe _ 。(5) 降温结晶 (或冷却结晶) 。 【探究三】(6) 水 , ____二氧化硫 ;____防止氢氧化钠溶液倒吸 ; __偏小 。 (7)____ 2FeSO4=△= Fe2O3+SO2↑+SO3↑ 。 (8)____7 。查看更多