2018届二轮复习四大平衡常数及应用教案(全国通用)
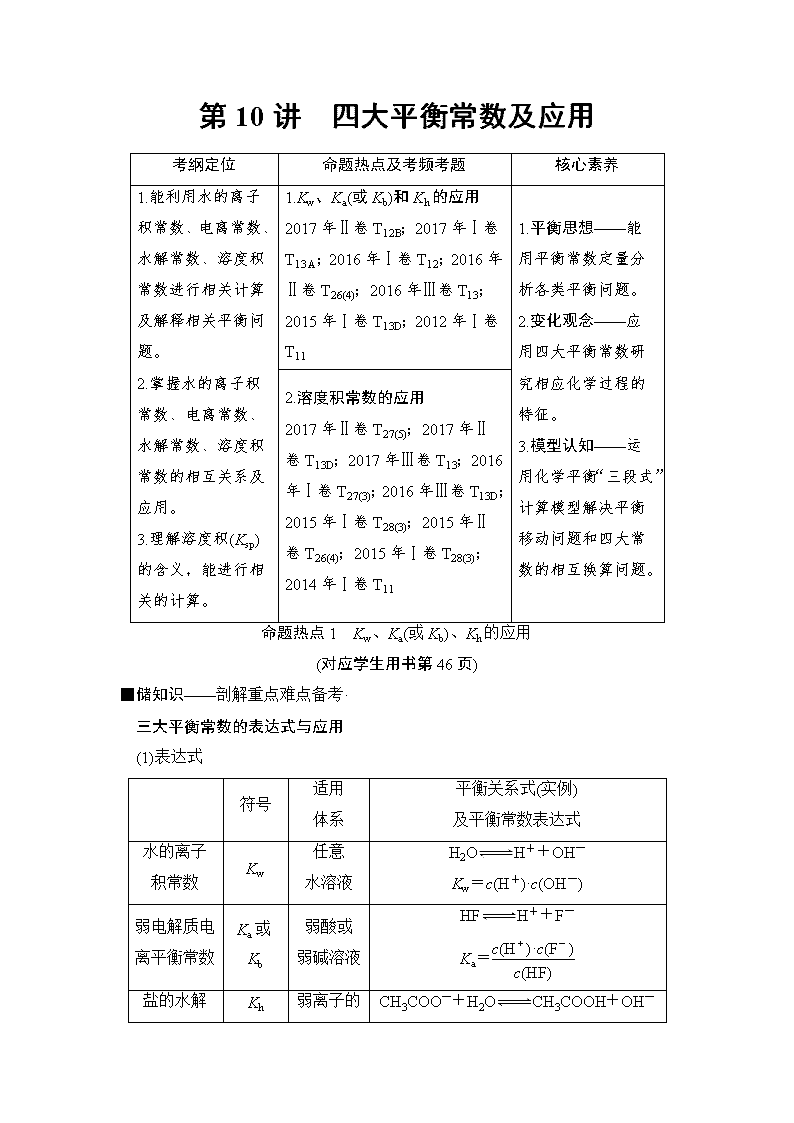
第10讲 四大平衡常数及应用
考纲定位
命题热点及考频考题
核心素养
1.能利用水的离子积常数、电离常数、水解常数、溶度积常数进行相关计算及解释相关平衡问题。
2.掌握水的离子积常数、电离常数、水解常数、溶度积常数的相互关系及应用。
3.理解溶度积(Ksp)的含义,能进行相关的计算。
1.Kw、Ka(或Kb)和Kh的应用
2017年Ⅱ卷T12B;2017年Ⅰ卷T13 A;2016年Ⅰ卷T12;2016年Ⅱ卷T26(4);2016年Ⅲ卷T13;2015年Ⅰ卷T13D;2012年Ⅰ卷T11
1.平衡思想——能用平衡常数定量分析各类平衡问题。
2.变化观念——应用四大平衡常数研究相应化学过程的特征。
3.模型认知——运用化学平衡“三段式”计算模型解决平衡移动问题和四大常数的相互换算问题。
2.溶度积常数的应用
2017年Ⅱ卷T27(5);2017年Ⅱ卷T13D;2017年Ⅲ卷T13;2016年Ⅰ卷T27(3);2016年Ⅲ卷T13D;2015年Ⅰ卷T28(3);2015年Ⅱ卷T26(4);2015年Ⅰ卷T28(3);2014年Ⅰ卷T11
命题热点1 Kw、Ka(或Kb)、Kh的应用
(对应学生用书第46页)
■储知识——剖解重点难点备考·
三大平衡常数的表达式与应用
(1)表达式
符号
适用
体系
平衡关系式(实例)
及平衡常数表达式
水的离子
积常数
Kw
任意
水溶液
H2OH++OH-
Kw=c(H+)·c(OH-)
弱电解质电
离平衡常数
Ka或Kb
弱酸或
弱碱溶液
HFH++F-
Ka=
盐的水解
Kh
弱离子的
CH3COO-+H2OCH3COOH+OH-
平衡常数
盐溶液
Kh=
(2)相关规律
①Qc与K的关系。
二者表达式相同,若Qc
K,平衡逆向移动。
②平衡常数都只与温度有关,温度不变,平衡常数不变。升高温度,Ka、Kb、Kw、Kh均增大。
③Ka、Kh、Kw三者的关系式为Kh=;Kb、Kh、Kw三者的关系式为Kh=。
[失分预警]
“四大常数”使用常见错误
(1)Ka、Kh、Kw数值不随其离子浓度的变化而变化,只与温度有关,Ka、Kh、Kw随着温度的升高而增大。在温度一定时,平衡常数不变,与化学平衡是否移动无关。
(2)Kw常误认为是水电离的c(H+)与c(OH-)的乘积。
(3)只有常温下水的离子积常数Kw=1.0×10-14。
■对点练——沿着高考方向训练·
1.升高温度,下列数据不一定增大的是( )
A.化学反应速率v
B.水的离子积常数Kw
C.化学平衡常数K
D.弱酸的电离平衡常数Ka
C [升高温度,活化分子的百分数增大,有效碰撞的次数增多,则反应速率加快;水的电离吸热,升高温度促进电离,水的离子积常数Kw增大;若化学反应为放热反应,则升高温度,平衡逆向移动,K减小;弱酸的电离吸热,升高温度促进电离,弱酸的电离平衡常数Ka增大。]
2.常温下,某酸HA的电离常数K=1×10-5。下列说法中正确的是( )
【导学号:97184125】
A.HA溶液中加入NaA固体后,减小
B.常温下,0.1 mol/L HA溶液中水电离出的c(H+)为10-13 mol/L
C.NaA溶液中加入盐酸至恰好完全反应,存在关系:2c(Na+)=c(A-)
+c(Cl-)
D.常温下,0.1 mol/L NaA溶液的水解常数为10-9
D [HA溶液中加入NaA固体后抑制HA的电离,===Kh==10-9,故比值不变,A错误、D正确;常温下,0.1 mol/L的HA溶液中氢离子浓度约为(0.1×10-5)1/2 mol/L=0.001 mol/L,则水电离出的c(H+)为10-11 mol/L,B错误;NaA溶液中加入盐酸至恰好完全反应,根据物料守恒:2c(Na+)=c(A-)+c(HA)+c(Cl-),C错误。]
3.(2017·衡水押题卷)化学上常用AG表示溶液中的lg 。25 ℃时,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 0.100 mol·L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
【导学号:97184126】
A.D点溶液的pH=11.25
B.B点溶液中存在c(H+)-c(OH-)=c(NO)-c(HNO2)
C.C点时,加入NaOH溶液的体积为20 mL
D.25 ℃时,HNO2的电离常数Ka=1.0×10-5.5
A [D点lg =-8.5,则=1.0×10-8.5,因为Kw=1.0×10-14,所以c(H+)=1.0×10-11.25,pH=11.25,A正确;B点溶液为等浓度的HNO2和NaNO2的混合溶液,电荷守恒式为c(H+)+c(Na+)=c(OH-)+c(NO),物料守恒式为2c(Na+)=c(NO)+c(HNO2),则2c(H+)-2c(OH-)=c(NO)-
c(HNO2),B错误;C点溶液的lg =0,则=1,HNO2的电离程度与NaNO2的水解程度相同,加入NaOH溶液的体积小于20 mL,C错误;A点溶液lg =8.5,则=1.0×108.5,Kw=1.0×10-14,c2(H+)=1.0×10-5.5,则HNO2的电离常数Ka=≈=,D错误。]
4.(2017·山东实验中学二模)已知下表为25 ℃时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( ) 【导学号:97184127】
CH3COOH
HClO
H2CO3
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.4×10-7
Ka2=4.7×10-11
A. 向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+
H2O===2HClO+CO
B.相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)
=c(OH-)-c(H+)
C.25 ℃时,0.10 mol·L-1 Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:
c(Na+)=c(CO)+c(HCO)+c(H2CO3)
D.向0.1 mol·L-1 CH3COONa溶液中加入少量水,溶液中
增大
B [根据电离平衡常数可知酸性强弱顺序是CH3COOH>H2CO3> HClO>HCO。根据较强酸制备较弱酸可知向NaClO溶液中通入少量二氧化碳的离子方程式为ClO-+CO2+H2O===HClO+HCO,A错误;相同浓度的CH3COONa和NaClO的混合溶液中存在物料守恒c(CH3COOH)+c(HClO)=c(Na+)-c(CH3COO-)-c(ClO-),根据电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+c(ClO-)+c(OH-),因此存在c(CH3COOH)+c(HClO)=c(OH-)-c(H+),B正确; 25 ℃时,0.10 mol·L-1 Na2CO3溶液通入CO2
至溶液的pH=7时溶液是NaHCO3和碳酸的混合溶液, 则溶液中:c(Na+)c(A-)+c(H+)+2c(HA),C错误;HA为弱酸,当滴入少量的MOH溶液时,溶液中的c(H+)减小,溶液的pH升高,促进HA的电离,c(A-)增大,c(HA)减小,c(A-)/c(HA)的值增大,D正确。]
[方法技巧]
电离平衡常数的拓展应用
(1)根据电离常数判断电离平衡移动方向
弱酸(或弱碱)溶液稀释时,平衡会向电离的方向移动,但为什么会向电离的方向移动却很难解释,应用电离常数就能很好地解决这个问题。如对CH3COOH溶液进行稀释:
CH3COOH H+ + CH3COO-
原平衡: c(CH3COOH) c(H+) c(CH3COO-)
Qc===1)
所以电离平衡向电离方向移动。
(2)计算弱酸(或弱碱)溶液中H+(或OH-)浓度
已知25 ℃时CH3COOH的电离常数Ka=1.75×10-5,则25 ℃时0.1 mol·L-1的CH3COOH溶液中CH3COOHH++CH3COO-
Ka=
由于水电离出的H+浓度很小,可忽略不计,故c(H+)=c(CH3COO-),而CH3COOH的电离程度很小,CH3COOH的平衡浓度与0.1 mol·L-1很接近,故可进行近似计算。
c2(H+)=0.1×Ka,c(H+)= mol·L-1≈1.32×10-3 mol·L-1。
■提能力——针对热点题型训练·
(见专题限时集训T1、T3、T5、T6、T9、T10)
命题热点2 溶度积常数的应用
(对应学生用书第47页)
■储知识——剖解重点难点备考·
1.溶度积常数Ksp的表达式
对于组成为AmBn的电解质,饱和溶液中存在平衡AmBn(s) mAn+(aq)+nBm-(aq),Ksp=cm(An+)·cn(Bm-)。
2.影响Ksp大小的因素
对于确定的物质来说,Ksp只与温度有关;一般情况下,升高温度,Ksp增大。
3.溶度积规则
当Qc>Ksp时,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡;当Qc=Ksp时,溶液饱和,沉淀与溶解处于平衡状态;当QcS(PbS)>S(CuS)
D.若溶液中c(Cu2+)=1×10-10 mol·L-1,则S2-已完全转化成CuS
B [ZnS在水中存在溶解平衡:ZnS(s)Zn2+(aq)+S2-(aq),由于
Ksp(CuS)Ksp(PbS)>Ksp(CuS),且其Ksp表达形式相同,据此可知三种物质在水中的溶解度:S(ZnS)>S(PbS)>S(CuS),C正确。若溶液中c(Cu2+)=1×
10-10 mol·L-1,则溶液中c(S2-)== mol·L-1=6.0×10-26 mol·L-1<1×10-5 mol·L-1,故S2-已完全转化成CuS,D正确。]
4.(2017·江西南昌摸底调研)在t ℃时,AgI在水中的沉淀溶解平衡曲线如图所示,下列说法不正确的是( )
【导学号:97184129】
A.在t ℃时,AgI的Ksp(AgI)=2.5×10-15
B.图中b点有AgI沉淀析出
C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点
D.在t ℃时,AgI的溶解度约为1.175×10-6 g
C [图中c点时c(Ag+)=c(I-)=5×10-8 mol·L-1,则该温度时AgI的Ksp(AgI)=c(Ag+)·c(I-)=5×10-8×5×10-8=2.5×10-15,A正确;图中b点在平衡曲线以上,该点的浓度商Qc>Ksp(AgI),则有AgI沉淀析出,B正确;c点溶液中加入适量蒸馏水,c(Ag+)、c(I-)均减小,故不能实现c点到a点的转化,C错误;由图可知,t ℃时AgI饱和溶液的浓度c(AgI)=5×10-8 mol·L-1,假设AgI饱和溶液的密度为1 g·cm-3,则有≈,故t ℃时AgI的溶解度约为1.175×10-6 g,D正确。]
■提能力——针对热点题型训练·
(见专题限时集训T2、T4、T7、T8)
复习效果验收| 真题试做 预测尝鲜
(对应学生用书第48页)
■体验高考真题·
1.(2017·全国Ⅲ卷)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4
,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是 ( )
A.Ksp(CuCl)的数量级为10-7
B.除Cl-反应为Cu+Cu2++2Cl-===2CuCl
C.加入Cu越多,Cu+浓度越高,除Cl-效果越好
D.2Cu+===Cu2++Cu平衡常数很大,反应趋于完全
C [A对:当-lg=0时,lg 约为-7,即c(Cl-)=
1 mol·L-1,c(Cu+)=10-7 mol·L-1,因此Ksp(CuCl)的数量级为10-7。
B对:分析生成物CuCl的化合价可知,Cl元素的化合价没有发生变化,Cu元素由0价和+2价均变为+1价,因此参加该反应的微粒为Cu、Cu2+和
Cl-,生成物为CuCl,则反应的离子方程式为Cu+Cu2++2Cl-===2CuCl。
C错:铜为固体,只要满足反应用量,Cu的量对除Cl-效果无影响。
D对:2Cu+===Cu2++Cu的平衡常数K=,可取图像中的c(Cu+)=
c(Cu2+)=1×10-6 mol·L-1代入平衡常数的表达式中计算,即为K==1×106 L·mol-1,因此平衡常数很大,反应趋于完全。]
2.(2016·全国Ⅲ卷)下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中增
大
C.向盐酸中加入氨水至中性,溶液中>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变
D [A项,CH3COOHCH3COO-+H+,K=,则=,加水稀释,K不变,c(CH3COO-)减小,故比值变大。B项,CH3COONa溶液中存在水解平衡:CH3COO-+H2OCH3COOH+OH-,K=,升高温度,水解平衡正向移动,K增大,
则(1/K)减小。C项,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知,c(Cl-)=c(NH)。D项,向AgCl、AgBr的饱和溶液中加入少量AgNO3,沉淀溶解平衡逆向移动,由于==,Ksp仅与温度有关,故不变。]
3.(2014·全国Ⅰ卷)溴酸银(AgBrO3)溶解度随温度变化曲线如下图所示。下列说法错误的是( )
【导学号:97184130】
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
A [A.由题图可知,随着温度升高,溴酸银的溶解度逐渐增大,因此AgBrO3的溶解是吸热过程。B.温度越高物质的溶解速率越快。C.由溶解度曲线可知,60 ℃时AgBrO3的溶解度约为0.6 g,则其物质的量浓度约为0.025 mol·L-1,AgBrO3的Ksp=c(Ag+)·c(BrO)=0.025×0.025≈6×10-4。D.若KNO3中含有少量AgBrO3,可通过蒸发浓缩得到KNO3的饱和溶液,再冷却结晶获得KNO3晶体,而AgBrO3留在母液中。]
■预测2018年高考·
[考情预测] 在高考试题中将弱电解质的电离与溶液的酸碱性、盐类的水解、离子浓度大小比较、沉淀溶解平衡等内容相结合,以图像的形式出现仍是重要的考查方式;2018年高考要特别关注电离常数、水解常数、溶度积的相关运用与计算。
1.25 ℃时,下列有关电解质溶液的说法正确的是( )
【导学号:97184131】
A.常温下,将0.1 mol·L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升
到5.0时,溶液中的值增大到原来的10倍
B.已知HA的Ka=6.25×10-5,当pH为5.0时,HA的溶液中=0.16
C.向含有Mg(OH)2固体的溶液中滴加几滴稀硫酸,Ksp[Mg(OH)2]增大
D.室温下K(HCN)c(Cu2+),离子浓度越大,-lgc(M2+)值越小,则相同条件下,饱和溶液中c(Fe2+)较大,所以Fe(OH)2饱和溶液中-lg c(Fe2+)较小,则b线表示Fe(OH)2饱和溶液中的变化关系,由图像可知,pH=8时,-lg c(Fe2+)=3.1,Ksp[Fe(OH)2]=10-3.1×
(10-6)2=
10-15.1,A正确;当pH=10时,-lgc(Cu2+)=11.7,则Ksp[Cu(OH)2]=
10-11.7×(10-4)2=10-19.7,c(Fe2+):c(Cu2+)===,B错误;向X点对应的饱和溶液中加入少量NaOH,溶液中会生成Cu(OH)2沉淀,溶液中c(Cu2+)的浓度会减小,而从X点到Y点c(Cu2+)浓度不变, C错误;Ksp[Cu(OH)2]
查看更多