- 2021-05-24 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考电化学 分类汇编
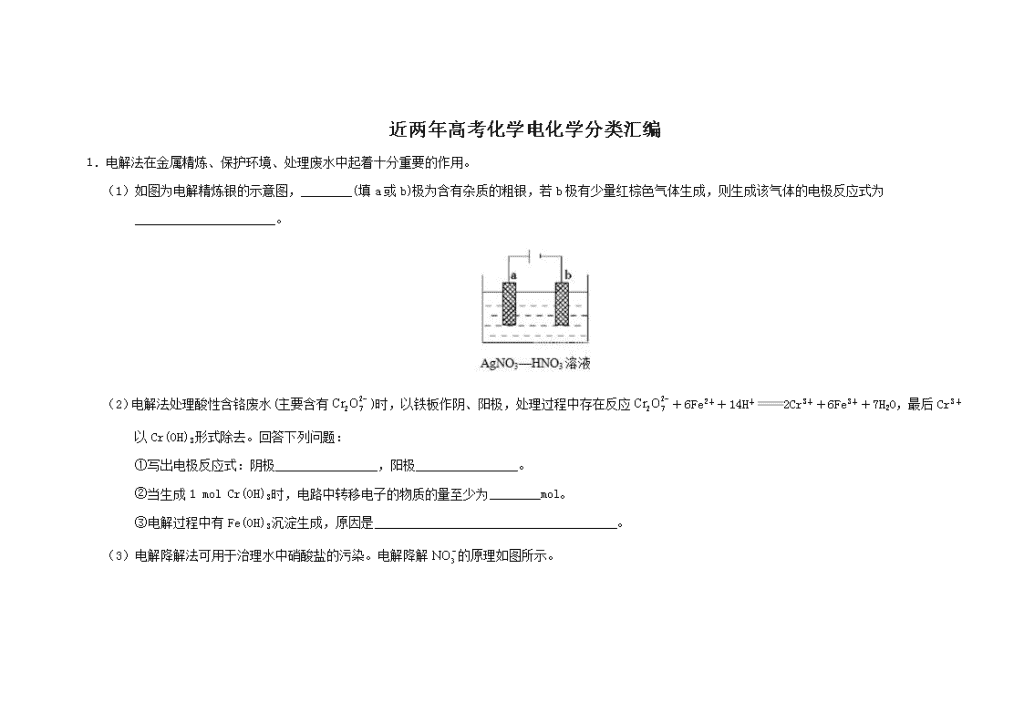
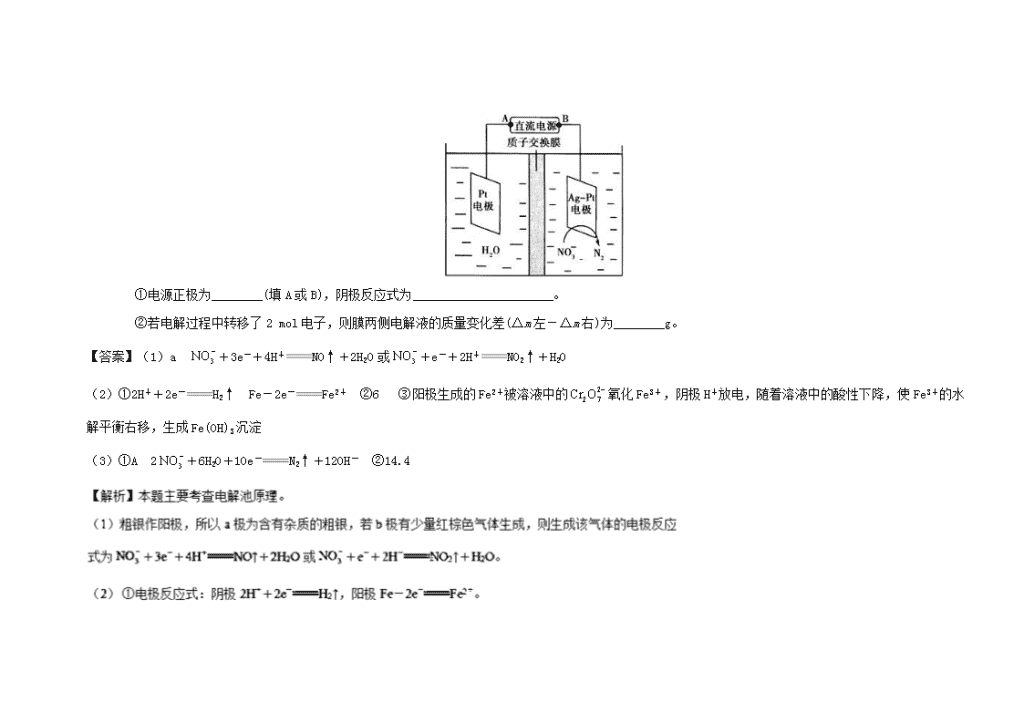
近两年高考化学电化学分类汇编 1.电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。 (1)如图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________。 (2)电解法处理酸性含铬废水(主要含有)时,以铁板作阴、阳极,处理过程中存在反应+6Fe2++14H+2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题: ①写出电极反应式:阴极________________,阳极________________。 ②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol。 ③电解过程中有Fe(OH)3沉淀生成,原因是______________________________________。 (3)电解降解法可用于治理水中硝酸盐的污染。电解降解的原理如图所示。 ①电源正极为________(填A或B),阴极反应式为______________________。 ②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。 【答案】(1)a +3e-+4H+NO↑+2H2O或+e-+2H+NO2↑+H2O (2)①2H++2e-H2↑ Fe-2e-Fe2+ ②6 ③阳极生成的Fe2+被溶液中的氧化Fe3+,阴极H+放电,随着溶液中的酸性下降,使Fe3+的水解平衡右移,生成Fe(OH)3沉淀 (3)①A 2+6H2O+10e-N2↑+12OH- ②14.4 3.Ⅰ.(1)研究钢铁的防腐蚀措施意义重大。利2.用如图所示装置可以模拟铁的电化学防护,其中Y为NaCl。 为减缓铁的腐蚀: ①若X为碳棒,开关K应置于 (填字母)处,此时X极发生的电极反应式为 。 ②若X为锌,开关K置于M处,则此时铁极发生的电极反应式为 。 (2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀。为表示其原理,某班级的学生绘制了下列装置图(假设电极材料均为铁,电解质溶液均为NaCl溶液)。 你认为其中能合理模拟金属管道的腐蚀原理的是 ;c(Ⅱ)的总反应方程式是 ;若图d 中接通电源,则平放的铁丝左侧附近产生的现象是 ;请你为防止地下金属管道腐蚀提供一种策略 。 Ⅱ.1 L某溶液中含有的离子如下表: 离子 Cu2+ Al3+ Cl− 物质的量浓度/(mol/L) 2 1 4 x 用惰性电极电解该溶液。当电路中有5 mol 电子通过时,溶液的pH= (忽略电解时溶液体积的变化及电极产物可能存在的溶解现象)。 【答案】Ⅰ.(1)①N 2Cl−−2e−Cl2↑ ②O2+2H2O+4e−4OH− (2)acd Fe+2H2OFe(OH)2↓+H2↑ 铁丝左侧有无色的气体产生,附近产生少量白色沉淀,随后白色沉淀变成灰绿色,最后变为红褐色 将埋在地下的金属管道表面涂绝缘膜(塑料或油漆等) Ⅱ.0 4.离子交换膜法为目前普遍使用的制碱技术,其 极反应为: CO2+3.(2017江苏卷)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: 注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。 (3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。 (4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。 【答案】(3)石墨电极被阳极上产生的O2氧化 (4)4CO32-+2H2O−4e−=4HCO3-+O2↑ H2 4.【2017天津卷】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。 Ⅱ.含铬元素溶液的分离和利用 (4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。[来源:学+科+网Z+X+X+K] 【答案】(4)在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液 CrO42-和Cr2O72- NaOH和H2 5.【2016新课标1卷】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下: 回答下列问题: (3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。 【答案】(3)NaOH溶液 ;Na2CO3溶液 ;ClO2−(或NaClO2); 【解析】(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2, 阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2; 6.【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。 (1)Fe还原水体中NO3-的反应原理如图所示。 [来源:Zxxk.Com] ①作负极的物质是________。 ②正极的电极反应式是_________。 (2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下: 初始pH pH=2.5 pH=4.5 NO3—的去除率 接近100% <50% 24小时pH 接近中性 接近中性 铁的最终物质形态 pH=4.5时,NO3—的去除率低。其原因是________。 (4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下: 初始pH pH=2.5 pH=4.5 NO3—的去除率 约10% 约3% 1小时pH 接近中性 接近中性 与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。 【答案】(1)①铁 ②NO3-+8e-+10H+=NH4++3H2O (2)因为铁表面生成不导电的FeO(OH),阻止反应进一步发生 (4)Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全,初始pH高时,产生的Fe2+浓度小,从而造成NO3—去除率和铁的最终物质形态不同。 【解析】(1)①Fe是活泼的金属,根据还原水体中的NO3-的反应原理图可知,Fe被氧化作负极; ②正极发生得到电子的还原反应,因此正极是硝酸根离子被还原为NH4+,该溶液为酸性电解质溶液,结合元素和电荷守恒可知电极反应式为:NO3-+8e-+10H+=NH4++3H2O; (2)从pH对硝酸根去除率的影响来看,初始pH=4.5时去除率低,主要是因为铁离子容易水解生成FeO(OH),同时生成的Fe3O4产率降低,且生成的FeO(OH)不导电,所以NO3-的去除率低; (4)Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全;初始pH高时,由于Fe3+的水解,Fe3+越容易生成FeO(OH),产生的Fe2+浓度小,从而造成NO3—去除率和铁的最终物质形态不同。 7.【2016江苏卷】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。[来源:学科网ZXXK] (1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72–的酸性废水通过铁炭混合物,在微电池正极上Cr2O72–转化为Cr3+,其电极反应式为_____________。 【答案】(1)Cr2O72–+6e-+14H+=2Cr3++7H2O 8.【2016天津卷】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题: (1)但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____。 (5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。 ①电解一段时间后,c(OH−)降低的区域在_______(填“阴极室”或“阳极室”)。[来源:学.科.网Z.X.X.K] ②电解过程中,须将阴极产生的气体及时排出,其原因是_______。 ③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。 【答案】(1)H2+2OH--2e-=2H2O (5)①阳极室 ②防止Na2FeO4与H2反应使产率降低 ③M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低)。 9.【2016浙江卷】催化还原CO2是解决温室效应及能源问题的重要手段之一。 (5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。 【答案】(5)阴 CO2+6H++6e−==CH3OH+H2O 【解析】(5)二氧化碳变甲醇,碳元素的化合价降低,得到电子,说明其在阴极反应,其电6H++6e-=CH3OH+H2O查看更多