- 2021-05-22 发布 |
- 37.5 KB |
- 31页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习学案课件(人教版):第5章 物质结构元素周期律第1节 元素周期表
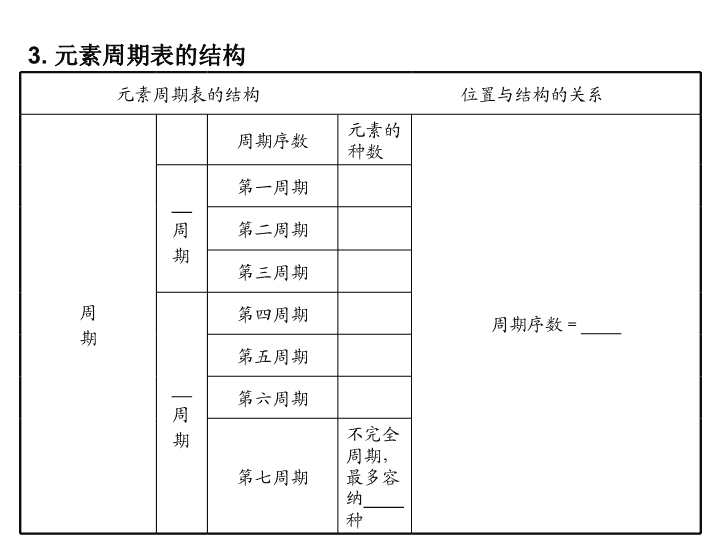
第一节 元素周期表 一、元素周期表 1. 第一张元素周期表 1869年由俄国化学家________初步绘制完成。 2. 编制原则 (1)按________递增顺序从左到右排列,把________相同的元素 排成一横行。 (2)把不同横行中____________相等的元素,按________递增 的顺序从上到下排成一纵行。 3. 元素周期表的结构 元素周期表的结构 位置与结构的关系 周 期 周期序数 元素的 种数 周期序数=____ __ 周 期 第一周期 第二周期 第三周期 __ 周 期 第四周期 第五周期 第六周期 第七周期 不完全 周期, 最多容 纳____ 种 族 主族(A) 共__个。 (ⅠA族~ⅦA 族) 由________ 元素和 ______元素 共同构成的 族 最外层电子 数=价电子 数= ________ 零族 ______元素 现在有____ 种 最外层电子 数均为____ 个(____为2 个除外) 副族(B) 共__个。 (ⅠB族~ⅦB 族) 只由 ________元 素构成的族 最外层电子 数一般不等 于族序数(第 ⅠB族、ⅡB 族除外) 第Ⅷ族 第 __________ 共3个纵行 4. 元素周期表中的元素分区 (1)请在下面的虚线框中用实线画出周期表的轮廓,并画出金属 与非金属的分界线。 (2)镧系和锕系 镧系位于第六周期________族,共______种元素;锕系位于第 ______周期________族,共________种元素。 (3)过渡元素 第3~12共____个纵行的元素,包括____个副族和______族, 全部是______元素,原子最外层电子数不超过2个(Pd除外)。 一、1. 门捷列夫 2.(1)原子序数 电子层数 (2)最外层电子数 电子层数 3. 短 2 8 8 长 18 18 32 32 原子核外电子层数 7 长周期 短周期 主族序数 稀有气体 6 8 He 7 长周期 8、9、10 4. (1)略 (2)ⅢB 15 七 ⅢB 15 (3)10 7 Ⅷ 金属 答案: 二、同主族元素的性质与原子结构 1. 碱金属元素 原子 序数 元素 符号 最外 层 电子 数 电子 层数 原子 半径 最高 化合 价 金属 性 非金 属性 3 1 ↓ 逐 渐 ____ +1 ↓ 逐 渐 ____ ↓ 逐 渐 ____ 11 19 37 55 2. 卤族元素 原子 序数 元素 符号 最外 层电 子数 电子 层数 原子 半径 最高 化合 价 最低 化合 价 金属 性 非金 属性 9 2 ↓ 逐 渐 ____ ↓ 逐 渐 ___ _ ↓ 逐 渐 ___ _ 17 3 都是 +735 4 53 5 由以上可得:元素的性质取决于原子核外电子的排布,特 别是__________。同主族元素的原子__________相同,因此 化学性质________;随电子层数依次增多,原子半径逐渐 ________,原子核对外围电子的吸引力逐渐________,失电子 能力逐渐______,得电子能力逐渐________,所以,元素金属 性逐渐________,元素非金属性逐渐________。 二、1. Li 2 Na 3 K 4 Rb 5 Cs 6 增大 增强 减弱 2. F Cl Br I 7 增大 -1 增强 减弱 最外层电子数 最外层电子数 相似 增大 减弱 增强 减弱 增强 减弱 答案: 同种元素可以有若干种不同的原子(即核素)。至今已发现 了112种元素,但发现的核素远多于112种。 答案: 三、核素 1. 原子的结构和三种微粒间的关系 AZX的含义:代表一个________为A、质子数为____的X原子。 质量数(A)=________+________ 2. 核素、同位素、元素 (1)核素:具有一定数目________和一定数目________的一种原 子。如氢元素有三种核素,符号分别为 ______________________________。 (2)同位素:________相同而________不同的同一元素的不同 ________互称同位素(即同一元素的不同________互称同位素)。 16O、17O、18O是氧元素的三种核素,互为同位素。 (3)元素:具有相同________的同一类________的总称。 三、1. 原子核 Z A-Z 核外电子 质量数 Z 质子数(Z) 中子数(N) 2. (1)质子 中子 1H(H)、2H(D)、3H(T) (2)质子数 中子数 原子 核素 (3)质子数 原子 答案: 元素的相对原子质量是该元素各同位素相对原子质量的平均值,即 元素周期表中的相对原子质量;原子的相对原子质量等于该原子的 质量与12C原子质量的1/12的比值;原子的相对原子质量的近似整 数值等于质量数。 答案: 元素周期表 【例1】 国际组织无机化学命名委员会将长式周期表原先的主 副族族号取消,由左向右编为18 列,如碱金属为第1列,稀有 气体为第18列。按这个规定,下列说法不正确的是( ) A. 只有第2列元素的原子最外层有2个电子 B. 第14列元素形成化合物种类最多 C. 第3列元素种类最多 D. 第16、17列元素并不都是非金属元素 【自主解答】 A 解析:本题考查元素周期表的结构,长式周期表原先的主副 族族号取消,第2列即为原先的ⅡA族,最外层电子数为2,但最 外层电子数为2的不一定只在这一族,如He最外层为2个电子或 某些过渡元素最外层也可能为2个,A项错误;第14列为原先的 ⅣA族,碳元素是形成化合物种类最多的元素,所以B正确;第 三列为原先的ⅢB族,在第六、七周期分别出现了镧系和锕系所 以元素种类最多,C项正确;第16、17列分别对应ⅥA、ⅦA族, 并非全部为非金属元素,D项正确。 1. 元素在周期表中位置的确定 (1)根据原子结构与元素周期表关系的确定 对于主族元素,①周期序数=核外电子层数 ②主族序数=最外层电子数=最高正价=8-︱最低负价︱ ③核内质子数=原子序数=核外电子数=核电荷数 (2)根据原子序数确定 掌握元素周期表的结构中各族的排列顺序,记住各周期元素数 目,可以快速确定惰性气体的原子序数。进而可以推断任意一 种元素在周期表中的位置。可遵循“比大小,定周期;比差值, 定族数”的原则。 2. 元素原子序数的确定 (1)奇偶关系 元素周期表中,原子序数为奇(或偶)数的元素,该元素所在族 序数、所在纵行序数的主要化合价(N除外)一般地也为奇(或偶) 数。 (2)利用同周期元素的原子序数差 ①同周期中直接相邻元素的原子序数相差1。 ②同周期ⅡA族与ⅢA族元素的原子序数差 第二、三周期元素,原子序数差为1; 第四、五周期元素,原子序数差为11(因为增加了10种过渡元 素); 第六、七周期元素,原子序数差为25(因为增加了15种镧系或锕 系元素)。 同理可推得ⅠA族与ⅢA族元素的原子序数差。 (3)利用同主族、邻周期元素的原子序数差 ①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻 周期元素的原子序数之差为上一周期元素所在周期所含元素种数。 ②位于过渡元素右侧的主族元素,即ⅢA~ⅦA族,同主族、邻 周期元素的原子序数之差为下一周期元素所在周期所含元素种数。 【知识关联】元素周期表与元素周期律、元素化合物知识联系。 1. 下列有关元素周期表的说法不正确的是( ) A. 同一主族相邻周期元素的原子序数的差不可能为10 B. 长周期第ⅡB族与第ⅢB族元素的原子序数差值一定是1 C. 催化剂一般在过渡元素中寻找 D. 过渡元素全部是金属元素 B 解析:解答本题必须熟练掌握元素周期表的结构。同一主族 相邻周期的两种元素的原子序数之差为2、8、8、18、18、32这 几个数,A项正确。在元素周期表中,第ⅡB族与第ⅢB族不相 邻,元素的原子序数差值不可能是1。 答案: 元素的性质与原子结构的关系 【例2】 (2009高考·海南卷,10)门捷列夫在描述元素周期表时, 许多元素尚未发现,但他为第四周期的三种元素留下了空位,并 对它们的一些性质做了预测,X是其中的一种“类硅”元素,后 来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准 确。根据元素周期律,下列有关X性质的描述中错误的是( ) A. X单质不易与水反应 B. XO2可被碳或氢还原为X C. XCl4的沸点比SiCl4的高 D. XH4的稳定性比SiH4的高 【自主解答】 D 解析:根据同主族元素性质与原子结构的关系,同主族元素 随着电子层数的递增,非金属性减弱,气态氢化物的稳定性减弱。 故D选项有明显错误。其他选项可由硅的性质进行类推。 1. 第ⅠA族不等于碱金属,氢元素不属于碱金属; 2. Li在氧气中燃烧只生成Li2O; 3. 氟元素没有正化合价,故没有含氧酸。 【知识关联】同主族元素性质的相似性和递变性与钠、氯元素 的单质及其化合物的性质联系。 2. (2009高考·山东卷,11)元素在周期表中的位置,反映了元素 的原子结构和元素的性质,下列说法正确的是( ) A. 同一元素不可能既表现金属性,又表现非金属性 B. 第三周期元素的最高正化合价等于它所处的主族序数 C. 短周期元素形成离子后,最外层电子都达到8电子稳定结构 D. 同一主族的元素的原子,最外层电子数相同,化学性质完全 相同 B 解析:处于元素周期表金属与非金属分界线附近的元素,既表 现金属性,又表现非金属性,A错误;主族元素的最高正化合价等 于它所处的主族序数,也等于其最外层电子数,B正确;H+、Li +的最外层电子数分别是0、2, C项错误;同一主族的元素的原子 最外层电子数虽相同,但是核电荷数、原子半径不同,化学性质不 完全相同而是相似,D错误。 答案: 原子结构、元素、核素、同位素 【例3】 (2009高考·广东卷,1) 我国稀土资源丰富。下列有关 稀土元素 14462Sm与 15062Sm的说法正确的是( ) A. 14462Sm与 15062Sm互为同位素 B. 14462Sm与 15062Sm的质量数相同 C. 14462Sm与 15062Sm是同一种核素 D. 14462Sm与 15062Sm的核外电子数和中子数均为62 【自主解答】 A 解析:解答本题必须明确元素、核素、同位素的区别与联 系,理解原子结构以及质量数与质子数、中子数的数量关系。由 稀土元素14462Sm、15062Sm可知,二者为Sm元素的两种核 素。核内质子数=原子序数=核外电子数=核电荷数=62。 14462Sm的质量数为144,中子数为82;15062Sm的质量数为 150,中子数为88;故二者互为同位素。 1. 原子结构及粒子间的关系 (1)原子结构 (2)粒子间的关系 ①质量数(A)=质子数(Z)+中子数(N) ②中性原子:质子数=核电荷数=核外电子数 ③阳离子:质子数=核外电子数+电荷数 ④阴离子:质子数=核外电子数-电荷数 2. 元素、核素、同位素的关系(图示) 【知识关联】原子结构与分子结构、离子结构及其简单计算联系。 3. (2011·江西吉安一中高三期中)在2010年4月召开的首届世界 核安全峰会上,胡锦涛总书记倡导各成员国未来应安全、合理 地开发利用核能。 23592U是核反应堆的重要原料,下列说法中 正确的是( ) A. 23592U的中子数为235 B. 23592U和 23892U是同一种核素 C. 23592U处在第六周期 D. 合理利用核能符合“低碳经济”要求 D 解析:23592U的中子数为235-92=143,A错;23592U和 23892U互称为同位素,是两种不同的核素,B错;23592U位于第 七周期,第ⅢB族,属于锕系元素,C错。 答案: 1. 下列关于元素周期表的说法错误的是( ) A. 元素周期表是按元素原子序数大小排列而成的 B. 元素原子的最外层电子数等于其所在族的族序数 C. 元素原子的电子层数一般等于其所在周期的周期序数 D. 元素周期表是元素周期律的具体表现形式 2. 在周期表中,第三、四、五、六周期元素的数目分别是( ) A. 8、18、32、32 B. 8、18、18、32 C. 8、18、18、18 D. 8、8、18、18 1. B 解析:本题主要考查元素周期表的编制原则。 “元素原子 的最外层电子数等于其所在族的族序数” 适用于主族元素,对于其 他族不一定正确。 2. B 解析:解题关键是根据元素周期表的结构准确记忆各周期 元素的数目。 答案: 3. (2010·山东潍坊期末)在陆地生态系统研究中,2H、13C、 15N、18O、34S等常用做环境分析的指示原子。下列说法中正 确的是( ) A. 32S与33S的中子数不等,属于两种不同的核素 B. 13C和15N原子核内的质子数相差2 C. 1H216O和2H218O分别与金属钠反应,所得气体的化学性质 不同 D. 2H+的酸性比1H+的酸性更强 4. 关于卤素(用X表示)的下列叙述中正确的为( ) A. 卤素单质与水反应的通式为X2+H2O HX+HXO B. HX都极易溶于水,它们的热稳定性随核电荷数增大而增强 C. 卤素单质的颜色随相对分子质量增大的顺序不断加深 D. X-的还原性随卤素的核电荷数增大而增强,核电荷数小的 卤素单质可将核电荷数大的卤素从它的盐溶液里置换出来 3. A 解析:本题主要考查核素和同位素。32S与33S的质子数相 同,中子数不等,属于S元素的两种不同的核素,A正确;13C和 15N质子数分别为6、7,B错;1H216O和2H218O化学性质相同, 与金属钠反应生成的1H2和2H2化学性质也相同,C错;2H+与1H +的化学性质相同,D错。 4. C 解析:本题主要考查卤素的相似性和递变性。解答时既要 掌握物质的共性,又要注意物质的特性。氟没有含氧酸,F2与水反 应不符合A中通式。卤化氢的稳定性顺序是HF>HCl>HBr>HI, B错。F2与H2O反应放出O2,不能置换出卤素单质,D错。 答案: 5. 根据元素周期表1~20号元素的性质和递变规律,回答下列问 题。 (1)属于金属元素的有____________种,金属性最强的元素与氧 反应生成的化合物有________(填两种化合物的化学式); (2)属于稀有气体的是________________(填元素符号,下同); (3)形成化合物种类最多的两种元素是 __________________________________________________ ______________________; (4)第三周期中,原子半径最大的是(稀有气体除外)________; (5)推测Si、N最简单氢化物的稳定性________大于________(填 化学式)。 (1)7 K2O、K2O2(KO2也可以) (2)He、Ne、Ar (3)C、H (4)Na (5)NH3 SiH4 解析:解答本题须知道1~20号元素在元素周期表中的排列关系, 并熟记相关元素的性质和递变规律。在解题时注意运用元素周期 律及元素“位-构-性”之间的关系分析推断。根据同主族元素 性质的相似性和递变性,Li的氧化物有 Li2O, Na的氧化物有 Na2O、 Na2O2 ,则 K的氧化物应有K2O、K2O2、 KO2、KO3 等。有机物的种类远大于无机物的种类,绝大多数有机物都含有 C、H两种元素。元素的非金属性:N>C(同周期)、C>Si(同主族), 故元素的非金属性:N>Si,最简单氢化物的稳定性:NH3>SiH4。 答案:查看更多