- 2021-05-22 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学复习拓展精练
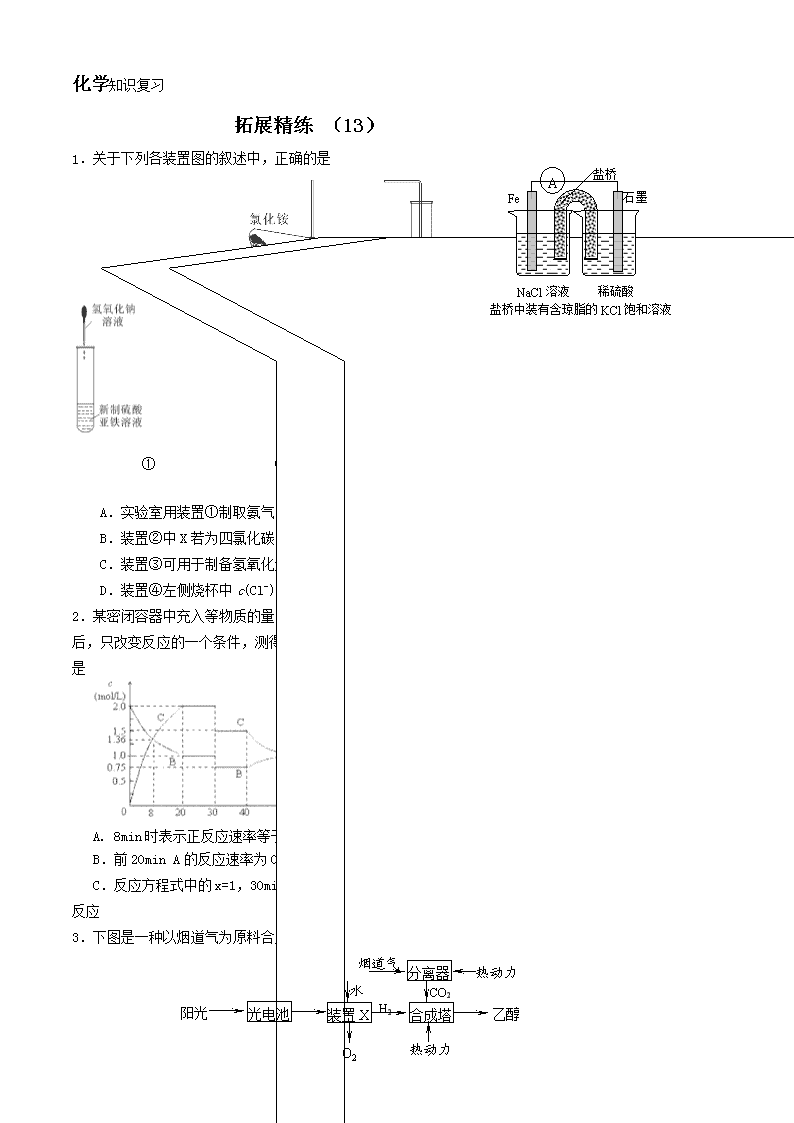
化学知识复习 拓展精练 (13)学科王 1.关于下列各装置图的叙述中,正确的是 盐桥 Fe 石墨水 NaCl溶液 稀硫酸 盐桥中装有含琼脂的KCl饱和溶液 A ① ② ③ ④ A.实验室用装置①制取氨气 B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 C.装置③可用于制备氢氧化亚铁并观察其颜色 D.装置④左侧烧杯中c(Cl-)增大 2.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A (g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是 A. 8min时表示正反应速率等于逆反应速率 B.前20min A的反应速率为0.05mol/(L·min ) C.反应方程式中的x=1,30min 时表示增大压强 D.40min时改变的条件是升高温度,且正反应为吸热反应 3.下图是一种以烟道气为原料合成乙醇的工作原理示意图。下列说法正确的是 阳光 光电池 装置X 水 O2 H2 合成塔 CO2 分离器 热动力 烟道气 热动力 乙醇 A.该流程图中只存在4种形式的能量转化 B.装置X中阳极反应式为:2H2O-4e-=4H++O2↑ C.合成塔中生成乙醇的反应是化合反应 D.本工艺减轻了烟道气中CO2对环境的压力,绿色化学的成分高 4(12分)饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案: pH=10.25 铝粉 N2 过滤 滤 渣 NO3-达标 煅烧 固体a 熔融电解 固体b 调节pH 饮用水 熟石灰 空气中 请回答下列问题: ⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为 __________________________________________。 ⑵该方案中选用熟石灰调节pH,理由是_______________________、__________________,在调节pH时,若pH过大或过小都会造成 的利用率降低。 ⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为____________________________________。 ⑷饮用水中的NO3- 主要来自于NH4+。已知在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下: 试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。 5.(15分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程: 粗品 SO2 Br2 操作Ⅰ 操作Ⅱ Na2SO3 混合② 少量Ba(OH)2 H2SO4 BaSO4 无色溶液 操作Ⅲ 混合溶液 精制的 氢溴酸 冰水 混合① 根据上述流程回答下列问题: (1)混合①中发生反应的化学方程式为 。 (2)混合①中使用冰水的目的是 。 (3)操作Ⅱ和操作Ⅲ的名称分别是 、 。 操作Ⅲ一般适用于分离____________混合物。(选填编号) a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体 (4)混合②中加入Na2SO3的目的是 。 (5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究: 甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。 乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂 。 6.(12分) 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。 方案甲: 含铜废料 黑色固体及残留物 足量稀硫酸.加热 蓝色溶液及不溶物 过滤 滤液 加铁屑 浅绿色溶液及红色沉淀物 过滤 红色粉末 在空气中灼烧 方案乙: 含铜废料 碎铜.碎电缆皮.其他杂质 加入足量稀硫酸 通入空气并加热 蓝色溶液及不溶物 过滤 滤液 加铁屑 浅绿色溶液及红色沉淀物 过滤 红色粉末 粉碎 (1)两个方案中,符合当前生产中绿色化学理念的是方案 ,理由是 。 (2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为_________________________, 若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为: ︰ 。 (3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测: ①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g ②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。 通过计算测知该晶体的化学式是 。 (4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl : 2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 = 2 CuCl ↓+ 3 Na2SO4 + CO2↑ 测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3 溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为: Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+ = Fe 3+ + Ce3+ 通过计算说明上述样品中CuCl的质量分数是否符合标准。 7(15分)氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液.制备出之后要冷却为固态才便于操作和贮存。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,铁架台和夹持仪器已略去。 部分物质的有关物理数据如下: 化学式 熔点(单位:℃) 沸点(单位:℃) N2 -209.86 -195.8 O2 -218.4 -183 CO2 -57 / NH3 -77.3 -33.35 Cl2 -101 -34.6 试回答: (1)A中盛有深色固体试剂a是 ,分液漏斗中b试剂是 。 (2)B中盛有液体c是 ,C中的液体d是 。 (3)D中发生化学反应的化学方程式是 。 (4)E中的保温瓶中盛有致冷剂,它应是 (在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是 。 (5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是 ,用这些不同的连接方式的主要理由是 。 8.(14分)氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。 (1)不能通过电解纯净的液态HF获得F2,其原因是 ;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2- 放电产生气体的电极反应式 。 (2)利用K2MnF6和SbF5在一定条件下发生反应也能制取氟,同时生成KSbF6 和MnF3,化学方程式为 ,其中还原产物是 。 (3)已知氟化氢气体中存在下列平衡 :H3F3 3HF △H >0, H2F2 2HF △H >0。 ƒ Al(OH)3 1 0 3 5 7 AlF2+ AlF2+ Al3+ AlF3 AlF4- 1.0 0.2 0.4 0.6 0.8 pH ①若在定温定容条件下再充入H3F3,则H3F3与HF的浓度(mol/L)比值 (填“增大”“减小”或“不变”,下同); ②若在定温定容条件下再充入HF,则H3F3与HF 的浓度(mol/L)比值 。 (4)一定浓度的HF和Al2(SO4)3混合液中,铝的 各种微粒含量ƒ随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式为 。 9(12分) 说明:本题是“物质结构与性质”选修模块的内容,在高考中属于选做题,本次考试本题必做。 下图是元素周期表的一部分: x S P ⑴表中区域名称s、p……等确定的依据是_______________________________________。 ⑵已知A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A的核外电子排布式为______________,B在元素周期表中的位置是___________。 ⑶上表中元素x的一种氢化物的晶体结构如右图所示,写出该化合物在氯气中燃烧的化学方程式 。 除x外,第四周期中最外层只有一个电子的还有 (填元素名称)。 ⑷表中短周期非金属元素之间可以形成形形色色的有机物,如邻羟基苯甲醛()和对羟基苯甲醛(),前者沸点低于后者,理由是 _____ _____ 参考答案 BD B BD 16.(12分) ⑴10Al+6NO3-+18H2O10Al(OH)3+3N2↑+6OH-(3分) ⑵引入的Ca2+对人体无害(1分) 来源丰富、价格便宜(1分) 铝(1分) ⑶5H2+2NO3-N2+4H2O+2OH-(3分) ⑷NH4+ (aq)+2O2(g)2H+(aq)+NO3- (aq)+H2O(l) △H =-346 kJ·mol-1(3分) 17.(15分) (1)SO2+Br2+2H2O== 2HBr+H2SO4。(3分) (2)降低体系温度,防止溴蒸发,使反应完全。(2分) (3)过滤、(1分) 蒸馏(1分) d (1分) (4)除去粗品中未反应完的溴。(3分) (5)KSCN溶液,(1分)溶液变成血红色。(1分) 含有Br2,(1分)CCl4。(1分) 18.(12分) △ (1)乙 (2分) 甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾(2分) (2)2Cu + O2 +4H+ 2Cu2+ + 2H2O (2分) (3)FeSO4·7H2O (2分) (4)97.9%(合格)(4分) 19.(15分) ①a:MnO2(2分); b:浓HCl(2分). ②C 饱和NaCl溶液(2分) d浓H2SO4(2分) ③2HgO+2Cl2HgO·HgCl2+Cl2O (3分) ④液态空气 Cl2 (各1分,共2分) ⑤D、E中无橡胶塞,氧化二氯接触有机物而爆炸。(2分) 20.(14分) (1)氟化氢是共价化合物,纯液态时不电离,因而不导电 (2分); HF2- -2e- =F2↑+H+(2分) (2)2K2MnF6 +4SbF5 =4KSbF6 + 2MnF3 +F2↑(2分) MnF3(2分) (3)(2分)增大 增大 (4)AlF2++3OH-=Al(OH)3↓+2F-(2分),AlF3+3OH-=Al(OH)3↓+3F-(2分) 21.(12分) ⑴根据构造原理最后填入电子的能级的符号(2分) ⑵1s22s22p63s23p63d34s2(2分)第四周期第VIA(2分) ⑶2CuH+3Cl22CuCl2+2HCl(2分) 钾、铬(2分) ⑷邻羟基苯甲醛存在分子内氢键,而对羟基苯甲醛存在分子间氢键(2分) 学科王查看更多