- 2021-05-22 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021 高考化学 考点36 金属的电化学腐蚀与防护(原卷版)
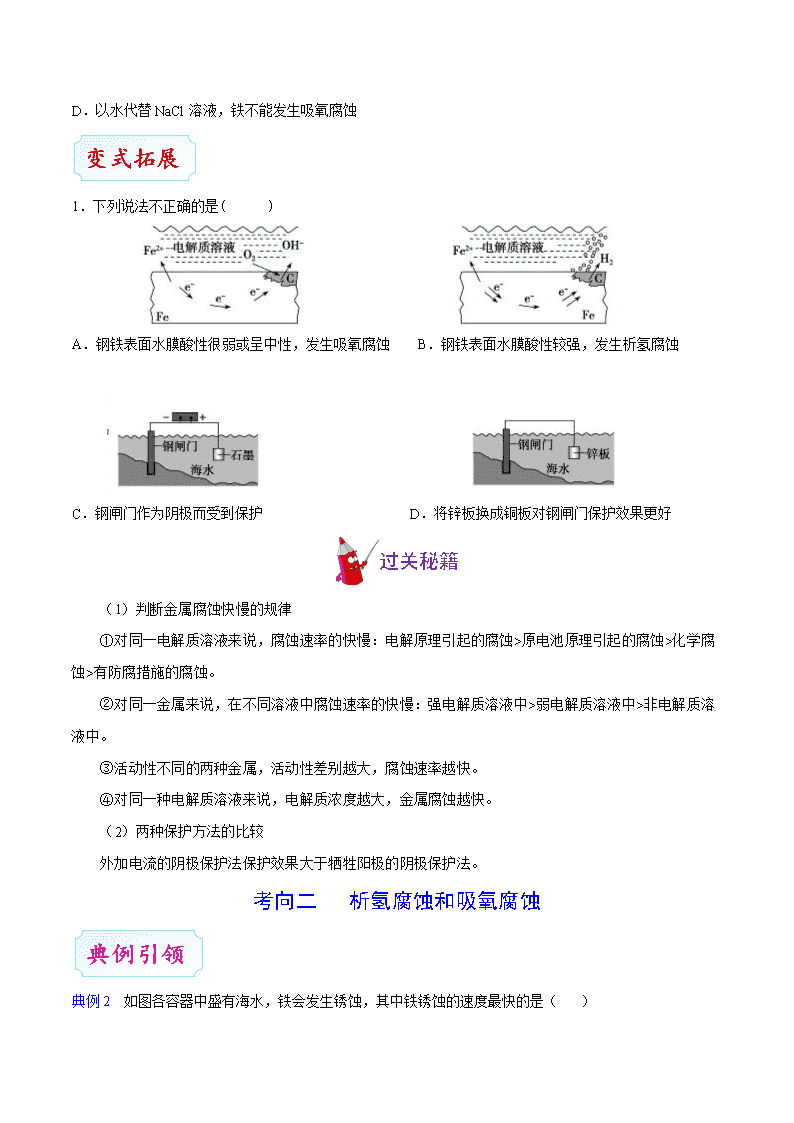
考点 36 金属的电化学腐蚀与防护 1.金属腐蚀的本质 金属原子失去电子变为金属阳离子,金属发生氧化反应。 2.金属腐蚀的类型 (1)化学腐蚀与电化学腐蚀 类型 化学腐蚀 电化学腐蚀 条件 金属跟非金属单质直接接触 不纯金属或合金跟电解质溶液接触 现象 无电流产生 有微弱电流产生 本质 金属被氧化 较活泼金属被氧化 联系 两者往往同时发生,电化学腐蚀更普遍 (2)析氢腐蚀与吸氧腐蚀 以钢铁的腐蚀为例进行分析: 类型 析氢腐蚀 吸氧腐蚀 图示 条件 水膜酸性较强(pH≤4.3) 水膜酸性很弱或呈中性 电极反应 负极 Fe−2e− Fe2+ 正极 2H++2e− H2↑ O2+2H2O+4e− 4OH− 总反应式 Fe+2H+ Fe2++H2↑ 2Fe+O2+2H2O 2Fe(OH)2 联系 吸氧腐蚀更普遍 铁锈的形成:4Fe(OH)2+O2+2H2O 4Fe(OH)3,2Fe(OH)3 Fe2O3·xH2O(铁锈)+(3−x)H2O。 3.金属腐蚀的防护方法 (1)改变金属的内部组织结构 例如把铬、镍等加入普通钢里制成不锈钢,就大大增加了钢铁对各种侵蚀的抵抗力。 (2)在金属表面覆盖保护层 在金属表面覆盖致密的保护层,从而使金属制品跟周围物质隔离开来,这是一种普遍采用的防护方法。 (3)电化学防护法 牺牲阳极的阴极保护法 外加电流的阴极保护法 依据 原电池原理 电解原理 原理 形成原电池时,被保护金属作正极(阴 极),不反应受到保护;活泼金属作负 极(阳极),发生反应受到腐蚀,阳极 要定期予以更换 将被保护的金属与另一附加电极作为电解池的 两个极,使被保护金属作阴极,在外加直流电的 作用下使阴极得到保护 应用 保护一些钢铁设备,如锅炉内壁、船 体外壳等装上镁合金或锌片 保护土壤、海水及水中的金属设备 实例 示意图 考向一 金属的腐蚀快慢与防护方法的比较 典例 1 将铁粉和活性炭的混合物用 NaCl 溶液湿润后,置于如图所示装置中,进行铁电化学腐蚀实验。下 列有关该说法正确的是 A.铁被氧化的电极反应式为 Fe-3e- ==Fe3+ B.电化学腐蚀过程中铁粉的电势比活性炭电势高 C.活性炭的存在会加速铁的腐蚀 D.以水代替 NaCl 溶液,铁不能发生吸氧腐蚀 1.下列说法不正确的是( ) A.钢铁表面水膜酸性很弱或呈中性,发生吸氧腐蚀 B.钢铁表面水膜酸性较强,发生析氢腐蚀 C.钢闸门作为阴极而受到保护 D.将锌板换成铜板对钢闸门保护效果更好 过关秘籍 (1)判断金属腐蚀快慢的规律 ①对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐 蚀>有防腐措施的腐蚀。 ②对同一金属来说,在不同溶液中腐蚀速率的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶 液中。 ③活动性不同的两种金属,活动性差别越大,腐蚀速率越快。 ④对同一种电解质溶液来说,电解质浓度越大,金属腐蚀越快。 (2)两种保护方法的比较 外加电流的阴极保护法保护效果大于牺牲阳极的阴极保护法。 考向二 析氢腐蚀和吸氧腐蚀 典例 2 如图各容器中盛有海水,铁会发生锈蚀,其中铁锈蚀的速度最快的是( ) A. B. C. D. 2.一定条件下,碳钢腐蚀与溶液 pH 的关系如下: pH 2 4 6 6.5 8 13.5 14 腐蚀快慢 较快 慢 较快 主要产物 Fe2+ Fe3O4 Fe2O3 2FeO 下列说法不正确的是 A.在 pH<4 溶液中,碳钢主要发生析氢腐蚀 B.在 pH>6 溶液中,碳钢主要发生吸氧腐蚀 C.在 pH>14 溶液中,碳钢腐蚀的正极反应为 O2+4H++4e- 2H2O D.在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会减缓 1.下列关于电解池的叙述中正确的是( ) A.电解池中的闭合回路仅是由电子的定向移动形成的 B.金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 C.在电解质溶液中,阴离子向阴极运动,阳离子向阳极运动 D.相同时间内,阳离子在阴极上得到的电子与阴离子在阳极上失去的电子数相等 2.关于下列各装置图的叙述不正确的是 A.用装置①精炼铜,则 b 极为精铜,电解质溶液为 CuSO4 溶液 B.装置②的总反应是 Cu+2Fe3+==Cu2++2Fe2+ C.装置③中钢闸门应与外接电源的负极相连 D.装置④中的铁钉几乎没被腐蚀 3.下列电化学装置及用途正确的是 A B C D 铜的精炼 铁上镀银 防止 Fe 被腐蚀 构成铜锌原电池 4.将金属 M 连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正 确的是 A.阴极的电极反应式为 2Fe 2e Fe B.金属 M 的活动性比 Fe 的活动性弱 C.钢铁设施表面因积累大量电子而被保护 D.钢铁设施在河水中的腐蚀速率比在海水中的快 5.在生产生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已经成为科学研究和技术领域的重 大问题。某化学兴趣小组的同学在实验室对金属腐蚀进行了探究。 (1)分别在三个洁净干燥的试管中各加入一个洁净无锈的铁钉,再向Ⅰ、Ⅱ号两个试管中分别加入经煮 沸迅速冷却的蒸馏水,然后向Ⅱ号试管中加入少量植物油,将Ⅲ号试管塞上木塞。请判断:________号 试管中的铁钉最容易生锈。由此可见,铁制品生锈需要的条件是________________。 (2)如图 2 所示,处于 A、B、C 三种不同环境中的铁片,被腐蚀的速率由大到小的顺序是________(用 字母表示)。 (3)据报道,全世界每年因为金属腐蚀造成的直接经济损失约达 7 000 亿美元,我国因金属腐蚀造成的 损失约占国民生产总值的 4%。 ①钢铁在发生电化学腐蚀时,负极反应为__________________。 ②请写出用稀硫酸除去铁锈的化学方程式:________________。 ③请根据不同的原理,提出防止钢铁腐蚀的两条合理措施:_______________、______________。 1.(2020·江苏卷)将金属 M 连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中, 下列有关说法正确的是 A.阴极的电极反应式为 2Fe 2e Fe B.金属 M 的活动性比 Fe 的活动性弱 C.钢铁设施表面因积累大量电子而被保护 D.钢铁设施在河水中的腐蚀速率比在海水中的快 2.[2019江苏]将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实 验。下列有关该实验的说法正确的是 A.铁被氧化的电极反应式为Fe−3e− Fe3+ B.铁腐蚀过程中化学能全部转化为电能 C.活性炭的存在会加速铁的腐蚀 D.以水代替NaCl溶液,铁不能发生吸氧腐蚀 3.[2018 北京]验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的 3%NaCl 溶液)。 ① ② ③ 在 Fe 表面生成蓝色沉淀 试管内无明显变化 试管内生成蓝色沉淀 下列说法不正确的是 A.对比②③,可以判定 Zn 保护了 Fe B.对比①②,K3[Fe(CN)6]可能将 Fe 氧化 C.验证 Zn 保护 Fe 时不能用①的方法 D.将 Zn 换成 Cu,用①的方法可判断 Fe 比 Cu 活泼 4.[2017 江苏][双选]下列说法正确的是 A.反应 N2(g)+3H2(g) 2NH3(g)的ΔH < 0,ΔS >0 B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 C.常温下,Ksp[Mg(OH)2]=5.6×10−12,pH=10 的含 Mg2+溶液中,c(Mg2+)≤5.6×10−4 mol·L−1 D.常温常压下,锌与稀 H2SO4 反应生成 11.2 L H2,反应中转移的电子数为 6.02×1023 5.[2017 新课标Ⅰ]支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示, 其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 6.[2015 上海]研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是 A.d 为石墨,铁片腐蚀加快 B.d 为石墨,石墨上电极反应为:O2 + 2H2O + 4e–→ 4OH– C.d 为锌块,铁片不易被腐蚀 D.d 为锌块,铁片上电极反应为:2H+ + 2e–→ H2↑查看更多