- 2021-05-22 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省泸县第五中学2020届高三下学期第四学月考试理综
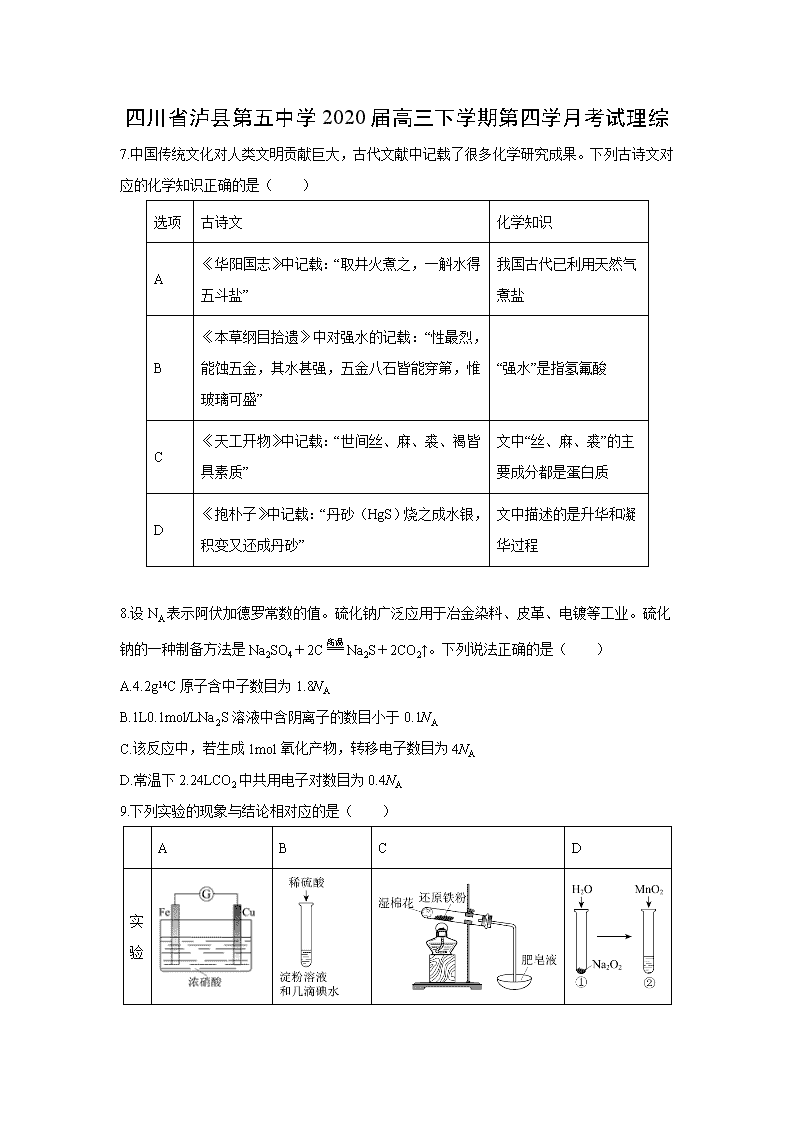
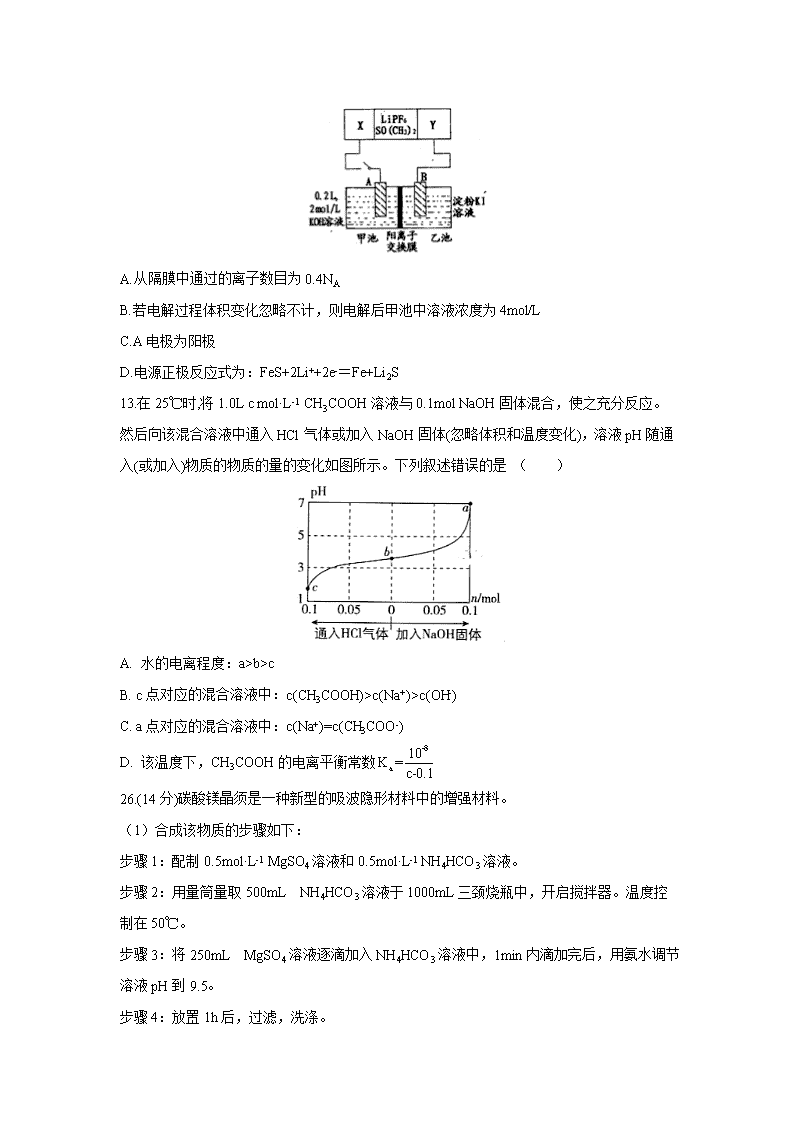
四川省泸县第五中学2020届高三下学期第四学月考试理综 7.中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。下列古诗文对应的化学知识正确的是( ) 选项 古诗文 化学知识 A 《华阳国志》中记载:“取井火煮之,一斛水得五斗盐” 我国古代已利用天然气煮盐 B 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,五金八石皆能穿第,惟玻璃可盛” “强水”是指氢氟酸 C 《天工开物》中记载:“世间丝、麻、裘、褐皆具素质” 文中“丝、麻、裘”的主要成分都是蛋白质 D 《抱朴子》中记载:“丹砂(HgS)烧之成水银,积变又还成丹砂” 文中描述的是升华和凝华过程 8.设NA表示阿伏加德罗常数的值。硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2CNa2S+2CO2↑。下列说法正确的是( ) A.4.2g14C原子含中子数目为1.8NA B.1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA C.该反应中,若生成1mol氧化产物,转移电子数目为4NA D.常温下2.24LCO2中共用电子对数目为0.4NA 9.下列实验的现象与结论相对应的是( ) A B C D 实验 现象 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 加热一段时间后溶液蓝色褪去 加热,肥皂液中产生无色气泡 ①和②中均迅速产生大量气泡 结论 铁片作负极,片刻后铜片作负极 淀粉在酸性条件下水解,产物是葡萄糖 铁粉与水蒸气反应生成H2 MnO2一定是②中反应的催化剂 10.已知 A、B、C、D、E 是短周期中原子序数依次增大的五种元素,A、B 形成的简单化合物常用作制冷剂,D 原子最外层电子数与最内层电子数相等,化合物 DC 中两种离子的电子层结构相同,A、B、C、D 的原子序数之和是 E 的两倍。下列说法正确的是 ( ) A.原子半径:C>B>A B.气态氢化物的热稳定性:E>C C.最高价氧化对应的水化物的酸性:B>E D.化合物 DC 与 EC2 中化学键类型相同 11.Fe3O4中含有Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程如图所示。下列说法正确的是 ( ) A.Pd作正极 B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用 C.反应过程中NO2-被Fe(Ⅱ)氧化为N2 D.用该法处理后水体的pH降低 12.已知高能锂电池的总反应式为:2Li+FeS=Fe+Li2S[LiPF6SO(CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H24.48L。下列有关叙述不正确的是( ) A.从隔膜中通过的离子数目为0.4NA B.若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4mol/L C.A电极为阳极 D.电源正极反应式为:FeS+2Li++2e-=Fe+Li2S 13.在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是 ( ) A. 水的电离程度:a>b>c B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-) C. a点对应的混合溶液中:c(Na+)=c(CH3COO-) D. 该温度下,CH3COOH的电离平衡常数 26.(14分)碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。 (1)合成该物质的步骤如下: 步骤1:配制0.5mol·L-1 MgSO4溶液和0.5mol·L-1 NH4HCO3溶液。 步骤2:用量筒量取500mL NH4HCO3溶液于1000mL三颈烧瓶中,开启搅拌器。温度控制在50℃。 步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。 步骤4:放置1h后,过滤,洗涤。 步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。 ①步骤2控制温度在50℃,较好的加热方法是_________。 ②步骤3生成MgCO3·nH2O沉淀的化学方程式为_______________________________。 ③步骤4检验沉淀是否洗涤干净的方法是________________。 (2)测定生成的MgCO3·nH2O中的n值。 称量1.000碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后将烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。 ①图中气球的作用是______________________________。 ②上述反应后期要升温到30℃,主要目的是___________________________。 ③测得每7.8000g碳酸镁晶须产生标准状况下CO2为1.12L,则n值为_______。 (3)碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中铁的含量,在实验室分别称取12.5g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用0.010mol/L H2O2溶液进行滴定。平行测定四组。消耗H2O2溶液的体积数据如表所示。 实验编号 1 2 3 4 消耗H2O2溶液体积/mL 15.00 15.02 15.62 14.98 ①H2O2溶液应装在_________(填“酸式”或“碱式”)滴定管中。 ②根据表中数据,可计算出菱镁矿中铁元素的质量分数为_________ %(保留小数点后两位)。 27.(14分)铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铵铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。 已知: Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似 Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13 (1)滤渣B的主要成分为____________(填化学式); (2)写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式___________________________; (3)MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式__________________________________________,若用浓HNO3溶解金属硫化物缺点是________________________________________________(任写一条); (4)从BeCl2溶液中得到BeCl2固体的操作是_____________________。 (5)溶液D中含c(Cu2+)=2.2mol•L-1、c(Fe3+)=0.008mol•L-1、c(Mn2+)=0.01mol•L-1,逐滴加入稀氨水调节pH可依次分离首先沉淀的是_________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于_________; (6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是______。 28.(15分)已知(Ⅰ)、(Ⅱ)反应在一定条件下焓变及平衡常数如下: 2H2(g)+S2(g)⇌2H2S(g) ΔH1 K1 (Ⅰ) 3H2(g)+SO2(g)⇌2H2O(g)+H2S(g) ΔH2 K2 (Ⅱ) (1)用ΔH1、ΔH2表示反应4H2(g)+2SO2(g)=S2(g)+4H2O(g)的ΔH=________。 (2)回答下列反应(Ⅰ)的相关问题: ①温度为T1,在1 L恒容容器中加入1.8 mol H2、1.2 mol S2,10 min时反应达到平衡。测得10 min内v(H2S)=0.08 mol·L-1·min-1,则该条件下的平衡常数为________。 ②温度为T2时(T2>T1),在1 L恒容容器中也加入1.8 mol H2、1.2 mol S2,建立平衡时测得S2的转化率为25%,据此判断ΔH1________0(填“>”或“<”),与T1时相比,平衡常数K1__(填“增大”“减小”或“不变”)。 (3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。 ①已知Na2SO3水溶液显碱性,原因是____________________________ _________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。 ②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的水解平衡常数=___________。 35.(15分)(化学——选修3:物质结构与性质) 2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题: (1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________,其中电子占据的轨道数为________个。 (2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________,羟基间的相互作用力为________。 (3)不同大小的苯芳烃能识别某些离子,如:、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。 (4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:___________________________________________________。 (5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于________晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_________________。 (6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示): 则一个C60分子中含有σ键的个数为________,C60晶体密度的计算式为________ g·cm-3。(NA为阿伏伽德罗常数的值) 36.(15分)H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下: 回答下列问题: (1)A的名称是_____________,H中官能团名称是________________; (2)反应①的反应条件为________________; (3)反应⑥的化学方程式为_______________________________________________;反应类型为___________________。 (4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为________________。 (5)符合下列条件的G的同分异构体有_______种。 I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰 (6)仿照H的合成路线,设计一种由B合成的合成路线________________________________________________________________________。 【参考答案】 7-13:ACACBCD 26.水浴加热 MgSO4+NH4HCO3+NH3▪H2O+(n-1)H2OMgCO3·nH2O↓+(NH4)2SO4 取最后一次洗涤液少许于试管中,加入稀盐酸,无明显现象,然后加入BaCl2溶液,若无白色沉淀,则沉淀已经洗涤干净 缓冲压强(或平衡压强),还可以起到封闭体系的作用 使广口瓶中溶解的CO2充分逸出,并被NaOH溶液充分吸收 4 酸式 0.13 27.CuS、FeS Na2BeO2+4HCl=BeCl2+2NaCl+2H2O 生成NO2污染空气 在氯化氢气流下蒸发结晶 Fe3+ 4 80% 28.2ΔH2-ΔH1 0.8 < 减小 SO32-+H2O⇌HSO3-+OH- > 10-6.8 35.1s22s22p63s23p63d1或[Ar]3d1 10 sp3 氢键 N≡C—S—S—C≡N 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥减弱,故H-N-H键角变大 分子 离子键、配位键、极性键 90 4×12×60×1030/(a3×NA) 36. 甲苯 酯基、溴原子 光照 取代反应 HOCH2CH2OH 4 查看更多