2019届一轮复习人教版化学能与热能学案(4)
第一节 化学能与热能
教材复习——打牢基础,基稳才能楼高
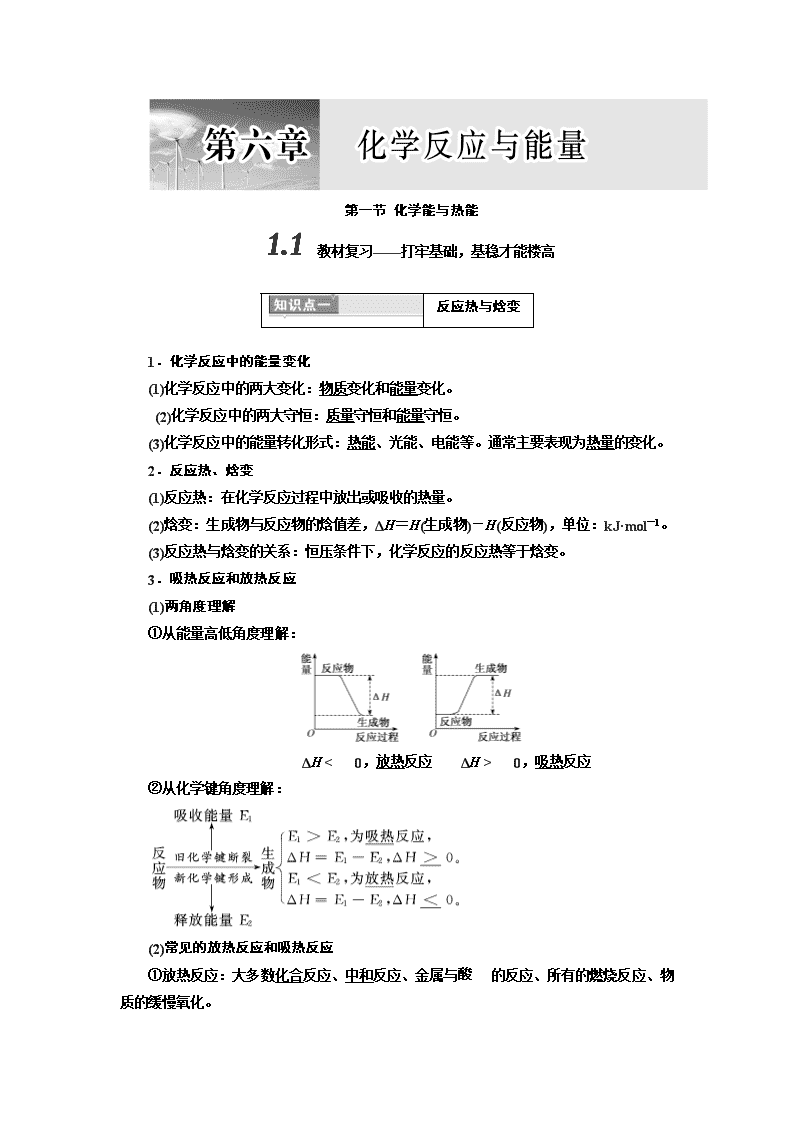
反应热与焓变
1.化学反应中的能量变化
(1)化学反应中的两大变化:物质变化和能量变化。
(2)化学反应中的两大守恒:质量守恒和能量守恒。
(3)化学反应中的能量转化形式:热能、光能、电能等。通常主要表现为热量的变化。
2.反应热、焓变
(1)反应热:在化学反应过程中放出或吸收的热量。
(2)焓变:生成物与反应物的焓值差,ΔH=H(生成物)-H(反应物),单位:kJ·mol-1。
(3)反应热与焓变的关系:恒压条件下,化学反应的反应热等于焓变。
3.吸热反应和放热反应
(1)两角度理解
①从能量高低角度理解:
ΔH0,放热反应 ΔH0,吸热反应
②从化学键角度理解:
(2)常见的放热反应和吸热反应
①放热反应:大多数化合反应、中和反应、金属与的反应、所有的燃烧反应、物质的缓慢氧化。
②吸热反应:大多数分解反应、盐类的水解反应、C与CO2反应、Ba(OH)2·8H2O和NH4Cl反应、C与H2O(g)反应。
4.反应热、活化能图示
(1)在无催化剂的情况,为正反应的活化能,为逆反应的活化能,ΔH=E1-E2。
(2)催化剂能降低反应的活化能,但不影响焓变的大小。
(1)化学反应的本质是旧化学键断裂和新化学键形成,任何化学反应都有热效应。
(2)需要加热才能进行的反应不一定是吸热反应,不需要加热就能进行的反应也不一定是放热反应。
[对点练习]
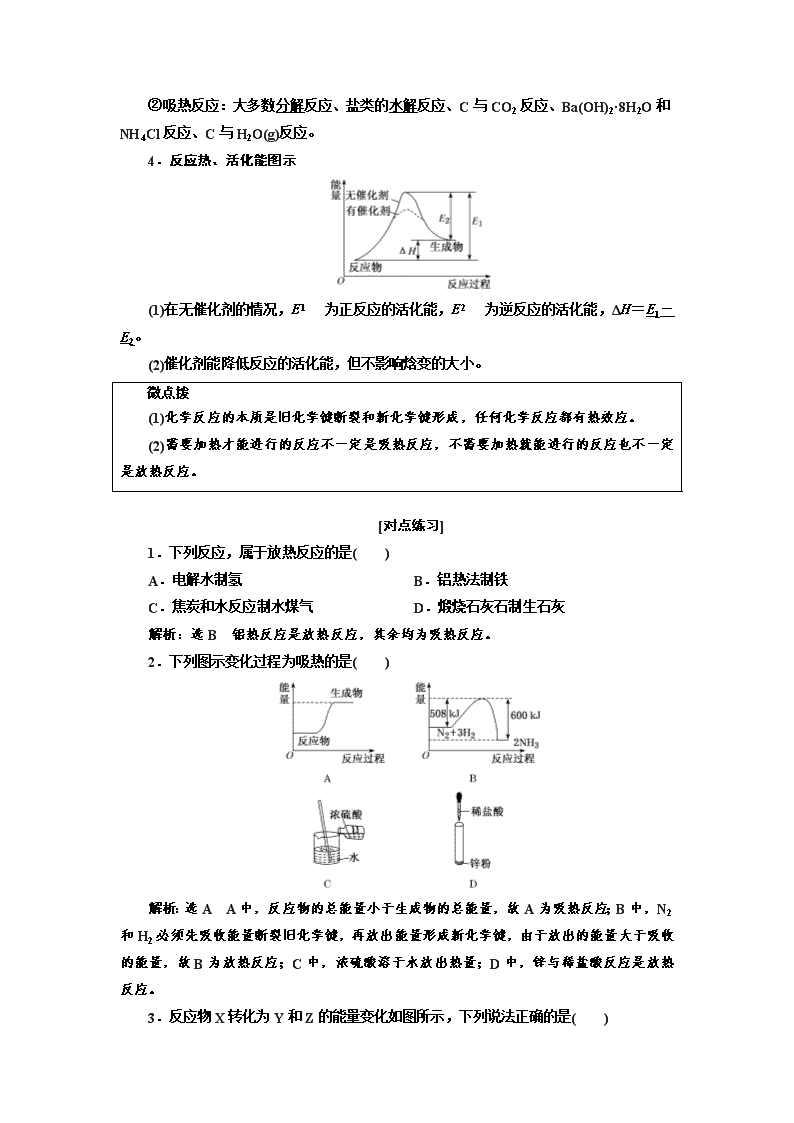
1.下列反应,属于放热反应的是( )
A.电解水制氢 B.铝热法制铁
C.焦炭和水反应制水煤气 D.煅烧石灰石制生石灰
解析:选B 铝热反应是放热反应,其余均为吸热反应。
2.下列图示变化过程为吸热的是( )
解析:选A A中,反应物的总能量小于生成物的总能量,故A为吸热反应;B中,N2和H2必须先吸收能量断裂旧化学键,再放出能量形成新化学键,由于放出的能量大于吸收的能量,故B为放热反应;C中,浓硫酸溶于水放出热量;D中,锌与稀盐酸反应是放热反应。
3.反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是( )
A.X→Y反应的ΔH=E5-E2
B.X→Z反应的ΔH>0
C.由图可知等物质的量的Y的能量一定比X的能量高
D.升高温度可提高X→Z的反应速率
解析:选D ΔH=生成物具有的总能量-反应物具有的总能量,由题图知X→Y反应的ΔH=E3-E2,A项错误;X→Z反应的ΔH=E1-E2<0,B项错误;由题图可知,2X(g)===3Y(g)为吸热反应,只能说明3 mol Y(g)的能量一定比2 mol X(g)的能量高,但不能得出等物质的量的Y的能量一定比X的能量高,C项错误;升高温度,化学反应速率加快,D项正确。
4.已知某反应A(g)+B(g)C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量__________(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH__________(填“增大”“减小”或“不变”)。
答案:(1)吸热 E1-E2 一定低 (2)减小 减小 不变
热化学方程式
1.热化学方程式及其意义
(1)概念:表示参加化学反应的物质的物质的量和反应热的关系的化学方程式。
(2)意义:表明了化学反应中的物质变化和能量变化。例如:H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1,表示在25 ℃和1.01×105 Pa下,1 mol H2和0.5 mol O2完全反应生成
1 mol液态水时放出285.8 kJ的热量。
2.热化学方程式的书写方法
(1)热化学方程式中物质的化学计量数仅表示该物质的物质的量,因此可以是整数,也可以是分数。
(2)热化学方程式的化学计量数改变n倍,反应热也改变n倍。
(3)可逆反应的ΔH表示完全反应的热量变化,与反应是否可逆无关。如N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,表示在101 kPa、25 ℃时,1 mol N2(g)和3 mol H2(g)完全反应生成2 mol NH3(g)时放出92.4 kJ的热量。
(4)反应逆向进行时,其焓变与正反应的数值相等,符号相反。
(5)与普通方程式的区别:一般不标注“↑”、“↓”以及反应条件等。
(6)同素异形体之间转化的热化学方程式除了注明状态外,还要注明名称。
[对点练习]
1.根据下列图像的叙述不正确的是( )
A.图(1)表示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1
B.图(2)表示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ·mol-1
C.由图可知正逆反应的热效应的数值相同
D.两个图像表示的含义不同
解析:选B 图(1)表示CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1,A正确;图(2)表示CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ·mol-1,B错误;由图知C正确;两个图像的反应物、生成物正好相反,D正确。
2.航天燃料从液态变为固态,是一项重要的技术突破。铍是高效率的火箭燃料,燃烧时放出巨大的能量,已知1 kg金属铍完全燃烧放出的热量为62 700 kJ。则铍燃烧的热化学方程式正确的是( )
A.Be+O2===BeO ΔH=-564.3 kJ·mol-1
B.Be(s)+O2(g)===BeO(s) ΔH=+564.3 kJ·mol-1
C.Be(s)+O2(g)===BeO(s) ΔH=-564.3 kJ·mol-1
D.Be(s)+O2(g)===BeO(g) ΔH=-564.3 kJ·mol-1
解析:选C 1 kg Be的物质的量为= mol,又因为1 kg铍完全燃烧放出的热量为62 700 kJ,则1 mol铍完全燃烧放出的热量为 kJ=564.3 kJ,Be与氧气反应生成BeO,则其热化学方程式为Be(s)+O2(g)===BeO(s) ΔH=-564.3 kJ·mol-1。
3.写出下列反应的热化学方程式。
(1)101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,表示H2燃烧热的热化学方程式为__________________________________________________________
________________________________________________________________________。
(2)0.3 mol乙硼烷(分子式B2H6)在氧气中燃烧,生成固体三氧化二硼和液体水,放出649.5 kJ的热量,则其热化学方程式为______________________________________________。
答案:(1)H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
(2)B2H6(g)+3O2(g)===B2O3(s)+3H2O(l)
ΔH=-2 165 kJ·mol-1
燃烧热和中和热 能源
1.燃烧热和中和热的比较
燃烧热
中和热
相同点
能量变化
放热
ΔH及其单位
ΔH<0,单位均为kJ·mol-1
不同点
反应物的量
可燃物的物质的量一定为1_mol
不一定为1 mol
生成物的量
不确定
生成水为 1_mol
反应热的含义
101 kPa 时,1_mol 纯物质完全燃烧生成稳定氧化物时所放出的热量
在稀溶液里,酸与碱发生中和反应生成 1_mol_水时所放出的热量
表示方法
燃烧热为ΔH=-a kJ·mol-1(a>0)
强酸与强碱反应的中和热为57.3 kJ·mol-1或ΔH=-57.3_kJ·mol-1
2.中和热的测定
(1)装置(请在横线上填写仪器名称)
(2)计算公式:ΔH=- kJ·mol-1
t1——起始温度,t2——终止温度。
(3)注意事项
①泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔热,减少实验过程中的热量损失。
②为保证酸完全中和,采取的措施是碱稍过量。
③因为弱酸或弱碱存在电离平衡,电离过程需要吸热,实验中若使用弱酸、弱碱则测得的数值偏小。
3.能源
(1)浓H2SO4稀释时放热,浓H2SO4与强碱溶液反应生成1 mol H2O时放出的热量大于57.3 kJ。
(2)当用热化学方程式表示中和热时,生成H2O的物质的量必须是1 mol,当用热化学方程式表示燃烧热时,可燃物的物质的量必须为1 mol。
[对点练习]
1.下列说法正确的是( )
A.强酸跟强碱的反应热一定是中和热
B.1 mol C完全燃烧放热383.3 kJ,其热化学方程式为
C+O2===CO2 ΔH=-383.3 kJ·mol-1
C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热
D.表示中和热的离子方程式为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
解析:选D 中和热是指在稀溶液中,强酸和强碱中和生成1 mol液态水和可溶性盐放出的热量,题中没有指明具体反应条件和生成水的物质的量,故A项、C项错误;书写热化学方程式时要特别注明反应物与生成物的状态,故B项错误;中和反应是放热反应,表示中和热的离子方程式中ΔH=-57.3 kJ·mol-1,故D项正确。
2.下列热化学方程式书写和表示正确的是(ΔH的绝对值均正确)( )
A.2SO2(g)+O2(g)2SO3(g)ΔH=-196 kJ·mol-1(反应热)
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1(燃烧热)
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.3 kJ·mol-1(中和热)
D.2NO2===O2+2NO ΔH=-116.2 kJ·mol-1(反应热)
解析:选A 二氧化硫与氧气反应生成三氧化硫是放热反应,焓变为负值,且标注了物质的聚集状态和反应焓变,符合热化学方程式的书写原则,故A项正确;燃烧热是1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,选项中生成的气态水不是稳定氧化物,故B项错误;酸碱中和反应是放热反应,焓变为负值,故C项错误;热化学方程式中物质的聚集状态未标注,故D项错误。
[基础过关练]
1.反应A+B―→C(ΔH<0)分两步进行①A+B―→X(ΔH>0) ②X―→C(ΔH<0),下列示意图中,能正确表示总反应过程中能量变化的是( )
解析:选B 由①A+B―→X ΔH>0知,X的能量高于(A+B)的能量,A、C不符合题意;由X―→C ΔH<0知,X的能量高于C的能量,D不符合题意。
2.一般硫粉含有S(单斜)和S(正交)两种同素异形体。已知常温下:
S(s,单斜)+O2(g)===SO2(g)ΔH=-297.16 kJ·mol-1
S(s,正交)+O2(g)===SO2(g)ΔH=-296.83 kJ·mol-1
下列说法错误的是( )
A.S(g)+O2(g)===SO2(g) ΔH<-297.16 kJ·mol-1
B.单斜硫转变为正交硫的能量变化可用如图表示
C.常温下正交硫比单斜硫稳定
D.单斜硫转化为正交硫的反应是放热反应
解析:选B 根据正交硫与单斜硫燃烧的热化学方程式可知单斜硫的能量高。气态硫变为固体,需要放出热量,则气态硫含有的能量高于硫粉的能量,故S(g)+O2(g)===SO2(g) ΔH<-297.16 kJ·mol-1,A正确;物质含有的能量越低,物质的稳定性就越强,所以常温下正交硫比单斜硫稳定,C正确;由于单斜硫的能量高于正交硫的能量,所以单斜硫转化为正交硫的反应是放热反应,D正确,B错误。
3.如图所示是298 K时N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
A.加入催化剂,不能改变该化学反应的反应热
B.b曲线是加入催化剂时的能量变化曲线
C.该反应的热化学方程式为N2(g)+3H2(g)2NH3(g)ΔH=-92 kJ·mol-1
D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92 kJ
解析:选D 根据图示可知加入催化剂,可以改变反应途径,降低反应的活化能,但是不能改变反应物、生成物的能量,也就不能改变该化学反应的反应热,A正确;a曲线是未加入催化剂时的能量变化曲线,b曲线是加入催化剂时的能量变化曲线,B正确;由于反应物的总能量比生成物的总能量高92 kJ,所以该反应的热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1,C正确;在温度、体积一定的条件下,通入1 mol N2和3 mol H2,由于该反应是可逆反应,反应物不能完全转化为生成物,所以反应后放出的热量小于92 kJ,D错误。
4.已知一定条件下断裂1 mol化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 247 kJ;H—Cl 434 kJ。下列所得热化学方程式或结论正确的是( )
A.H(g)+Cl(g)===HCl(g) ΔH=-434 kJ·mol-1
B.2HCl(g)===H2(g)+Cl2(g)的反应热ΔH<0
C.H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ
D.相同条件下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不相等
解析:选A H(g)+Cl(g)===HCl(g) ΔH=-434 kJ·mol-1,故A项正确;2HCl(g)===H2(g)+Cl2(g) ΔH=(434×2-436-247)kJ·mol-1=+185 kJ·mol-1,故B项错误;H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1,故C项错误;相同条件下,同一反应的ΔH与反应条件无关,故D项错误。
5.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,则下列说法正确的是( )
A.该反应的ΔH=(y-x)kJ·mol-1
B.断裂2 mol A—B键需要吸收y kJ能量,y kJ是该反应逆反应的活化能
C.2 mol AB(g)的总键能低于1 mol A2(g)和1 mol B2(g)的总键能
D.断裂1 mol A—A键和1 mol B—B键可放出x kJ的能量
解析:选B A2(g)+B2(g)===2AB(g)是放热反应,ΔH=(x-y)kJ·mol-1,故A项错误;由题图可知断裂2 mol A—B键需要吸收y kJ能量,y kJ是该反应逆反应的活化能,故B项正确;A2(g)+B2(g)===2AB(g)是放热反应,ΔH=反应物总键能-生成物总键能<0,故2 mol AB(g)的总键能高于1 mol A2(g)和1 mol B2(g)的总键能,故C项错误;化学键的断裂需要吸收能量,故D项错误。
6.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察图像,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的ΔH=________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是___________________________________
________________________________________________________________________。
解析:(1)根据图像可知反应物的总能量大于生成物的总能量,该反应为放热反应;该反应需要加热,使反应物分子变为活化分子,活化分子发生碰撞时才能发生化学反应;反应的焓变=生成物的总能量-反应物的总能量,即ΔH=E2-E1
。(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,反应的焓变=正反应的活化能-逆反应的活化能,由已知反应得其逆反应的活化能为167.2 kJ·mol-1+241.8 kJ·mol-1=409.0 kJ·mol-1。(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,最有可能的原因是使用了催化剂。
答案:(1)放热 需要 E2-E1 (2)409.0 kJ·mol-1
(3)使用了催化剂
高考研究——把握考情,方向不对努力白费
考 纲 要 求
高 频 考 点
1.了解化学反应中能量转化的原因及常见的能量转化形式。
2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义,能正确书写热化学方程式。
4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
5.了解焓变(ΔH)与反应热的含义。
6.理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。
1.热化学方程式的书写与正误判断
5年3考
2.反应热的计算与大小比较
5年5考
考点一 热化学方程式的书写与正误判断
[高考这样考]
1.(2014·海南高考)标准状况下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是( )
A.H2O(g)===H2(g)+O2(g) ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
解析:选D 1 mol H2O(g)分解产生1 mol H2和 mol O2的能量变化是2×463 kJ·mol-1-436 kJ·mol-1-×495 kJ·mol-1=242.5 kJ·mol-1,因此热化学方程式为H2O(g)===H2(g)+O2(g) ΔH=+242.5 kJ·mol-1,A、B错误;2 mol H2O分解产生2 mol H2和1 mol O2的能量变化则是+485 kJ,热化学方程式是2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1,C
错误,D正确。
2.(2017·全国卷Ⅰ节选)近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为____________________________、______________________________________________,制得等量H2所需能量较少的是____________。
解析:系统(Ⅰ)和系统(Ⅱ)都是吸热反应,从热化学方程式可以看出,系统(Ⅱ)制备1 mol H2需要消耗20 kJ能量,而系统(Ⅰ)制备1 mol H2需要消耗286 kJ能量,故系统(Ⅱ)消耗的能量较少。
答案:H2O(l)===H2(g)+O2(g)ΔH=+286 kJ·mol-1
H2S(g)===H2(g)+S(s) ΔH=+20 kJ·mol-1
系统(Ⅱ)
3.(2017·天津高考节选)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
解析:该还原性气体为CO,易水解生成TiO2·xH2O的液态化合物为TiCl4,反应的化学方程式为2Cl2(g)+TiO2(s)+2C(s)===TiCl4(l)+2CO(g),结合题意知ΔH=-×2=-85.6 kJ·mol-1。
答案:2Cl2(g)+TiO2(s)+2C(s)===TiCl4(l)+2CO(g)ΔH=-85.6 kJ·mol-1
4.(2017·北京高考节选)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华)
316
1 412
熔点/℃
-69
-25
193
304
714
在TiCl4中的溶解性
互溶
——
微溶
难溶
氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH2=-220.9 kJ·mol-1
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:________________________________________________________________________。
解析:根据盖斯定律,将已知的两个热化学方程式相加即可得到所求热化学方程式。
答案:TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g)ΔH=-45.5 kJ·mol-1
5.(2016·天津高考)Si与Cl两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃。写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
答案:Si(s)+2Cl2(g)===SiCl4(l)ΔH=-687 kJ·mol-1
6.(2014·全国卷)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
答案:AX3(l)+X2(g)===AX5(s)ΔH=-123.8 kJ·mol-1
7.(2014·天津高考)由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:_________________________________________________。
答案:SiCl4(g)+2H2(g)===Si(s)+4HCl(g)ΔH=+0.025a kJ·mol-1
[师说高考]
知
考
情
高考主要以非选择题的形式考查本部分内容。题目以生产、生活、科学技术和能源问题等社会热点为背景,将热化学方程式的书写和盖斯定律的计算融合在一起,较好地考查学生对知识的灵活应用能力和运用化学用语的能力
明
学
法
复习时,要认识热化学方程式与一般化学方程式的不同,清楚书写热化学方程式的要求和注意事项,熟记反应热、中和热、燃烧热的概念,通过比较明确它们的区别和联系,把握概念的内涵和外延,并能根据热化学方程式、盖斯定律进行相关计算
[过关这样练]
1.在一定条件下,将64 g二氧化硫气体氧化成三氧化硫气体时,实验测得放出的热量为78.64 kJ,已知二氧化硫在此条件下的转化率为80%。下列热化学方程式书写正确的是( )
A.SO2(g)+O2(g)===SO3(g) ΔH=-98.3 kJ·mol-1
B.2SO2(g)+O2(g)===2SO3(l) ΔH=-196.6 kJ·mol-1
C.SO2(g)+O2(g)===SO3(g) ΔH=-78.64 kJ·mol-1
D.2SO2(g)+O2(g)===2SO3(g) ΔH=+196.6 kJ·mol-1
解析:选A n(SO2)=1 mol,参加反应的有0.8 mol,放出的热量为78.64 kJ,若参加反应的SO2是1 mol,则放出的热量为98.3 kJ,A项正确。
2.下列热化学方程式书写正确的是( )
A.甲烷的燃烧热为-890 kJ·mol-1,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890 kJ·mol-1
B.在一定条件下将1 mol SO2和0.5 mol O2置于密闭容器中充分反应,放出热量79.2 kJ,则反应的热化学方程式为2SO2(g)+O2(g)2SO3(g)ΔH=-158.4 kJ·mol-1
C.NaOH(s)+H2SO4(浓)===Na2SO4(aq)+H2O(l)ΔH=-57.3 kJ·mol-1
D.2.00 g C2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6 kJ的热量,该反应的热化学方程式为
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-2 589.6 kJ·mol-1
解析:选D 该热化学方程式中水应为液态,A项错误;该反应为可逆反应,1 mol SO2和0.5 mol O2反应生成的SO3小于1 mol,故2SO2(g)+O2(g)2SO3(g) ΔH<-158.4 kJ·mol-1,B项错误;NaOH固体溶解、浓硫酸稀释均放热,故NaOH(s)与H2SO4(浓)反应的中和热大于57.3 kJ·mol-1,C项错误;2.00 g C2H2的物质的量是= mol,2 mol C2H2气体完全燃烧生成液态水和二氧化碳气体放出的热量为=2 589.6 kJ,D项正确。
3.依据能量图像完成下列热化学方程式问题
(1)下图是1 mol NO2和1 mol CO反应生成CO2
和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________________。
(2)化学反应N2+3H2===2NH3的能量变化如图所示(假设该反应反应完全)
试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:
________________________________________________________________________。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
答案:(1)NO2(g)+CO(g)===CO2(g)+NO(g)ΔH=-234 kJ·mol-1
(2)N2(g)+3H2(g)===2NH3(l)ΔH=-2(b+c-a)kJ·mol-1
(3)-139
考点二 反应热的计算与大小比较
[高考这样考]
1.(2014·全国卷Ⅱ)室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A.ΔH2>ΔH3 B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
解析:选B 1 mol CuSO4·5H2O(s)溶于水会使溶液温度降低,为吸热反应,故ΔH1>0,1 mol CuSO4(s)溶于水会使溶液温度升高,为放热反应,故 ΔH2<0,1 mol CuSO4·5H2O(s)溶于水可以分为两个过程,先分解成1 mol CuSO4(s)和5 mol水,然后1 mol CuSO4(s)再溶于水, CuSO4·5H2O的分解为吸热反应,即ΔH3>0,根据盖斯定律得到关系式ΔH1=ΔH2+ΔH3,分析得到答案:ΔH1<ΔH3。
2.(2017·全国卷Ⅱ节选)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
正丁烷(C4H10)脱氢制1丁烯(C4H8)的热化学方程式如下:
①C4H10(g)===C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+O2(g)===C4H8(g)+H2O(g)ΔH2=-119 kJ·mol-1
③H2(g)+O2(g)===H2O(g)ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。
解析:根据盖斯定律,由②式-③式可得①式,因此ΔH1=ΔH2-ΔH3=-119 kJ·mol-1+242 kJ·mol-1=+123 kJ·mol-1。
答案:+123
3.(2017·全国卷Ⅲ节选)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
已知:As(s)+H2(g)+2O2(g)===H3AsO4(s) ΔH1
H2(g)+O2(g)===H2O(l) ΔH2
2As(s)+O2(g)===As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)===2H3AsO4(s)的ΔH=____________。
解析:将已知热化学方程式依次编号为①、②、③,根据盖斯定律,由①×2-②×3-③可得:As2O5(s)+3H2O(l)===2H3AsO4(s) ΔH=2ΔH1-3ΔH2-ΔH3。
答案:2ΔH1-3ΔH2-ΔH3
4.(2017·海南高考节选)碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
已知:
①2NaOH(s)+CO2(g)===Na2CO3(s)+H2O(g)ΔH1=-127.4 kJ·mol-1
②NaOH(s)+CO2(g)===NaHCO3(s) ΔH2=-131.5 kJ·mol-1
反应2NaHCO3(s)===Na2CO3(s)+H2O(g)+CO2(g)的ΔH=________kJ·mol-1。
解析:根据盖斯定律,由①-2×②得,2NaHCO3(s)===Na2CO3(s)+H2O(g)+CO2(g) ΔH=-127.4 kJ·mol-1-2×(-131.5 kJ·mol-1)=+135.6 kJ·mol-1。
答案:+135.6
5.(2015·全国卷Ⅱ节选)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g) ΔH1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键
HH
CO
HO
CH
E/(kJ·mol-1)
436
343
1 076
465
413
由此计算ΔH1=__________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
解析:根据键能与反应热的关系可知,ΔH1=反应物的键能之和-生成物的键能之和=(1 076 kJ·mol-1+2×436 kJ·mol-1)-(413 kJ·mol-1×3+343 kJ·mol-1+465 kJ·mol-1)=-99 kJ·mol-1。根据盖斯定律,由②-①可得:CO2(g)+H2(g)CO(g)+H2O(g) ΔH3=ΔH2-ΔH1=(-58 kJ·mol-1)-(-99 kJ·mol-1)=+41 kJ·mol-1。
答案:-99 +41
[师说高考]
知
考
情
高考主要以生产、生活、科学技术和能源问题等社会热点为背景,将热化学方程式的书写和盖斯定律的计算融合在一起,较好地考查学生对知识的灵活应用和运算能力
明
学
法
复习本部分内容时,要清楚书写热化学方程式的要求和注意事项,理解盖斯定律的含义,把握利用盖斯定律计算反应热的关键是合理设计反应途径,正确加减热化学方程式
[备考这样办]
突破点1 反应热大小的比较
比较ΔH的大小时需考虑正负号,对放热反应,放热越多,ΔH越小;对吸热反应,吸热越多,ΔH越大。
(1)吸热反应的ΔH比放热反应的大(前者>0,后者<0)。
(2)产物相同时,同种气态物质燃烧放出的热量比等量的固态物质燃烧放出的热量多;
反应物相同时,生成同种液态物质放出的热量比生成等量的气态物质放出的热量多。
(3)生成等量的水时,强酸和强碱的稀溶液反应比弱酸和强碱(或弱碱和强酸,或弱酸和弱碱)的稀溶液反应放出的热量多。
(4)对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于相应热化学方程式中的反应热数值。
[对点训练]
1.(2018·湖南长沙模拟)已知:
(1)H2(g)+O2(g)===H2O(g) ΔH1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
(3)H2(g)+O2(g)===H2O(l) ΔH3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.a
d>0
C.2a=b<0 D.2c=d>0
解析:选C 氢气燃烧为放热反应,ΔH<0,气态水液化放出热量,故生成液态水放出的热量多,但ΔH小,故c0,CO与O2生成CO2的反应是放热反应,ΔH3<0,铁与氧气的反应是放热反应,ΔH4<0,A、B项错误;前两个方程式相减得:2CO(g)+O2(g)===2CO2(g) ΔH3=ΔH1-ΔH2,即ΔH1=ΔH2+ΔH3,C项正确;由4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4和6CO(g)+2Fe2O3(s)===6CO2(g)+4Fe(s) 2ΔH5相加,得2CO(g)+O2(g)===2CO2(g) ΔH3=(ΔH4+2ΔH5)/3,D项错误。
突破点2 利用键能计算ΔH
(1)计算公式:ΔH=反应物的键能总和-生成物的键能总和。
(2)根据键能计算反应热的关键是正确找出反应物和生成物所含共价键的数目,如H2O分子中含有2个(O—H)共价键,NH3分子中含有3个(N—H)共价键等。要注意特殊分子或晶体中化学键的数目,常见的有1 mol P4中含有6 mol P—P键,1 mol晶体硅中含有2 mol Si—Si键,1 mol石墨晶体中含有1.5 mol C—C键,1 mol金刚石中含有2 mol C—C键,1 mol SiO2中含有4 mol Si—O键等。
[对点训练]
3.已知:
C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H、O===O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.-332 B.-118 C.+350 D.+130
解析:选D 根据盖斯定律,由题给的两个热化学方程式可得:2H2O(g)===2H2(g)+O2(g) ΔH=+(2a+220)kJ·mol-1,则有:4×462 kJ·mol-1-2×436 kJ·mol-1-496 kJ·mol-1=(2a+220)kJ·mol-1,解得a=+130,故选项D正确。
4.(2015·全国卷Ⅰ节选)已知反应2HI(g)H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为________kJ。
解析:设1 mol HI(g)分子中化学键断裂吸收的能量为x,则2x-436 kJ-151 kJ=+11 kJ,x=299 kJ。
答案:299
5.(2018·杭州市重点中学过关卷)乙苯催化脱氢制苯乙烯反应:
已知:
化学键
C—H
C—C
C===C
H—H
键能/(kJ·mol-1)
412
348
612
436
计算上述反应的ΔH=________kJ·mol-1。
解析:制备苯乙烯需断开2 mol C—H键,生成1 mol H—H键,同时在C—C键的基础上生成C===C键,因此生成1 mol苯乙烯吸收的热量为2×412 kJ=824 kJ,放出的热量为436 kJ+(612-348)kJ=700 kJ,根据反应热的定义可知,ΔH=824 kJ·mol-1—700 kJ·mol-1=124 kJ·mol-1。
答案:+124
突破点3 利用盖斯定律计算ΔH
(1)盖斯定律
化学反应不管是一步完成还是分几步完成,其反应热是相同的,即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(2)应用五步骤
[对点训练]
6.已知:①2O2(g)+N2(g)===N2O4(l) ΔH1
②N2(g)+2H2(g)===N2H4(l) ΔH2
③O2(g)+2H2(g)===2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g)
ΔH4=-1 048.9 kJ·mol-1
上述反应热效应之间的关系式为ΔH4=________,联氨和N2O4可作为火箭推进剂的主要原因为__________________________________________________________________
________________________________________________________________________。
解析:由已知热化学方程式①②③可得:
N2O4(l)===2O2(g)+N2(g) -ΔH1
2N2H4(l)===2N2(g)+4H2(g) -2ΔH2
2O2(g)+4H2(g)===4H2O(g) 2ΔH3
根据盖斯定律,将上述三个热化学方程式相加,可得2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=2ΔH3-2ΔH2-ΔH1。由热化学方程式可知,N2H4和N2O4反应时放出大量的热,且产生大量气体。
答案:2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体
7.(2018·山东实验中学练兵)已知下列反应:
SO2(g)+2OH-(aq)===SO(aq)+H2O(l) ΔH1
ClO-(aq)+SO(aq)===SO(aq)+Cl-(aq) ΔH2
CaSO4(s)===Ca2+(aq)+SO(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=________。
解析:将题给三个热化学方程式分别标号为Ⅰ、Ⅱ、Ⅲ,根据盖斯定律,由Ⅰ+Ⅱ-Ⅲ可得:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq),则有ΔH=ΔH1+ΔH2-ΔH3。
答案:ΔH1+ΔH2-ΔH3
8.(2017·武汉诊断)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为________。
解析:①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3 kJ·mol-1,
②H2(g)+O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1,
③CO(g)+O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1,
根据盖斯定律,①-2×②-2×③得:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=-890.3 kJ·mol-1+2×285.8 kJ·mol-1+2×283.0 kJ·mol-1=+247.3 kJ·mol-1,即生成1 mol CO需吸收能量=123.65 kJ,因此生成1 m3(标准状况)CO所需能量:×123.65 kJ·mol-1≈5 520 kJ=5.52×103 kJ。
答案:5.52×103 kJ
[课堂即时练]
1.已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1,则HCN在水溶液中电离的ΔH等于( )
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1
C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
解析:选C 反应的热化学方程式分别为
①HCN(aq)+OH-(aq)===CN-(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;②H+(aq)+OH-(aq)===H2O(l) ΔH=-55.6 kJ·mol-1
根据盖斯定律,由①-②可得HCN电离的热化学方程式为HCN(aq)H+(aq)+CN-(aq) ΔH=-12.1 kJ·mol-1-(-55.6 kJ·mol-1)=+43.5 kJ·mol-1。
2.(2018·马鞍山二中月考)根据热化学方程式:S(l)+O2(g)===SO2(g) ΔH=-293.23 kJ·mol-1,分析下列说法中正确的是( )
A.S(s)+O2(g)===SO2(g) ΔH<-293.23 kJ·mol-1
B.S(g)+O2(g)===SO2(g) ΔH>-293.23 kJ·mol-1
C.1 mol SO2(g)的键能总和大于1 mol S(l)和1 mol O2(g)的键能之和
D.1 mol SO2(g)的键能总和小于1 mol S(l)和1 mol O2(g)的键能之和
解析:选C 因物质由液态转变成固态要放出热量,所以S(s)+O2(g)===SO2(g) ΔH>-293.23 kJ·mol-1,A项错误;因物质由液态转变成气态要吸收热量,所以S(g)+O2(g)===SO2(g) ΔH<-293.23 kJ·mol-1,B项错误;由题意知,该反应为放热反应,放热反应中反应物总键能小于生成物总键能,C项正确,D项错误。
3.根据键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为( )
化学键
C—H
C—F
H—F
F—F
键能/(kJ·mol-1)
414
489
565
155
A.-485 kJ·mol-1 B.+485 kJ·mol-1
C.+1 940 kJ·mol-1 D.-1 940 kJ·mol-1
解析:选D ΔH=反应物的键能总和-生成物的键能总和=414 kJ·mol-1×4+155 kJ·mol-1×4-489 kJ·mol-1×4-565 kJ·mol-1×4=-1 940 kJ·mol-1。
4.(2018·太原五中月考)燃烧a g C2H5OH(l),生成二氧化碳气体和液态水,放出的热量为Q kJ,经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则表示乙醇燃烧的热化学方程式是( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-20Q kJ·mol-1
B.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-40Q kJ·mol-1
C.C2H5OH(l)+O2(g)===CO2(g)+H2O(g)ΔH=-20Q kJ·mol-1
D.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-40Q kJ·mol-1
解析:选B 由关系式:CaCO3~CO2~C2H5OH可知,a g乙醇的物质的量为n(CaCO3)=0.025 mol,所以1 mol C2H5OH(l)燃烧生成二氧化碳气体和液态水,放出的热量是40Q kJ,热化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-40Q kJ·mol-1
。
5.(2018·滨州模拟)已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)
ΔH=-24.8 kJ·mol-1
Fe2O3(s)+CO(g)===Fe3O4(s)+CO2(g)
ΔH=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH=+640.4 kJ·mol-1
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时的反应热约为( )
A.-218 kJ·mol-1 B.-109 kJ·mol-1
C.+218 kJ·mol-1 D.+109 kJ·mol-1
解析:选B 该问题可以转化为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=?所以,若把已知的3个热化学方程式按顺序编号为①、②、③,根据盖斯定律,由[(①-②)×-③2]×即可得到目标热化学方程式,ΔH=[(-24.8+15.73)×3/2-640.4]×1/6 kJ·mol-1=-109 kJ·mol-1。
6.已知:
2H2(g)+O2(g)===2H2O(g) ΔH1
H2(g)+Cl2(g)===2HCl(g) ΔH2
4HCl(g)+O2(g)===2Cl2(g)+2H2O(g) ΔH3
N2(g)+3H2(g)2NH3(g) ΔH4
2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH2>0 B.ΔH3>0,ΔH4>0
C.ΔH2=ΔH4+ΔH5 D.ΔH3=ΔH1-2ΔH2
解析:选D 2H2(g)+O2(g)===2H2O(g)属于放热反应,ΔH1<0;H2(g)+Cl2(g)===2HCl(g)属于放热反应,ΔH2<0;4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)属于放热反应,ΔH3<0;N2(g)+3H2(g)2NH3(g)属于放热反应,ΔH4<0,A、B错误;根据盖斯定律,ΔH2=(ΔH4+ΔH5)×,C错误;根据盖斯定律,ΔH3=ΔH1-2ΔH2,D正确。
7.依据事实写出下列反应的热化学方程式。
(1)1 g碳与适量水蒸气反应生成CO和H2,需要吸收10.94 kJ热量,此反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)已知2.0 g燃料肼(N2H4)气体完全燃烧生成N2和水蒸气时,放出33.4 kJ的热量,则表示肼燃烧的热化学方程式为____________________________________________
________________________________________________________________________。
(3)2 mol Al(s)与适量O2(g)反应生成Al2O3(s),放出1 669.8 kJ的热量。此反应的热化学方程式为__________________________________________________________________
________________________________________________________________________。
(4)2.3 g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7 g液态水和2.24 L CO2(标准状况)并放出68.35 kJ的热量。写出此反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
解析:(1)1 g( mol)碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,则碳与水蒸气反应的热化学方程式为C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.28 kJ·mol-1。(2)2.0 g( mol)肼气体在氧气中完全燃烧生成氮气和水蒸气时放出33.4 kJ热量,则表示肼燃烧的热化学方程式为N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.4 kJ·mol-1。(3)2 mol Al(s)与适量O2(g)反应生成Al2O3(s),放出1 669.8 kJ的热量,则此反应的热化学方程式为4Al(s)+3O2(g)===2Al2O3(s) ΔH=-1 669.8 kJ·mol-1×2=-3 339.6 kJ·mol-1。(4)通过燃烧的产物可知该有机物中肯定含有碳元素和氢元素,可能含有氧元素。n(H2O)==0.15 mol,n(H)=0.3 mol,m(H)=0.3 g,n(CO2)==0.1 mol,n(C)=0.1 mol,m(C)=1.2 g,则碳元素和氢元素的质量之和是0.3 g+1.2 g=1.5 g<2.3 g,故该有机物中还含有氧元素,氧元素的质量是2.3 g-1.5 g=0.8 g,n(O)=0.05 mol,从而可确定该有机物的分子式为C2H6O,该液态有机物为C2H5OH(l),故该反应的热化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-1 367 kJ·mol-1。
答案:(1)C(s)+H2O(g)===CO(g)+H2(g)ΔH=+131.28 kJ·mol-1
(2)N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.4 kJ·mol-1
(3)4Al(s)+3O2(g)===2Al2O3(s)ΔH=-3 339.6 kJ·mol-1
(4)C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-1 367 kJ·mol-1
8.(2018·临汾一中月考)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。
(1)已知:
Cu(s)+2H+(aq)===Cu2+(aq)+H2(g)
ΔH=+64.39 kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g)ΔH=-196.46 kJ·mol-1
H2(g)+O2(g)===H2O(l)ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)对含氮物质的研究和利用有着极为重要的意义。
N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)===2NO(g)ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)===2NH3(g)ΔH=-92.4 kJ·mol-1
则氨的催化氧化反应的热化学方程式为____________________________________
________________________________________________________________________。
(4)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。反应的化学方程式为2NO(g)+2CO(g)N2(g)+2CO2(g)。
已知部分化学键的键能如下:
分子式/结构式
NO/N≡O
CO/C≡O
CO2/O===C===O
N2/N≡N
化学键
N≡O
C≡O
C===O
N≡N
键能/kJ·mol-1
632
1 072
750
946
请计算上述反应的ΔH=____________kJ·mol-1。
解析:(1)将题给已知三个热化学方程式依次编号为反应①、②、③,根据盖斯定律,①+×②+③得Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH=+64.39 kJ·mol-1+×(-196.46 kJ·mol-1)+(-285.84 kJ·mol-1)=-319.68 kJ·mol-1。(2)将已知的两个热化学方程式相加后再乘,就可以得到相应的热化学方程式:CH4(g)+2NO2(g)===CO2(g)+2H2O(g)+N2(g)ΔH=-867 kJ·mol-1。
(3)把已知方程式依次编号为①、②、③,依据盖斯定律,由②×3-③×2+①×2得到:4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=-905 kJ·mol-1。
(4)化学反应的焓变等于反应物旧键断裂吸收的总能量和产物中新键形成释放的总能量之差,所以2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH=(632×2+1 072×2)kJ·mol-1-(946+750×4)kJ·mol-1=-538 kJ·mol-1。
答案:(1)Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH=-319.68 kJ·mol-1
(2)CH4(g)+2NO2(g)===CO2(g)+2H2O(g)+N2(g)ΔH=-867 kJ·mol-1
(3)4NH3(g)+5O2(g)===4NO(g)+6H2O(g)ΔH=-905 kJ·mol-1
(4)-538
[课下达标练]
1.下列既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与水蒸气的反应
D.甲烷(CH4)在O2中的燃烧反应
解析:选C 铝片与稀盐酸之间的置换反应、甲烷(CH4)在O2中的燃烧反应既是氧化还原反应,又是放热反应;灼热的炭与水蒸气发生的氧化还原反应是吸热反应;Ba(OH)2·8H2O与NH4Cl 之间发生的复分解反应是吸热反应。
2.某反应由两步反应ABC构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是( )
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应中ΔH=E1-E4
解析:选B A―→B的反应为吸热反应,B―→C的反应为放热反应,A错误;物质的能量越低,越稳定,B正确;加入催化剂,只改变反应的活化能,不改变焓变,C错误;整个反应中ΔH=(E1+E3)-(E2+E4),D错误。
3.已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
2H2(g)+O2(g)===2H2O(g) ΔH2
C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为( )
A.12ΔH3+5ΔH2-2ΔH1 B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
解析:选A 将题给的3个热化学方程式依次编号为①、②、③,根据盖斯定律,由12×③+5×②-2×①,可得4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g) ΔH=12ΔH3+5ΔH2-2ΔH1,故A项正确。
4.(2018·郑州一中月考)下列有关热化学方程式的表示及说法正确的是( )
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.含20.0 g NaOH的稀溶液与稀硫酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
D.已知I2(g)+H2(g)===2HI(g) ΔH1,
I2(s)+H2(g)===2HI(g) ΔH2,则ΔH1>ΔH2
解析:选C 燃烧热是指1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,氢气完全燃烧,生成的稳定氧化物是指液态水,A错误;石墨转化为金刚石是吸热反应,说明石墨的能量低,所以石墨稳定,B错误;中和热是指稀溶液中强酸与强碱反应生成1 mol液态水和易溶性盐时放出的热量,C正确;碘蒸气变为碘固体,会放出热量,所以碘蒸气与氢气反应放出的热量多,则ΔH1<ΔH2,D错误。
5.(2018·滕州二中月考)由金红石TiO2制取单质Ti,涉及的步骤为:TiO2―→TiCl4Ti。已知:
①C(s)+O2(g)===CO2(g) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH为( )
A.ΔH3+2ΔH1-2ΔH2 B.ΔH3+ΔH1-ΔH2
C.ΔH3+2ΔH1-ΔH2 D.ΔH3+ΔH1-2ΔH2
解析:选C 根据盖斯定律,由2×①-②+③,可得TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g) ΔH=2ΔH1-ΔH2+ΔH3,故C项正确。
6.我国发射“神十一”所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534 kJ·mol-1
下列关于肼和NO2反应的热化学方程式正确的是( )
A.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l)ΔH=-1 135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g)===2N2(g)+4H2O(g)ΔH=-1 135.7 kJ·mol-1
C.N2H4(g)+NO2(g)===N2(g)+2H2O(g)ΔH=-1 135.7 kJ·mol-1
D.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g)ΔH=-1 135.7 kJ·mol-1
解析:选D 根据盖斯定律,由②×2-①,可得2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g) ΔH=-534 kJ·mol-1×2-67.7 kJ·mol-1=-1 135.7 kJ·mol-1,故D项正确。
7.(2018·山西重点中学联考)肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O===O为500、N—N为154,O—H为452.5,则断裂1 mol N—H所需的能量(kJ)是( )
A.194 B.391
C.516 D.658
解析:选B ΔH=反应物的总键能-生成物的总键能,由图可知N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1。设断裂1 mol N—H所需能量为x kJ,则154 kJ+4x kJ+500 kJ-(942+2×2×452.5)kJ=-534 kJ,解得x=391。
8.氢气、铝、铁都是重要的还原剂。已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是( )
2H2(g)+O2(g)===2H2O(g) ΔH1
3H2(g)+Fe2O3(s)===2Fe(s)+3H2O(g) ΔH2
2Fe(s)+O2(g)===Fe2O3(s) ΔH3
2Al(s)+O2(g)===Al2O3(s) ΔH4
2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5
A.ΔH1<0 ΔH3>0 B.ΔH5<0 ΔH4<ΔH3
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
解析:选B 将题给的5个热化学方程式依次编号为①、②、③、④、⑤,其中①、③分别表示H2、Fe燃烧的热化学方程式,燃烧均为放热反应,则ΔH1<0,ΔH3<0,故A项错误;铝热反应为放热反应,故ΔH5<0;根据盖斯定律,由④-③
可得:2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5=ΔH4-ΔH3<0,则ΔH4<ΔH3,故B项正确;根据盖斯定律,由(②+③)×可得:2H2(g)+O2(g)===2H2O(g) ΔH1=(ΔH2+ΔH3),故C项错误;ΔH5=ΔH4-ΔH3,则ΔH3=ΔH4-ΔH5,故D项错误。
9.(2017·江苏高考)通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH= kJ·mol-1
D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d)kJ·mol-1
解析:选C 反应①的产物为CO和H2,反应②的产物为CO2和H2,反应③的原料为CO2和H2,A项正确;反应③将温室气体CO2转化为燃料CH3OH,B项正确;反应④中生成物H2O为气体,C项中生成物H2O为液体,故C项中反应的焓变不等于 kJ·mol-1,C项错误;依据盖斯定律,由②×2+③×2+④,可得所求反应的焓变,D项正确。
10.在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+O2(g)===SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)===S2(g)+2H2O(g) ΔH2
H2S(g)+O2(g)===S(g)+H2O(g) ΔH3
2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=(ΔH1+ΔH2-3ΔH3)
B.ΔH4=(3ΔH3-ΔH1-ΔH2)
C.ΔH4=(ΔH1+ΔH2-3ΔH3)
D.ΔH4=(ΔH1-ΔH2-3ΔH3)
解析:选A 将题给的4个热化学方程式依次编号为①、②、③、④,根据盖斯定律,④=(①+②)×-③×2,故ΔH4=(ΔH1+ΔH2-3ΔH3),A项正确。
11.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g)
ΔH=x kJ·mol-1
已知:碳的燃烧热ΔH1=a kJ·mol-1
S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1
则x为( )
A.3a+b-c B.c-3a-b
C.a+b-c D.c-a-b
解析:选A 碳燃烧的热化学方程式为①C(s)+O2(g)===CO2(g) ΔH1=a kJ·mol-1,将另外两个热化学方程式进行编号,②S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1,③2K(s)+N2(g)+3O2(g)===2KNO3(s)
ΔH3=c kJ·mol-1,根据盖斯定律,由①×3+②-③得S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g)
ΔH=(3a+b-c)kJ·mol-1,则x=3a+b-c,故A正确。
12.(1)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:
2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq) ΔH1
反应Ⅱ:
NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________________________________________________________________________。
(2)由磷灰石[主要成分为Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)===3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
已知相同条件下:
①4Ca5(PO4)3F(s)+3SiO2(s)===6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
②2Ca3(PO4)2(s)+10C(s)===P4(g)+6CaO(s)+10CO(g) ΔH2
③SiO2(s)+CaO(s)===CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=__________。
(3)在图甲和图乙中出现的所有物质都为气体,分析图甲和图乙,可推测:4NO(g)+3O2(g)===2N2O5(g) ΔH=__________。
解析:(1)根据盖斯定律可得出,将“反应Ⅱ×2-反应Ⅰ”,即得反应Ⅲ,所以ΔH3=2ΔH2-ΔH1。
(2)由磷灰石制黄磷的反应,可由①+②×3+③×18得到,则ΔH=ΔH1+ΔH2×3+ΔH3×18。
(3)由图像可知:NO(g)+O2(g)===NO2(g) ΔH=143 kJ·mol-1-287 kJ·mol-1=-144 kJ·mol-1①,4NO2(g)+O2(g)===2N2O5(g) ΔH=372 kJ·mol-1-583 kJ·mol-1=-211 kJ·mol-1②,将①×4+②即可得到目标反应,根据盖斯定律可算出该反应的反应热ΔH=4×(-144 kJ·mol-1)+(-211 kJ·mol-1)=-787 kJ·mol-1。
答案:(1)2ΔH2-ΔH1 (2)ΔH1+3ΔH2+18ΔH3
(3)-787 kJ·mol-1
13.(2018·长沙一中月考)(1)丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题。
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:
________________________________________________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1
C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)
ΔH3=-Q3 kJ·mol-1
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为__________ kJ。
②碳在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有______________。
解析:(1)①通过题图可知反应物的总能量大于生成物的总能量,则丙烷完全燃烧生成CO2和1 mol H2O(l)的过程放热,ΔH为“-”。②燃烧热是101 kPa时,1 mol物质完全燃烧生成稳定氧化物时放出的热量,所以表示丙烷燃烧热的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 215.0 kJ·mol-1。③n(二甲醚)×1 455 kJ·mol-1+[1 mol-n(二甲醚)]×2 215.0 kJ·mol-1=1 645 kJ,解得n(二甲醚)=0.75 mol,n(丙烷)=0.25 mol。
(2)①将题中已知三个化学方程式分别标为Ⅰ、Ⅱ、Ⅲ,由Ⅰ×3+Ⅲ-Ⅱ可得C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH4=-(3Q1-Q2+Q3)kJ·mol-1,所以使46 g液态无水酒精完全燃烧,并恢复到室温,整个过程中放出的热量为(3Q1-Q2+Q3)kJ。②利用盖斯定律计算反应C(s)+O2(g)===CO(g)的ΔH,需要测得的实验数据有碳和CO的燃烧热。
答案:(1)①-
②C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)ΔH=-2 215.0 kJ·mol-1
③1∶3
(2)①3Q1-Q2+Q3 ②碳和CO的燃烧热
14.随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系,若①变化是置换反应,则其化学方程式可以是____________________(合理即可)。
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)===CO2(g) ΔH1<0①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)===2CO2(g) ΔH3<0③
2H2(g)+O2(g)===2H2O(g) ΔH4<0④
则途径Ⅰ放出的热量__________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是__________。
(3)甲醇是一种可再生能源,开发和应用前景广阔,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)CH3OH(g)
方法二 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1 g甲醇完全燃烧放热22.68 kJ,写出表示甲醇燃烧热的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s) ΔH=-235.8 kJ·mol-1
已知:2Ag2O(s)===4Ag(s)+O2(g)ΔH=+62.2 kJ·mol-1
则O3转化为O2的热化学方程式为_________________________________________
________________________________________________________________________。
解析:(1)反应①是由C通过置换反应生成CO,则其化学方程式可以是C+H2O(g)H2+CO。(2)由盖斯定律可知,反应热只与反应体系的始态和终态有关,而与反应途径无关,故途径Ⅰ放出的热量等于途径Ⅱ放出的热量;根据盖斯定律,①=②+×③+×④,故ΔH1=ΔH2+(ΔH3+ΔH4)。(3)25 ℃、101 kPa下,1 g( mol)甲醇完全燃烧放热22.68 kJ,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1。(4)将题给的两个热化学方程式依次编号为①、②,根据盖斯定律,由①×2+②×3可得:2O3(g)===3O2(g) ΔH=-285.0 kJ·mol-1。
答案:(1)C+H2O(g)H2+CO
(2)等于 ΔH1=ΔH2+(ΔH3+ΔH4)
(3)CH3OH(l)+O2(g)===CO2(g)+2H2O(l)ΔH=-725.76 kJ·mol-1
(4)2O3(g)===3O2(g) ΔH=-285.0 kJ·mol-1