- 2021-05-21 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】贵州省铜仁第一中学2020届高三下学期防疫期间“停课不停学”网上周考(四)(解析版)
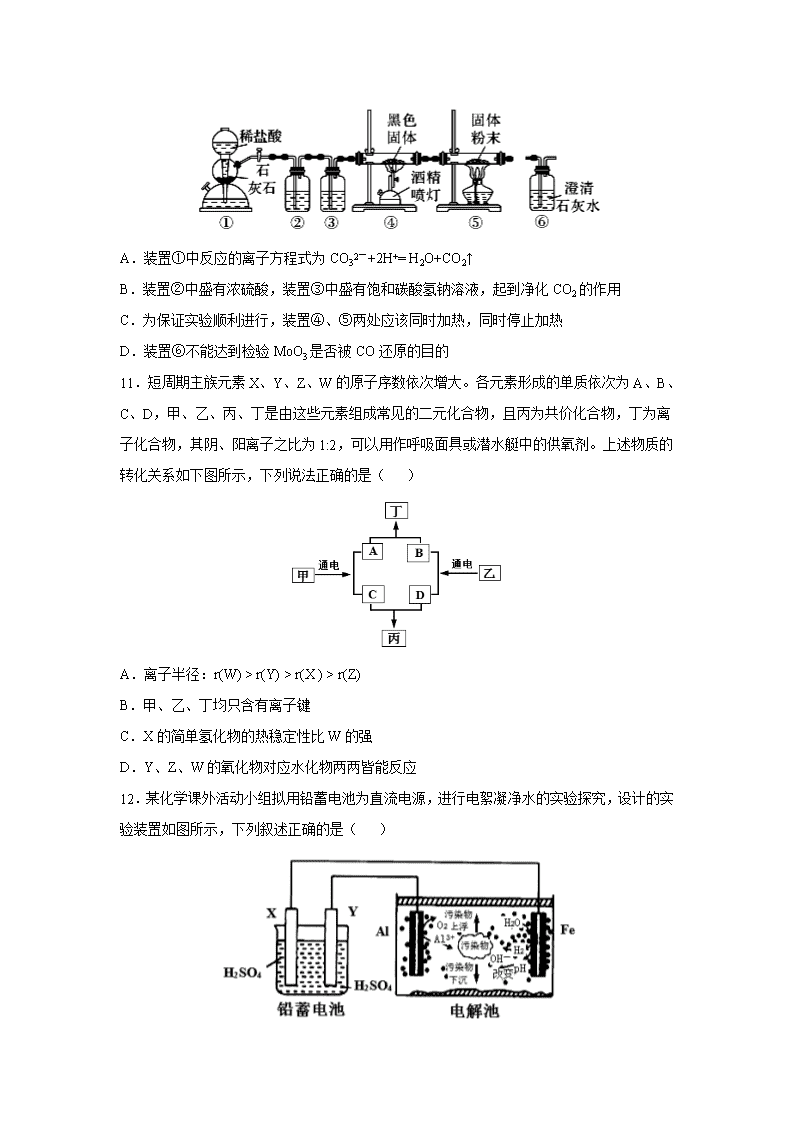
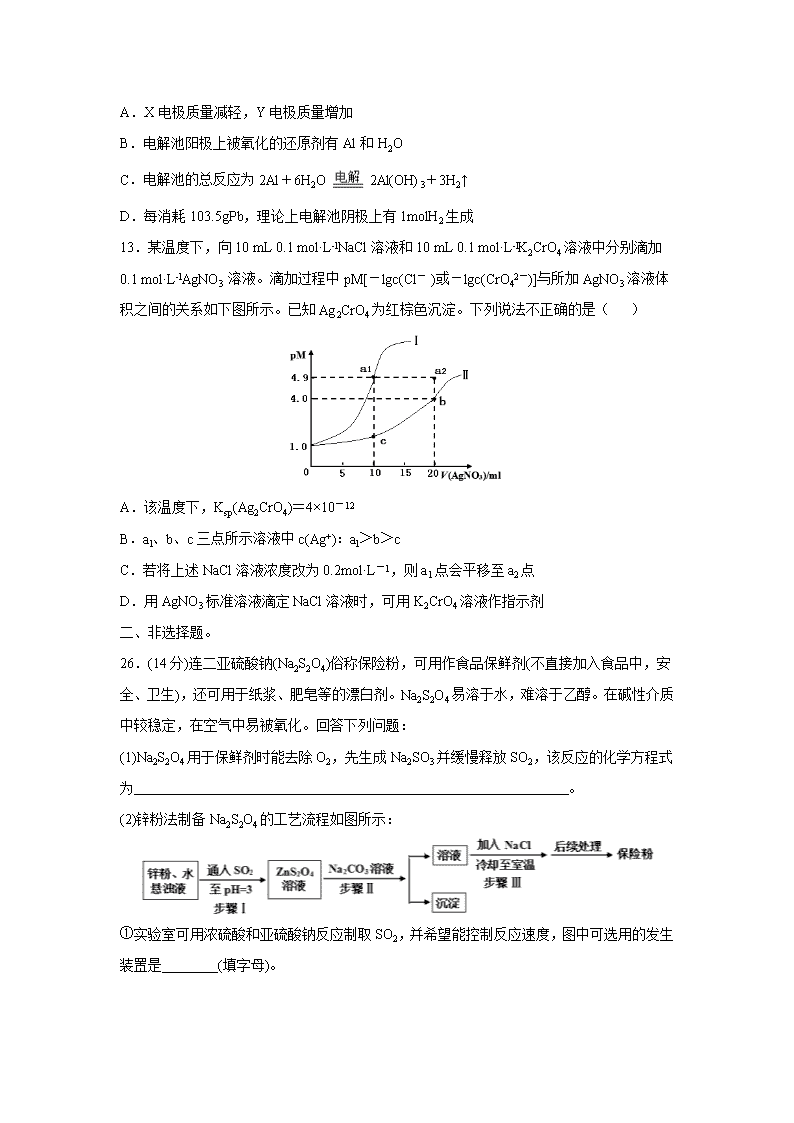
贵州省铜仁第一中学2020届高三下学期防疫期间“停课不停学”网上周考(四) 可能用到的相对原子质量:H-1 C-12 O-16 B-11 P-31 S-32 Na-23 Cu-64 Pd-207 一、选择题。 7.化学与生活、社会发展息息相关,下列有关叙述正确的是( ) A.《己亥杂诗》中 “ 落红不是无情物,化作春泥更护花 ”蕴藏着自然界碳、氮的循环 B.PM2.5是指大气中直径接近2.5×10-6 m的颗粒物,分散在空气中形成胶体 C.大量使用含丙烷、二甲醚等辅助成分的“空气清新剂”,不会对环境造成新的污染 D.《易经》记载 “ 泽中有火……上火下泽 ”,其描述的是CO在湖泊池沼水面上起火的现象 8.化合物丙属于桥环化合物,是一种医药中间体,可以通过以下反应制得: 下列有关说法正确的是( ) A.甲分子中所有原子可能处于同一平面上 B.乙可与H2按物质的量之比1∶2发生加成反应 C.丙能使酸性高锰酸钾溶液、溴的CCl4溶液褪色,且反应原理相同 D.等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12 9.设NA为阿伏加德罗常数的值。下列说法错误的是( ) A.10g 46%甲酸(HCOOH)水溶液所含的氧原子数为0.5NA B.2.0 g D216O和H218O混合物中含有的中子数目为0.9NA C.25 ℃时,1.0 L pH=12的NaClO溶液中由水电离出的OH-的数目为0.01NA D.用惰性电极电解CuSO4溶液一段时间后,若加入29.4 g Cu(OH)2 能使溶液复原,则电解过程中转移电子的数目为1.2NA 10.钼(Mo)的主要用途是制造特种钢,某小组以下图所示装置模拟工业用MoO3(白色粉末,加热时变黄)制备单质Mo,下列说法正确的是(残留有毒气体处理装置未显示)( ) A.装置①中反应的离子方程式为CO32-+2H+= H2O+CO2↑ B.装置②中盛有浓硫酸,装置③中盛有饱和碳酸氢钠溶液,起到净化CO2的作用 C.为保证实验顺利进行,装置④、⑤两处应该同时加热,同时停止加热 D.装置⑥不能达到检验MoO3是否被CO还原的目的 11.短周期主族元素X、Y、Z、W的原子序数依次增大。各元素形成的单质依次为A、B、C、D,甲、乙、丙、丁是由这些元素组成常见的二元化合物,且丙为共价化合物,丁为离子化合物,其阴、阳离子之比为1:2,可以用作呼吸面具或潜水艇中的供氧剂。上述物质的转化关系如下图所示,下列说法正确的是( ) A.离子半径:r(W) > r(Y) > r(X ) > r(Z) B.甲、乙、丁均只含有离子键 C.X的简单氢化物的热稳定性比W的强 D.Y、Z、W的氧化物对应水化物两两皆能反应 12.某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( ) A.X电极质量减轻,Y电极质量增加 B.电解池阳极上被氧化的还原剂有Al和H2O C.电解池的总反应为2Al+6H2O 2Al(OH)3+3H2↑ D.每消耗103.5gPb,理论上电解池阴极上有1molH2生成 13.某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3 溶液。滴加过程中pM[-lgc(Cl- )或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法不正确的是( ) A.该温度下,Ksp(Ag2CrO4)=4×10-12 B.al、b、c三点所示溶液中c(Ag+):al>b>c C.若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点 D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂 二、非选择题。 26.(14分)连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题: (1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为 。 (2)锌粉法制备Na2S2O4的工艺流程如图所示: ①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。 ②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是 。步骤Ⅱ中发生反应的化学方程式为 。 ③在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是 。 (3) 目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学反应方程式是 。 (4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02mol•L-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______g•L-1。(以SO2计) 27.(14分)硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的流程如图: 已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。 ②Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成 [Ni(NH3)6]2+。请回答下列问题: (1)“酸溶”时为了提高浸取率,可采取的措施有 (任写出一条)。 (2)“滤渣I”的主要成分是 。(填化学式) (3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为 。 (4)“氨解”的目的为 ,“净化”时加入的H2S的目的是将镍元素转化为 沉淀。(填化学式) (5)“氧化”时发生反应的离子方程为 。 (6)“二次碱析”时,若使溶液中的Ni2+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于_____ 。(已知Ni(OH)2的Ksp=2×10-15,≈1.4) (7)以Fe、Ni为电极制取Na2FeO4的原理如右上图所示。通电后,在铁电极附近生成紫红色的FeO42-。电解时阳极的电极反应式为 ,离子交换膜(b)为________(填“阴”或“阳”)离子交换膜。 28. (15分)以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。 (1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应: 主反应:CH3OH(g) + H2O(g) CO2(g) + 3H2(g) △H = +49 kJ•mol-1 副反应:H2(g) + CO2(g) CO(g) + H2O(g) △H=+41 kJ•mol-1 ①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为 ,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是 。 ②分析适当增大水醇比 对甲醇水蒸气重整制氢的好处是 。 ③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为___________(忽略副反应)。 (2)工业上用CH4与水蒸气在一定条件下制取H2,原理为 CH4(g) + H2O(g)CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1 ①该反应逆反应速率表达式为:v逆= k•c(CO)•c3(H2),k 为速率常数,在某温度下测得实验数据如表: CO浓度(mol•L-1) H2浓度(mol•L-1) 逆反应速率(mol•L-1•min-1) 0.05 c1 4.8 c2 c1 19.2 c2 0.15 8.1 由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3•mol-3•min-1。 ②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应, 测得平衡时H2的体积分数与温度及压强的关系如图所示: 则压强Pl P2(填“大于”或“小于”);N点v正 M点v逆(填“大于”或“小于”); 求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。 选考题:请考生从2道化学题任选一题作答。如果多做,则每科按所做的第一题计分。 35.【选修3——物质结构与性质]】(15分) 磷化硼是一种典型的超硬无机材料,常以BCl3、PH3为原料制备。回答下列问题: (1)基态P原子与B原子中未成对电子数之比为 。 (2)与BC13分子互为等电子体的一种离子为 (填化学式)。 (3)PH3分子的立体结构为 ;PH3的沸点 (填“高于”或“低于”)NH3,理由是 。 (4)BCl3、PCl3和PF3三种分子中键角由大到小的顺序为 。 (5)BCl3可转化为硼酸,硼酸为一元强酸的原因是 (用离子方程式表示)。 (6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子,晶胞中P原子空间堆积方式为 。已知磷化硼晶体的密度为ρg·cm-3,设阿伏加德罗常数的值为NA,则晶胞中B原子与P原子间最短距离为 pm。若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实线圆圈画出B原子的投影位置 (注意原子体积的相对大小)。 36.【选修5——有机化学基础】(15分) 含氧有机物甲可用来制取多种有用的化工产品,合成路线如图: (1)甲的名称是 。检验该官能团常用的一种化学试剂 。 (2)写出己和丁的结构简式:己 ,丁 。 (3)乙有多种同分异构体,属于甲酸酯,含酚羟基,且酚羟基与酯的结构在苯环邻位的同分异构体共有 种。 (4)庚与M合成高分子树脂的化学方程式为 。 (5)参照以上路线,以甲为原料,合成。(无机试剂任选) 【参考答案】 7.A 。由于细菌、真菌和少数藻类等微生物使动植物遗体不断地腐烂、分解,转化成二氧化碳、水和无机盐,这些物质又是植物制造有机物的原料,“ 落红不是无情物,化作春泥更护花 ”蕴含了生态系统中的物质循环,A正确;分散质微粒直径在10— 9~10— 7m(1nm~100nm)的分散系才是胶体,PM2.5的颗粒物直径接近2.5×10-6 m大于10-7m,不能形成胶体,B错误;二甲醚在光照下分解产生甲醛等物质,会对环境造成新的污染,C错误; 湖泊池沼中腐烂的植物能产生CH4,则 “ 泽中有火……上火下泽 ”描述的是CH4在湖泊池沼水面上起火的现象,D错误。 8.D。甲分子中含有饱和碳原子,由于饱和碳原子构成的是正四面体结构,与该C原子连接的原子最多有2个在这一平面上,所以不可能所有原子都在同一平面上,A错误;乙分子中含有碳碳双键和酯基,只有碳碳双键可与H2发生加成反应,二者反应的物质的量之比为1∶1,B错误;丙物质含有碳碳双键,可以被酸性高锰酸钾溶液氧化而使溶液褪色,也可以与溴的CCl4溶液发生加成反应而使溶液褪色,两者反应原理不同,C错误;甲的分子式是C5H6,1 mol甲完全燃烧消耗O2的物质的量为6.5 mol,乙的分子式为C5H8O2,1 mol乙完全燃烧消耗O2的物质的量为6 mol,所以等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12,D正确。 9.B。10g46%甲酸(HCOOH)水溶液含有溶质的物质的n(HCOOH)= ,其中含有O原子的物质的量为n(O)=2n(HCOOH)=0.2mol,该溶液中含有溶剂水的物质的量为n(H2O)= ,掌握水中所含的氧原子数为0.3mol,故该溶液中含有氧原子的总物质的量为0.5mol,含有的O原子数目为0.5NA,A正确;D216O和H218O的摩尔质量都为20g/mol,2.0g该混合物的物质的量为0.1mol,1分子的含有的中子数都为10个,1mol该混合物的中子数为NA,B错误;NaClO溶液中由于ClO-+ H2O HClO+OH- ,使溶液显碱性,溶液中的OH-来自水电离产生,根据pH=12可知,由水电离出的c(OH-)=0.01 mol·L-1,1.0 L该溶液水电离出的OH-数目为0.01NA,故C正确;若加入29.4gCu(OH)2(即29.4g/98g·mol—1= 0.3mol),可以看成加入0.3mol CuO· H2O使溶液复原,原电解时在阴极上析出发生Cu2++2e—=Cu、2H2O+2e—=H2+2OH-,生成0.3mol铜转移电子个数=0.3mol×2×NA/mol=0.6NA ,根据原子守恒知,生成0.3mol水需要0.3mol氢气,生成0.3mol氢气转移电子的个数=0.3mol×2×NA/mol =0.6NA,所以电解过程中共转移电子数为1.2NA,D正确。 10.D。碳酸钙为难溶物,不能拆开,应该写成CaCO3+2H+=Ca2++ H2O+CO2↑,A错误;盐酸与碳酸钙反应制备的CO2中含HCl杂质,先通过饱和NaHCO3溶液,除去HCl杂质,再通过浓硫酸,干燥CO2,B错误;在加热条件下,装置④中CO2与炽热的C反应生成CO,装置⑤中CO与MoO3发生氧化还原反应,由于CO有毒,可能造成操作者中毒,且为了提高CO的利用率,应该先对装置⑤加热,后对装置④加热,完成实验应该先停止对装置⑤加热,后停止装置④加热,用生成CO作保护气,可以防止Mo被氧化,C错误;装置④中未反应的CO2也能使装置⑥中澄清石灰水变浑浊,D错误。 11.B。丁为二元离子化合物,其阴、阳离子之比为1:2,可以做潜水艇的供氧剂,确定为Na2O2;丁由单质A和单质B生成,构成A的元素X原子序数小于构成B的元素的原子序数Y,因此A为O2,B为Na;根据高中常涉及的电解反应,确定甲为氧化铝,乙为NaCl,因此C为Al、D为Cl2、丙为AlCl3;推导得出:X为O,Y为Na,Z为Al,W为Cl;甲为Al2O3,乙为NaCl,丙为AlCl3,丁为Na2O2。 由于电子层数越多半径越大,电子层数相同时,核电荷数越大吸电子能力越强,则半径越小,四种元素形成的离子分别为 ,因此离子半径:r(Cl-)>r(O2-)>r(Na+)>r(Al3+),即r(W)>r(X)>r(Y)>r(Z),A错误; 甲为Al2O3,乙为NaCl ,丁为Na2O2,其既含离子键也含共价键, ,B错误;非金属性O>Cl,气态氢化物越稳定,因此X(O)的简单氢化物的热稳定性比W(Cl)的强,即H2O>HCl,C正确;若是Y、Z、W的最高价氧化物对应水化物依次为NaOH、Al(OH)3、HClO4,由于Al(OH)3为两性氢氧化物,两两皆能反应,而题中只是Y、Z、W的氧化物对应水化物,氯可以对应弱酸HClO,其酸性太弱与Al(OH)3不反应,D错误。 12.B。据图可知电解池中,铝电极失电子作阳极,电极反应为:2Al-6e-=2Al3+,在铝表面有氧气产生,说明有部分氢氧根离子放电,铁电极上水得电子作阴极,电极反应为:6H2O+6e-=3H2↑+6OH-,铅蓄电池中X与阴极铁相连,作负极,负极上发生的反应是Pb+SO42--2e-=PbSO4,Y与阳极铝相连,作正极,电极反应为PbO2+4H++SO42-+2e-= PbSO4+2H2O,串联电路中各电极转移电子相等,据此分析解答。 蓄电池中两电极都生成硫酸铅,因此两个电极的质量都增加,A错误;铝电极失电子作阳极,电极反应为:2Al-6e-=2Al3+,在铝表面有氧气产生,说明有部分氢氧根离子放电,OH- 是水电离产生,说明电解池阳极上被氧化的还原剂有Al和H2O,B正确;阳极铝电极反应为:2Al-6e-=2Al3+,阴极铁电极电极反应为6H2O+6e-=3H2↑+6OH-,总反应为2Al+6H2O 2Al(OH)3(胶体)+3H2↑,在铝的表面有氧气产生,说明还存在电解水的过程:2H2O O2↑+2H2↑,C错误;n(Pb)==0.5mol,Pb是+2价的金属,反应的Pb的物质的量是0.5mol,则反应转移电子的物质的量是0.5mol×2=1mol,根据串联电路中电子转移守恒,则电解池的阴极上反应产生H2的物质的量是0.5mol,D错误; 13.B。由图知,加入10 mL0.1 mol·L-lAgNO3对应a1点的pM=4.9,该点对应离子浓度约等于1×10-4.9mol·L-l,近视完全反应,由Ag+(aq)+ Cl-(aq)AgCl(s),Ag+与 Cl-反应计量比为1:1,可以确定曲线Ⅰ对应AgCl,曲线Ⅱ上b点时,恰好反应生成Ag2CrO4,-lgc(CrO42-)=4.0,c(CrO42-)= 10-4mol·L-l,则c(Ag+)=2× 10-4mol·L-l,该温度下,Ksp(Ag2CrO4)=c(CrO42-)×c2(Ag+)=4×10-12,故A正确;al点恰好反应,-lgc(Cl-)=4.9,c(Cl-)=10-4.9mol·L-l,则c(Ag+)=10-4.9mol·L-l,b点c(Ag+)=2× 10-4mol·L-l,c点,K2CrO4过量,c(CrO42-)约为原来的1/4,则c(CrO42-)= 0.025mol·L-l,则c(Ag+)= =×10-5mol·L-l,al、b、c三点所示溶液中b点的c(Ag+)最大,故B错误;温度不变,氯化银的溶度积不变,若将上述NaCl溶液浓度改为0.2mol·L-1,平衡时,-lgc(Cl-)=4.9,但需要的硝酸银溶液的体积变成原来的2倍,因此a1点会平移至a2点,故C正确;根据上述分析,当溶液中同时存在Cl-和CrO42-时,加入硝酸银溶液,Cl-先沉淀,用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂,滴定至终点时,会生成Ag2CrO4为红棕色沉淀,故D正确。 26.(14分)【答案】(1)2Na2S2O4+O2=2Na2SO3+2SO2 (2分) (2)①ad(2分) ②增大锌粉的表面积,加快反应速率 (2分) ZnS2O4+Na2CO3=Na2S2O4+ZnCO3↓(2分) ③ 除去晶体表面的水分,并减少Na2S2O4的溶解损失(2分) (3)HCOONa+NaOH+2SO2=Na2S2O4+CO2+H2O(2分) (4)0.256(2分) 【解析】(1) Na2S2O4与O2生成Na2SO3和SO2,反应方程式为 2Na2S2O4 + O2 = 2Na2SO3 + 2SO2; (2)①浓硫酸与Na2SO3发生复分解反应产生Na2SO4、SO2、H2O,反应方程式为:H2SO4+Na2SO3=Na2SO4+SO2↑+H2O。反应不需要加热,Na2SO3 是细小晶体,通过控制分液漏斗的活塞控制反应速率,装置a合理;不能控制反应速率,且浓硫酸具有吸水性,长颈漏斗容易导致浓硫酸稀释,b不合理;浓硫酸与盐的反应放出大量的热,会导致集气瓶炸裂,c不合理;通过控制分液漏斗的活塞控制反应速率,上下联通的导气管会使浓硫酸上下气体压强一致,便于浓硫酸顺利滴下,装置d合理。②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是增大锌粉的表面积,加快反应速率。根据流程图可知步骤Ⅱ中发生复分解反应的化学方程式为ZnS2O4+Na2CO3=Na2S2O4+ZnCO3↓;③Na2S2O4易溶于水,难溶于乙醇,用乙醇洗涤,既能除去晶体表面的水分,并减少Na2S2O4的溶解损失;(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液液中,然后通入SO2发生反应,产生Na2S2O4,同时有CO2气体放出和水生成,总反应的化学方程式是HCOONa+NaOH+2SO2=Na2S2O4+CO2+H2O。(4)根据氧化还原反应中电子转移数目相等可知两种物质的反应关系为:2K3[Fe(CN)6] ~~Na2S2O4,n{K3[Fe(CN)6]}=0.02mol/L×0.01L=2×10-4mol,则n(Na2S2O4)=1×10-4mol,溶液的体积是50mL=0.05L,所以c(Na2S2O4)= 1×10-4mol÷0.05L=2×10-3mol/L,根据S元素守恒,该样品中Na2S2O4的含量以SO2计为:2×10-3mol/L ×2×64g/mol=0.256g•L-1。 27.(14分)【答案】(1)升高温度、将废镍催化剂粉碎、搅拌等(1分) (2)SiO2 (1分) (3)Cr3++4OH-=CrO2-+2H2O(2分) (4) 除去Fe3+ (2分) NiS(1分) (5)3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O(2分) (6) 1.4×10-5mol/L (2分) (7)Fe-6e-+8OH-=FeO42-+4H2O(2分) 阴 (1分) 【解析】废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍,加入20%的硫酸酸溶,NiCO3、Fe2O3、Cr2O3反应进入溶液中,SiO2不能反应,过滤,滤渣Ⅰ为SiO2,滤液加入NaOH溶液进行一次碱析,滤液Ⅰ含有CrO2-,沉淀加入氯化铵、氨水缓冲液,由信息②可知滤渣Ⅱ为Fe(OH)3,过滤得到的滤液含有[Ni(NH3)6]2+,“净化”时通入的H2S,可以将镍元素转化为NiS沉淀,加入硝酸氧化,可生成S和Ni2+,加入氢氧化钠生成Ni(OH)2,过滤后加入硫酸可得到硫酸镍,经蒸发浓缩、冷却结晶得到硫酸镍晶体。(1)“酸溶”时为了提高浸取率,可以先将废镍催化剂粉碎,以增大固体表面积,或进行搅拌,并在加热条件下使废镍催化剂与20%硫酸充分反应等;(2)“滤渣Ⅰ”主要成分为二氧化硅;(3)Cr(OH)3难溶于水,Cr(OH)3是两性氢氧化物,可以与过量的NaOH溶液发生反应产生CrO2-,则含铬微粒发生反应的离子方程式为Cr3++4OH-=CrO2-+2H2O;(4)加入氯化铵和氨水的缓冲液,可生成Fe(OH)3沉淀,同时生成[Ni(NH3)6]2+,达到除去Fe3+ 的目的;“净化”时通入的H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为[Ni[Ni(NH3)6]2++H2S= NiS↓+2NH4++4NH3↑;(5)“氧化”时HNO3将NiS氧化为S单质,HNO3被还原为NO,发生反应的离子方程式为3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O,从而可除去硫,生成镍离子;(6)离子浓度≤1×10-5mol/L时,离子沉淀完全,已知Ni(OH)2的Ksp=2×10-15,则c(OH-)= mol/L=1.4×10-5mol/L;(7)电解池中阳极发生氧化反应,依据题意可知铁在阳极失去电子,碱性环境下生成高铁酸根离子FeO42-,阳极的电极反应式为:Fe-6e-+8OH-= FeO42-+4H2O,离子交换膜(b)为阴离子交换膜,可使氢氧根离子进入阳极区。 28.(15分)【答案】 (1)① CH3OH(g)CO(g)+2H2(g) ΔH = +90 kJ/mol (2分) 升温(1分) ② 提高甲醇的利用率、有利于抑制CO的生成或抑制副反应发生(2分) ③ ×100% (2分) (2)①1.2×104 (2分) ②大于(1分) 小于 (1分) 48 (mol/L)2 (2分) 正反应方向 (2分) 【解析】(1)①根据盖斯定律计算所求反应的焓变,从压强和温度角度分析措施;②适当增大水醇比[n(H2O):n(CH3OH)],可视为增大H2O的量,能使CH3OH转化率增大,生成更多的H2,抑制转化为CO的反应的进行;③根据主反应方程式计算,平衡体系总压为各组分分压之和;(2)①根据v逆=k•c(CO)•c3(H2)计算k的值;②反应为气体分子数增多的反应,随着反应的进行,体系压强增大,增大压强不利于反应正向进行,反应为吸热反应,温度升高有利于反应正向进行,化学反应平衡时的正反应和逆反应速率相等;根据温度高、压强大使化学反应速率加快分析M、N点速率大小;利用三段式计算平衡时各种物质的物质的量,结合容器的容积得到相应物质的平衡浓度,根据平衡常数表达式可得其平衡常数的数值。然后将加入1 mol CH4和1 mol CO加入反应体系,计算此时的Qc并与K比较,判断平衡移动的方向。 (1)①已知:CH3OH(g)+H2O(g)CO2(g)+3H2(g) △H = +49 kJ/mol, ②H2(g)+CO2(g)CO(g)+H2O(g) △H=+41kJ/mol, 根据盖斯定律,反应可由①+②整理可得,CH3OH(g)CO(g)+2H2(g)△H=△H1+△H2=+90kJ/mol;该反应为吸热反应,升高温度既能加快化学反应速率同时可以促使反应正向进行,提高CH3 OH平衡转化率,而增大压强能加快化学反应速率,但对正反应不利,所以既能加快反应速率又能提高CH3OH平衡转化率的一种措施是升高温度;②适当增大水醇比[n(H2O):n(CH3OH)],可视为增大H2O的量,能使CH3OH转化率增大,生成更多的H2,抑制转化为CO的反应的进行,所以适当增大水醇比[n(H2O):n(CH3OH)]对甲醇水蒸气重整制氢的好处为:提高甲醇的利用率,有利于抑制CO的生成;③主反应为:CH3OH(g)+H2O(g)CO2(g)+3H2(g),n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,根据同温同体积条件下的体系中,各组分的压强之比等于其物质的量之比,可知: CH3OH(g)+H2O(g)CO2(g)+3H2(g) 初始压强 0.5p1 0.5p1 转化压强 p p p 3p 平衡压强 0.5p1-p 0.5p1-p p 3p 所以可得p2=(0.5p1-p)+(0.5p1-p)+ p+3p=p1+2p,故p=,则平衡时甲醇的转化率为α=×100% (2)①根据v逆=k•c(CO)•c3(H2),由表中数据,c13=mol3/L3,则c2==0.2mol/L,所以k= L3•mol−3•min−1=1.2×104 L3•mol−3•min−1; ②反应为气体分子数增多的反应,随着反应的进行,体系压强增大,增大压强不利于反应正向进行,所以压强p1大于p2;M、N都处于平衡状态,该点的正反应速率等于逆反应速率。由于温度:M>N,压强:M>N,升高温度或增大压强都会使化学反应速率加快,因此N点v正查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档