- 2021-05-21 发布 |
- 37.5 KB |
- 20页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学高分必练
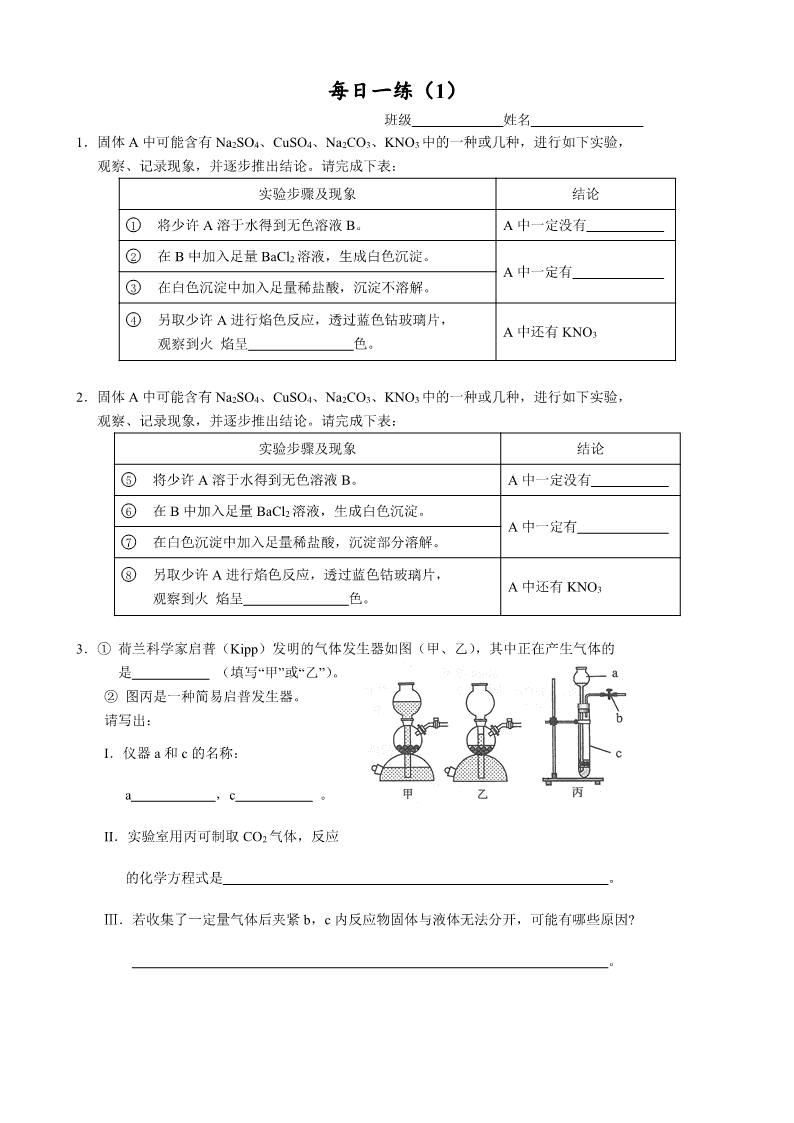
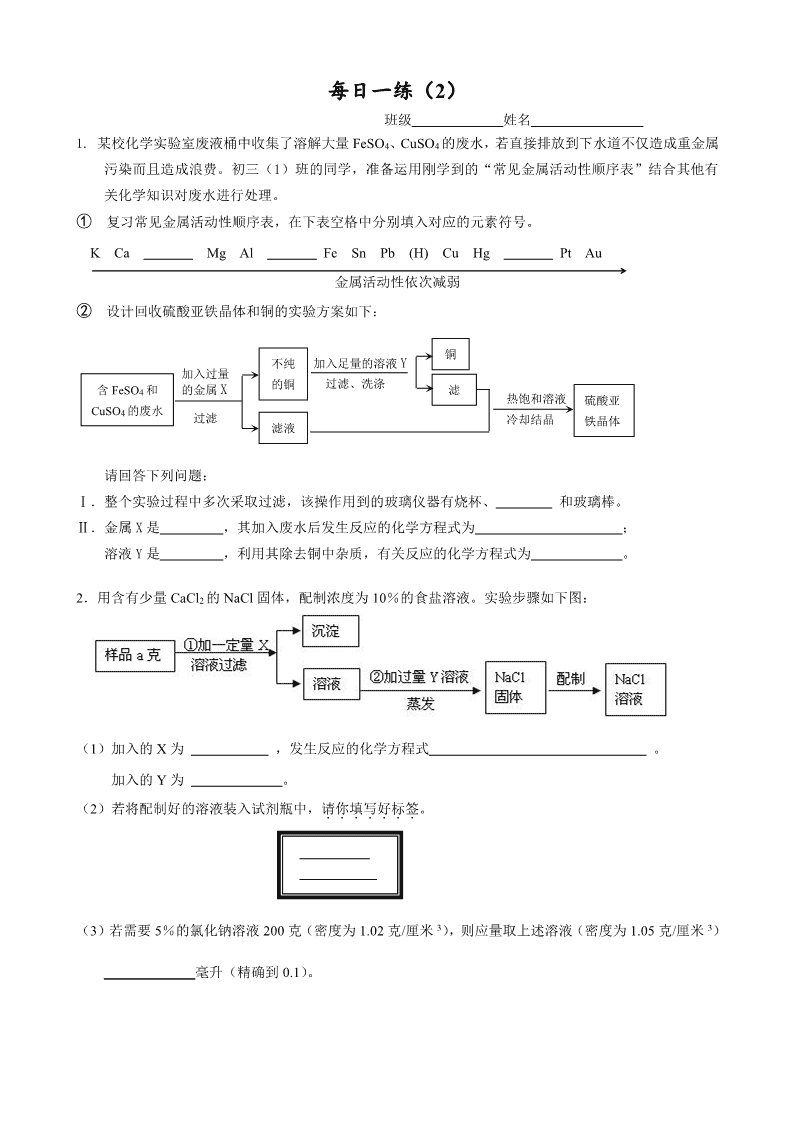
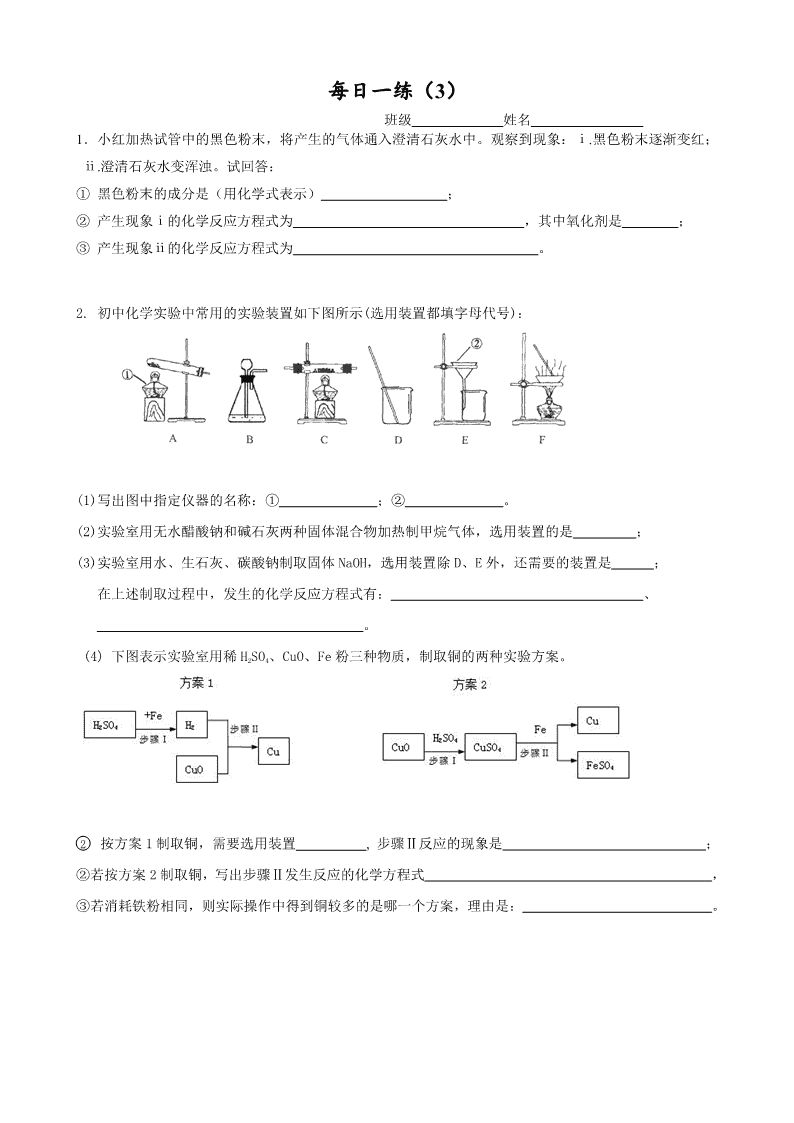
每日一练(1) 班级 姓名 1.固体A中可能含有Na2SO4、CuSO4、Na2CO3、KNO3中的一种或几种,进行如下实验, 观察、记录现象,并逐步推出结论。请完成下表: 实验步骤及现象 结论 ① 将少许A溶于水得到无色溶液B。 A中一定没有 ② 在B中加入足量BaCl2溶液,生成白色沉淀。 A中一定有 ③ 在白色沉淀中加入足量稀盐酸,沉淀不溶解。 ④ 另取少许A进行焰色反应,透过蓝色钴玻璃片, 观察到火 焰呈 色。 A中还有KNO3 2.固体A中可能含有Na2SO4、CuSO4、Na2CO3、KNO3中的一种或几种,进行如下实验, 观察、记录现象,并逐步推出结论。请完成下表: 实验步骤及现象 结论 ⑤ 将少许A溶于水得到无色溶液B。 A中一定没有 ⑥ 在B中加入足量BaCl2溶液,生成白色沉淀。 A中一定有 ⑦ 在白色沉淀中加入足量稀盐酸,沉淀部分溶解。 ⑧ 另取少许A进行焰色反应,透过蓝色钴玻璃片, 观察到火 焰呈 色。 A中还有KNO3 3.① 荷兰科学家启普(Kipp)发明的气体发生器如图(甲、乙),其中正在产生气体的 是 (填写“甲”或“乙”)。 ② 图丙是一种简易启普发生器。 请写出: I.仪器a和c的名称: a ,c 。 II.实验室用丙可制取CO2气体,反应 的化学方程式是 。 Ⅲ.若收集了一定量气体后夹紧b,c内反应物固体与液体无法分开,可能有哪些原因? 。 每日一练(2) 班级 姓名 1. 某校化学实验室废液桶中收集了溶解大量FeSO4、CuSO4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费。初三(1)班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理。 ① 复习常见金属活动性顺序表,在下表空格中分别填入对应的元素符号。 K Ca Mg Al Fe Sn Pb (H) Cu Hg Pt Au 金属活动性依次减弱 ② 设计回收硫酸亚铁晶体和铜的实验方案如下: 加入足量的溶液Y 过滤、洗涤 加入过量 的金属X 过滤 含FeSO4和 CuSO4的废水 滤液 铜 不纯 的铜 滤液 热饱和溶液 冷却结晶 硫酸亚 铁晶体 请回答下列问题: Ⅰ.整个实验过程中多次采取过滤,该操作用到的玻璃仪器有烧杯、 和玻璃棒。 Ⅱ.金属X是 ,其加入废水后发生反应的化学方程式为 ; 溶液Y是 ,利用其除去铜中杂质,有关反应的化学方程式为 。 2.用含有少量CaCl2的NaCl固体,配制浓度为10%的食盐溶液。实验步骤如下图: (1)加入的X为 ,发生反应的化学方程式 。 加入的Y为 。 (2)若将配制好的溶液装入试剂瓶中,请你填写好标签。 (3)若需要5%的氯化钠溶液200克(密度为1.02克/厘米3),则应量取上述溶液(密度为1.05克/厘米3) _____________毫升(精确到0.1)。 每日一练(3) 班级 姓名 1.小红加热试管中的黑色粉末,将产生的气体通入澄清石灰水中。观察到现象:ⅰ.黑色粉末逐渐变红;ⅱ.澄清石灰水变浑浊。试回答: ① 黑色粉末的成分是(用化学式表示) ; ② 产生现象ⅰ的化学反应方程式为 ,其中氧化剂是 ; ③ 产生现象ⅱ的化学反应方程式为 。 2. 初中化学实验中常用的实验装置如下图所示(选用装置都填字母代号): (1)写出图中指定仪器的名称:① ;② 。 (2)实验室用无水醋酸钠和碱石灰两种固体混合物加热制甲烷气体,选用装置的是 ; (3)实验室用水、生石灰、碳酸钠制取固体NaOH,选用装置除D、E外,还需要的装置是 ; 在上述制取过程中,发生的化学反应方程式有: 、 。 (4) 下图表示实验室用稀H2SO4、CuO、Fe粉三种物质,制取铜的两种实验方案。 ② 按方案1制取铜,需要选用装置 , 步骤Ⅱ反应的现象是 ; ②若按方案2制取铜,写出步骤Ⅱ发生反应的化学方程式 , ③若消耗铁粉相同,则实际操作中得到铜较多的是哪一个方案,理由是: 。 每日一练(4) 班级 姓名 1.下图是某研究性学习小组设计的几种装置,请你分析并回答下列问题: ①图中标号仪器为:a b ②装置A可用作实验室制取O2或CO2的发生装置,用此装置制取O2的化学方程式是: ,此反应的基本类型属于 。 ③小勤同学从装置A得到启发,在装置A的基础上增加了隔离铜网制成装置B来制取氢气,又用一支底部有一个小洞的试管和矿泉水瓶制成装置C。则B与A相比优点是 ,C与B相比优点是 ;而装置B显示的化学反应状态为 (填“进行中”或“已停止”)。 ④在实验室用装置C制取CO2化学反应方程式为 ,若隔离网改用铁丝做成,则产生的后果是 ,说明金属活动性Fe Cu(填“=”或“>”或“<”)。 相对原子质量:H---1 Cl---35.5 S---32 O---16 2.食盐不仅是人类生活必需的调味品,而且是一种重要的工业原料。在实验室里常用它制取氯化氢:2NaCl +H2SO4(浓)2HCl↑ +Na2SO4。 ① HCl的式量为_________,摩尔质量为_________。0.1 mol HCl的质量是 g。这些HCl溶于水,可得到7.3%的盐酸 g。 ②用上述方法制取7.3 g HCl时,消耗H2SO4 多少mol?(写出计算过程) 每日一练(5) 班级 姓名 1.某工厂排放的废液中含H2SO4和ZnSO4,处理废液回收ZnSO4晶体的流程如下: 废液 过量ZnO 操作Ⅰ 滤液 (ZnSO4) ZnO 操作Ⅱ 100℃ZnSO4 饱和溶液 冷却 20℃的滤液 ZnSO4晶体 过滤 可供选择的装置如下: a b A B C 请回答: ①写出仪器a、b的名称 、 。 ②加入过量ZnO后发生反应的化学方程式为 。 ③操作Ⅰ的装置为 (填装置编号);操作Ⅱ的名称是 ,需要的装置 为 (填装置编号)。 ④从环保和经济的角度分析,该流程中可重复利用的物质有 。 2.氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板。以下是印刷线路板的生产及废液的处理过程: 请回答下列问题: ① 步骤②中发生了两个反应:2FeCl3 + Fe→3FeCl2 和 , 涉及化学反应类型为置换和 。 ② 过滤是将混合物进行分离,被分离的物质需满足的条件是 。 ③ 滤渣的成份有 ,步骤③中发生反应的化学方程式是 。 ④ 该流程中可以循环、回收利用的物质是: 。 每日一练(6) 班级 姓名 1.右图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和部分生成物省略)。 请按下列要求填空: (1)物质a主要成分的化学式是 ; 发生燃烧的化学方程式 (2)物质b主要成分中原子团符号是 ; (3)物质c(C6H12O6)所属类别是 ,(有机物,无机物); 该物质 中C、H、O三种元素的物质的量比是 ; 1mol(C6H12O6)中有 个氢原子;一个(C6H12O6)分子中有 个氢原子; (4)标出物质e化学式中带点元素的化合价 。写出氢氧化钠溶液吸收二氧化碳的化学方程式 。有学生认为氢氧化钠溶液吸收二氧化碳后,滴入酚酞显无色,你认为对吗?请说出理由 。 (5)写出由CO2生成物质d的化学反应方程式 。 2. 请从下图中选择适当的实验装置序号填空,并回答有关问题。 (1) A,B装置都可以制取氧气,请写出使用A,B装置制取氧气对应的化学方程式 , ; 对应的基本反应类型为 。如果用B装置制氧气,为便于控制反应速率,装置中的仪器需稍作调整,其方法是 ; (2)实验室制取CO2选用的发生装置是____________,收集CO2若用D装置,则气体从 (a ,b)进。若用D装置收集氢气,则氢气从 (a ,b)进。 (3)若要除去CO2中混有的HCl气体,得到纯净、干燥的CO2,应在收集装置前连接两个相同的________装置,第一个装置中放入足量的_________ (NaHCO3溶液、NaOH溶液、石灰水)除去HCl;第二个装置中放入足量的____________ 除去水蒸气。 (4 实验室用CO和H2的混合气体还原Fe2O3,若要设计一套连续装置,检验并吸收反应后的气态产物(100℃以上),合理的操作顺序是: ,E中药品为 ,写出有关反应方程式 , , , ; 剩余气体不能直接排放到空气中,应采取的措施是___________________ 。 每日一练(7) 班级 姓名 1.氧化剂定义: ;发生 反应 还原剂定义: ;发生 反应 2.Mg+2H2O→Mg(OH)2+H2↑。该反应中氧化剂是……………………………………( ) A.Mg B.H2O C.Mg(OH)2 D.H2 3. 下列物质是我们常见的物质,请按有机物与无机物分类(无机物写化学式) 蔗糖,碳酸钙,酒精,碳酸钾,甲烷,纯碱,碳酸氢钙,碳酸,一氧化碳,干冰,硫酸钠 4.家庭常用物质中属于无机物的是……………………………………………( ) A.葡萄糖 B.淀粉 C.食盐 D.蔗糖 5.中国2010上海世博会的主题是“城市,让生活更美好”。 ①在世博会开幕式上举行了上海有史以来最为盛大的一次焰火表演,光彩夺目的焰火离不开多种元素的焰色反应,其中钠元素的焰色呈______________色。 ②世博园区内使用电动车,有效减少了CO2、SO2、CO的排放,这些物质中会引起温室效应的是_________;会造成酸雨的是________;用烧碱溶液可吸收CO2、SO2气体,写出化学方程式: , ; 能与血液里的血红蛋白结合,造成人体中毒的是_______。煤气的主要成分是 ,它燃烧时产生 , 燃烧的化学方程式 。 ③世博园区内用“活性炭+超滤膜+紫外线”组合工艺获得直饮水。其中活性炭起________作用;用紫外线代替氯气对水进行处理,其作用是_________ 。 6.每年的6月5日是世界环境日,环境保护是我国的一项基本国策,空气的质量越来越受到人们的关注,下列各组气体中都属于空气污染物的是……………………………( )A、CO2、N2 B、NO2、O2 C、SO2、NO2 D、N2、NO2 7.传统的化学燃料是 , , 。 8.化石燃料是不可再生能源。开发和利用新能源迫在眉睫,下列不属于新能源的是 A、太阳能 B、煤气 C、地热能 D、潮汐能 9.同素异形体:由 。 10.下列不属于同素异形体的是………………………………………………………( ) A、O2和O3 B、水和双氧水 C、N2 和 N4 D、金刚石和石墨 每日一练(8) 班级 姓名 1.水对于人类生活、工农业生产都具有重要意义。某自来水厂生产的主要步骤为:试回答: (1) 以上步骤中,加入 可以除去河水中较大颗粒悬浮物杂质,加入 能够消毒杀菌。 (2) 生产得到的自来水与蒸馏水的主要区别是 ;能保持水化学性质的微粒是水分子,电解水的化学方程式是 ;这一实验可以说明水是由 元素和 元素组成的。 7.大多数固体随温度升高而 ,少数物质如食盐随 ,极少数物质如 随温度 。 练习:运用溶解度表与溶解度曲线回答下列问题: (1)B是 的溶解度曲线; (2)P点的含义是 ; (3)满足A的溶解度<B的溶解度的温度范围是 ; (4) 60℃时,50g水中加入55g硝酸钾,所得溶液是 (填“饱和”或“不饱和”)溶液,溶液质量是 g (5)若要从A的溶液中提取A最简单的方法是 。 8.温度升高气体的溶解度 ,压强增大气体的溶解度 。 (1) 常压下,CO2在水中的溶解度随温度的变化应类似于_______ 物质;(填甲或乙) (2)为了减缓二氧化碳使全球变暖的趋势,有科学家设想:将排放到空气中的二氧化碳压缩使其液化,然后将其压入到冰冷的深海中。但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,从而造成灾难性的后果。 Ⅰ.二氧化碳气体转变为液体时发生了 变化; Ⅱ.二氧化碳使海水酸度增加的原理用化学方程式表示为: ; Ⅲ.二氧化碳在深海中的溶解度比在通常状况下的水中的溶解度 , 理由是 。 每日一练(9) 班级 姓名 9.实验室制二氧化碳的发生装置采用启普发生器的优点是:________________________ ;启普发生器适用范围:(a)反应物状态:_____________;(b)反应条件:___________。 ①二氧化碳的收集:一般用___________法收集,原因:_________________________。 ②验满:检验一瓶二氧化碳是否集满的方法:____________ 。 ③检验:检验一瓶无色气体是二氧化碳的方法:__________________________________。 ④用途、俗称:固体二氧化碳俗称 ,用途:用于灭火或 。 二氧化碳用于灭火的原因: , 。 ⑤实验室用__________溶液来检验CO2。化学方程式为:__________________________, 反应的实验现象为:____________________。用__________溶液来吸收CO2。化学方程式为:_________________________________。 练习:通过一年的化学学习,我们知道了常见气体的实验室制取方法和相关性质,我能根据所学知识回答下列问题: ⑴实验室用氯酸钾和二氧化锰混合物制取氧气的化学方程式是 ,所选用的发生装置是 (填序号),用C装置收集氧气后,验满的方法是 图24-2 。 ⑵小丽欲使用图24-2装置收集较纯净的氧气,则应先将装置中装满 水,再将气体从 (填“a”或“b”)端通入。 ⑶小丽用排新制的澄清石灰水的方法收集了半瓶氧气,然后将燃着的 木炭伸入该集气瓶中继续做气体性质实验,我能观察到的现象是 , 我能写出二氧化碳和澄清石灰水发生反应的化学方程式 。 10.久置在空气中的澄清石灰水瓶壁上会有一层白色物质,这是_______,要除去它用_______;写出有关上述现象的化学方程式:_____________________________________、_____________________________________。 11.烧碱暴露在空气中会变质,写出变质的化学方程式 练习1:下列气体能用固体氢氧化钠干燥的是…………………………………………( ) A.CO B.CO2 C. SO2 D.HCl 练习2:除去二氧化碳中的水蒸气,可选用的干燥剂是…………………………………( ) A.氢氧化钠固体 B.生石灰 C.浓硫酸 D.氧化铜 每日一练(10) 班级 姓名 12.金属活动性顺序在工农业生产和科学研究中有重要应用。请回答下列问题: (1)完成金属活动性顺序表: K Ca Na Mg ____ Zn Fe Sn Pb (H) Cu Hg ____ Pt Au 练习1:能与硝酸银溶液反应,但不能与稀盐酸反应的金属是…………………………( ) A.镁 B.银 C.铁 D.铜 练习2:下列不能用金属与盐酸直接反应制得的物质是…………………………………( ) A、MgCl2 B、FeCl2 C、ZnCl2 D、FeCl3 练习3:根据金属活动性顺序进行分析,下列描述或判断错误的是……………………( ) A.常温下,金属镁在空气中要比铁容易氧化 B.在氧气中灼烧时,铁丝要比铜丝反应剧烈 C.在同一盐酸中反应时,锌片比铁片反应剧烈 D.铜活动性不强,故铜不能与硝酸银溶液反应得到金属银 13.二氧化碳中混入一氧化碳,为除去一氧化碳,可将混合气体通过 。 反应方程式: 现象: 一氧化碳中混入二氧化碳,为除去二氧化碳,可将混合气体通过 。 反应方程式: 14.除去NaCl溶液中杂质Na2SO4 的试剂是 , 化学方程式 15.除去CaO固体中杂质CaCO3 的方法是 ,方程式 16.除去CuO固体中杂质 Cu的方法是 ,方程式 练习1:通过用水溶解、过滤、蒸发操作,可将下列各组混合物分离的方法是…………( ) A.硝酸钾,氯化钾 B.氧化铜 、二氧化锰 C.氯化钠、木炭 D.氧化铜,四氧化三铁 练习2:除去二氧化碳气体中混有的少量一氧化碳,正确的方法是……………………( ) A.点燃 B.通过灼热的氧化铜 C.通过澄清的石灰水 D.通过紫色的石蕊试液 练习3:除去下列物质中的少量杂质(括号内是杂:质),所用试剂及方法均正确的是…( ) A.铜粉(碳粉)——在空气中灼烧 B.氯化亚铁溶液(氯化铜)——加过量的铁粉、过滤 C.氢氧化钠(碳酸钠)——加适量的稀盐酸、蒸发 D.一氧化碳(二氧化碳)——通过灼热的氧化铜 练习4:除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是………( ) 项目 物质 杂质(少量) 试剂 操作方法 A KNO3 MnO2 足量的水 溶解、过滤、蒸发 B H2 水蒸气 适量的NaOH溶液 洗气 C 硝酸 盐酸 过量的硝酸银溶液 过滤 D CaO CaCO3 足量的水 溶解、过滤 每日一练(11) 班级 姓名 1.达菲(C16H31N2PO8) 是目前国际社会用来治疗甲型H1N1流感患者的重要药物,达菲由 种元素组成,1mol达菲中含_______mol磷元素,约为 个磷原子。 2.乙醇汽油的使用,可以缓解石油危机。所谓乙醇汽油是在汽油中加入适量乙醇混合而成的一种燃料。 (1)乙醇的化学式为__________。乙醇汽油属于______________(选填:“纯净物”或“混合物”)。 (2)从环境保护的角度看,下列燃料中最理想的是___________________(填写字母编号)。 A.氢气 B.煤 C.乙醇汽油 D.煤气(主要含CO) 3.右图是甲、乙两种固体物质的溶解度曲线,请你回答: (1)t1℃时,甲的溶解度 (填“>”、“<”或“=”)乙的溶解度; (2)甲、乙两种物质的溶解度受温度变化影响较大的是 ; (3)甲中含有少量乙,要提纯甲,可采用的方法是 ; 40 (4)t2℃时,分别取等质量的甲、乙两种物质,均刚好配制 成饱和溶液(甲、乙完全溶解),所需水的质量关系 20 是甲 (填“>”、“<”或“=”)乙。 (5)t1℃时,将15g乙物质溶解在50g水中,充分溶解后, 配成饱和溶液的质量为 g。 4.海洋是一个巨大的资源宝库,我们可以从海水中提取氯化钠,并以氯化钠和冰为原料制得氢氧化钠、氢气和氯气(Cl2)。其制取的主要工艺流程如下: (1)利用风吹日晒可以从海水中提取粗盐,该过程主要发生______________变化(选填:“物理”或“化学”)。 (2)要除去食盐水中混有少量的泥沙,你选择的操作方法是________________________________。 (3)请你写出氯化钠在生活中的一种用途__________________________________________________。 (4)氯化钠饱和溶液在通电条件下发生反应的化学方程式是:__________________________________。 每日一练(12) 班级 姓名 1. 在工农业生产和日常生活中,化学物质具有广泛的用途。请用下列物质的化学式选择填空:氦气、氮气、氧化钙、氢氧化钙、盐酸、硝酸、硫酸亚铁。 ⑴可用来替代氢气作为探空气球的稀有气体是 。 ⑵胃液中常含有的酸是 。 ⑶可用于治疗缺铁性贫血的药物是 。 ⑷为了防止某些食品受潮,在其包装袋中放入一小袋干燥剂。这种干燥剂是 。 2. 诺氟沙星胶囊主要成分是诺氟沙星(化学式为C16H18FN3O3,式量为319),适用于肠道感染、尿路感染及其它沙门菌感染。它由________种元素组成,其中1mol诺氟沙星中所含物质的量最多的原子是__________;31.9克诺氟沙星的物质的量是 mol,其中所含氮的原子个数为 。 3. 右图是甲、乙两物质的溶解度曲线: (1)甲、乙两物质溶解度相等时的温度为 ℃。 (2)60℃时,320g甲的饱和溶液中溶质的质量为______g。 (3)60℃时,将乙的饱和溶液降温至20℃时,以下描述 正确的是 (填字母)。 A.有乙物质的晶体析出 B.乙的溶解度不变 C.乙的溶质质量分数不变 D.乙溶液为不饱和溶液 4. 水是生命之源,也是常用于配制溶液的溶剂。 (1)写出“能证明水是由H、O两元素组成”的实验的化学方程式是: ; (2)供城市生活用水的自来水厂净水流程如图所示: 在净水流程中有一个活性炭池,它最主要的作用是 ,投的药一般是液氯其目的是 。[来源:Zxxk.Com] 每日一练(13) 班级 姓名 1. 使用电子天平的步骤是接通电源,先 ,(归零,去皮),然后放一张洁净的 ,潮湿或有腐蚀性的药品放在 中称量,再 ,(归零,去皮)。此时若在烧杯中放入药品大理石,待数据不再变化时记下的读数就是 的质量。 2. 下列实验操作,能达到预期目的是( ) A.用10mL水和10mL酒精配制成20mL酒精溶液 B.用NaOH溶液除去CO2中的HCl气体 C.用托盘天平称取3.27 gNaCl固体 D.用电子天平称取3.272 gNaCl固体 3. 现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取34 g该溶液于分液漏斗A中,锥形瓶B中加入一定量的二氧化锰。不同时间电子天平的读数如下表所示(不考虑H2O逸出): 反应时间/min 0 1 2 3 4 5 6 装置 + 过氧化氢溶液 + 二氧化锰/g 335.70 333.78 332.64 332.58 332.50 332.50 332.50 请根据要求回答下列问题: ① 发生反应的化学方程式为 ; ② 生成氧气的物质的量为 mol; ③ 根据上述氧气的量计算分解过氧化氢的物质的量 (根据化学方程式列式计算) ② 瓶内过氧化氢溶液中溶质的质量分数为 。 (写出计算过程) 4:“黄铜”是铜锌合金,具有较高机械性能,比纯铜耐腐蚀。现取20.0 g某种黄铜投入l00 g某浓度的稀硫酸中,完全反应后得到氢气0.1mol。请计算: ① 该黄铜含锌的物质的量是 mol(根据化学方程式列式计算)。 ② 剩余溶液的质量 g (写出计算过程)。 5:今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应): 烧杯① 烧杯② 烧杯③ 烧杯④ 烧杯⑤ 加入样品的质量/g 10 10 10 10 10 加入稀盐酸的质量/g 10 20 30 40 50 充分反应后生成气体的质量/g 0.88 1.76 X 3.52 3.52 (1)表中X的值为 ; (2)求样品中碳酸钙的质量分数;(3)烧杯④中物质充分反应后所得溶液的质量为 g。 每日一练(14) 班级 姓名 H-1 Cl-35.5 Na-23 O-16 1.木炭具有 和 的化学性质;用 溶液吸收二氧化碳气体;检验一瓶液体是氢氧化钙溶液可通入 ____________________气体。 2.利用下图装置可进行气体性质的探究实验。甲的玻璃管中盛放黑色粉末(CuO或C),乙的洗气瓶中盛放无色溶液(澄清石灰水或NaOH溶液)。 实验 甲 乙 实验一 探究CO与CuO的反应。 反应的化学方程式: _______________________________ 氧化剂:_______________________ 澄清石灰水的作用: _________________________ 实验二 探究CO2与C的反应。 (b换成酒精喷灯) 反应的化学方程式: _______________________________ 反应类型:_____________________ NaOH溶液的作用: _________________________ 上述两实验中,在导管c的尖嘴处都用火柴点燃,其目的是否完全相同?简述理由。 __________________________________________________________________________ 3.某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。 (1)配制200g质量分数为8%的氢氧化钠溶液。 ①计算:需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。 ②称量:电子天平接通电源,先 ,(归零,去皮),然后放一张洁净的 ,放上烧杯,再 ,(归零,去皮)。 将氢氧化钠固体加入烧杯中,待数据稳定时记下的读数就是 的质量。该步骤中用烧杯而不用称量纸的原因是 。 ③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。 ④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。请你填写好标签。 (2)右图表示用上述配制的氢氧化钠溶液与20 g某 稀盐酸发生反应后溶液温度的变化情况。 ①根据曲线判断,当加入氢氧化钠溶液的 质量为 时,反应恰好完全进行。 ②当加入15 g氢氧化钠溶液时,所得溶液中的溶质为 (写化学式)。 ③试计算该稀盐酸中溶质的质量分数(请写出计算过程) 每日一练(15) 班级 姓名 1.烟花爆竹的主要成分是黑火药,其化学组成为硝酸钾、硫磺和木炭等。 (1)黑火药中至少有_______ 种元素,欲分离出硝酸钾,可进行______、过滤、蒸发结晶等操作。 (2)黑火药的一般配方是:硫磺2 g、硝酸钾3 g、炭粉4. 5 g。已知黑火药在空气中燃爆时可 发生:S + 2KNO3 + 3C →K2S + 3CO2↑+ N2↑,则S、KNO3、C完全反应时的质量比为_______,该配方中C和_____ (填化学式)明显过量。燃放烟花爆竹产生SO2的反应方程式是_________ 。 (3)SO2气体在空气中经粉尘催化氧化为SO3 , SO3与水反应,形成硫酸型酸雨,写出有关 反应的化学方程式:___________ ___ ,____________ _______ 。 (4)很多城市出台“禁放”规定杜绝此类污染,以下解决“现代文明”与“传统文化”冲突的做法可行的是_______。(填字母) A.提倡电子鞭炮 B.开发绿色鞭炮 C.关停鞭炮企业 2.气体的实验室制取是初中非常重要的一组实验,结合下列实验装置图回答有关问题: (1)仪器a的名称是 。 (2)在初中可同时用来制取O2、CO2和H2的发生装置是 (填字母)。 (3)写出实验室用KClO3制氧气的化学方程式 。 (4)用KClO3制氧气需加MnO2作催化剂。若在KClO3中加少量的KMnO4,也能加快KClO3的分解。用文字说明其原因 。 (5)实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸反应来制取SO2。 已知:SO2是一种没有颜色而有刺激性气味的有毒气体,易溶于水,密度比空气大,常温下在空气中不反应。 ①制取SO2的化学方程式为 。 ②制取SO2的收集装置为 (填字母)。 ③在收集SO2,为了避免SO2对环境的污染,对SO2的收集装置作了改进(见下图),请你把集气瓶内的导管补充完整(图中“→”表示气体流向)。 3. 我爱化学,化学使我们的生活变得绚丽多彩!前几天家里的花叶子有些发黄,妈妈给花施加了一些碳酸氢铵(NH4HCO3),今天我惊喜地发现花叶子变得浓绿。我知道碳酸氢铵是一种_____(填“磷肥”、“氮肥”或“复合肥”)。 爸爸给家里换了一台节能天然气热水器,天然气的主要成分甲烷燃烧的化学方程式为___________________________________,该反应将化学能转化为______能。我在学习炒菜时,不小心油锅着火了,我迅速用锅盖盖灭,该灭火的原理是___________ 。 每日一练(16) 班级 姓名 1. 下图是一些常见物质的转化关系,其中C是无色无刺激性的气体,且能使澄清石灰水变浑浊; E是一种元污染的清洁能源,其燃烧产物是H。 (1) 红棕色粉末A和气体C、E的化学式 分别为:A 、C 、E: 。[来源:学.科.网] (2)G转化为H和A的反应类型是 反应; B转化成E和D的反应类型是 反应。 (3)①A与盐酸反应的化学方程式为: ; ②D和氯气化合生成F的化学方程式为: 。 (4)以上图中无色气体C为中心,延展如下图: 固体J CO 高温 化合 无色 气体 C 溶液K CaCO3 沉 淀 ①请写出实现这两个转化的另一反应物J、K的化学式:J 、K 。 ②请完善由CO和CaCO3分别转变成无色气体C的转化关系图,在箭号上注明必要的反应条件和其它反应物。 CO 无色 气体 C CaCO3 沉 淀 2.氯气(Cl2)是黄绿色气体,水溶液叫氯水。把品红试纸(染有品红的纸)伸入氯水中,品红褪色。 【发现问题】 氯水中的哪些成分能使品红褪色呢? 【查阅资料】 氯气溶于水,部分与水反应,方程式为Cl2 + H2O → HCl + HClO。 其中,HClO的名称叫次氯酸,是一种弱酸,具有强氧化性。 【猜 想】 猜想1:是氯水中的水使品红褪色的; 猜想2:是氯水中的 (填化学式)使品红褪色的; 猜想3:是氯水中的盐酸使品红褪色的; 猜想1:是氯水中的次氯酸使品红褪色的。 【实验探究】 实验操作 实验现象 过程分析 ①把品红试纸伸入水中 没有褪色 猜想1不成立 ②把品红试纸伸入干燥的氯气中 没有褪色 猜想2不成立 ③ 没有褪色 猜想3不成立 【结 论】 综合分析:氯水中的 (填化学式)使品红褪色,具有漂白作用(能使品红等有色物质褪色)。 【反 思】 (1)HClO中氯元素的化合价为 价。 (2)氯水中加入AgNO3溶液有白色沉淀生成,化学方程式为 。 (3)向氯水中滴加紫色石蕊试液,观察到的现象是 。 每日一练(17) 班级 姓名 1.20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四只各盛有50 g水的烧杯中,充分溶解后的情况如下表: 物质 甲 乙 丙 丁 未溶解固体的质量 /g 4.2 2[来源:Z_xx_k.Com] 0 9.2 下列说法正确的是 A.所得溶液一定都是饱和溶液 B.丁溶液中溶质质量分数一定最大 C.20 ℃时物质溶解度的关系为:丁>甲>乙>丙 D.所得溶液的质量关系为:丙>乙>甲>丁 2. 已知①中盛有一定量的碳酸钠溶液, 根据下图所示的实验过程,下列说法正确的是 A. ②中溶液为无色 B. ③中溶液的溶质组成有2种情况 C. 加入过量稀盐酸后,③中只观察到沉淀消失,产生大量气泡 D. ④中溶液的溶质除酚酞外,还有3种 5 g 42 mL 3.用下图操作可完成甲、乙两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为16%的氯化钠溶液。下列说法中,正确的是 ① ② ③ ④ ⑤ A.甲实验的步骤是①④⑤,其中去除杂质的关键一步是蒸发 B.甲实验各步操作中的玻璃棒都是用来搅拌的 C.乙实验按照②③①的步骤进行操作, 会导致配制的溶液浓度偏小 D.乙实验中,若①所用烧杯刚刚用清水洗过,会导致配制的溶液浓度偏大 4.向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。下列说法正确的是①②③④⑤ 资料:A的溶解度 温度/℃ 20 30 40 50 60 溶解度/g 37.2 41.4 45.8 50.4 55.2 A.②中A的质量分数最大 B.③⑤中A的质量分数相等 C.②④⑤的溶液为饱和溶液 D.①③④⑤中没有固体存在 每日一练(18) 班级 姓名 1.下列是分析放置在空气中的NaOH固体的相关实验,其中合理的是 序号 实验目的 实验方案 ① 证明变质 取少量固体,加水溶解,滴加足量稀盐酸,观察是否有气泡产生 ② 确定成分 取少量固体,加入石灰水,过滤,向滤液中滴加酚酞溶液 ③ 测定纯度 取少量固体,加入足量稀盐酸,用排水法收集VmL气体 ④ 除去杂质 取固体,加水溶解,滴加石灰水至恰好完全反应,过滤 A.②③ B.①③ C.②④ D.①④ 2.如右图所示,瓶中X为固体,把滴管内的液体Y滴入瓶中,插入水中的导管口一定没有气泡冒出的是 A B C D X Zn NaCl CaO NaOH Y H2SO4 H2O H2O H2O 3.同学在实验室发现了一瓶标签残缺的无色液体(右图),想通过探究确定其成分,以便重新利用。 【初步分析】操作不规范可能造成标签破损,能造成标签破损的不当操作有 (写一点)。 根据受损标签的情况判断,这瓶试剂不可能是 (填字母代号)。 A.酸 B.碱 C.盐 【查阅资料】初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。有关四种物质的信息如下: 物质 NaCl NaOH Na2CO3 NaHCO3 20oC溶解度g/100g水 36 109 21.5 9.6 水溶液的pH 7 14 11 9 【实验探究】为确定该溶液的成分,小芳设计了如图乙所示的实验过程: ② 稀盐酸 ① 石蕊试液 图乙 图丙 (1)实验①观察到紫色石蕊试液变蓝,由此得出结论是 。 (2)实验②观察到有气泡产生,还有可能观察到的现象是 。 【得出结论】通过以上活动,小刚认为不能确定瓶中试剂的成分,小芳认为可以,小芳的理由是 。 【拓展应用】通过以上探究活动,小组同学联想到二氧化碳与氢氧化钠的反应,设计了如图丙所示实验,观察到的现象是 。 每日一练(19) 班级 姓名 1. 向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量。 某同学依据实验事实绘制了如图所示的曲线。 下列说法正确的是 A.a至b段对应溶液的pH逐渐减小 B.b点对应溶液中的溶质为硫酸钠 C.c点对应溶液中的溶质种类最少 D.a至d段硫酸钠的质量逐渐增大 2.实验小组对久置生石灰的成分进行分析,实验操作及部分现象如下图所示。 (1)样品加水放热的原因是______________________________________________(用化学方程式表示)。 (2)②中反应的化学方程式是________________________________________________________________。 (3)③中的实验现象是______________________________________________________________________。 (4)将混合物B、C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣。向滤液E中滴加CaCl2溶液,有白色沉淀生成,则滤液E中的溶质可能是______。 依据实验现象及数据判断,原样品的成分是________________________________________________。 3、某兴趣小组用右图装置(碱石灰是氧化钙和固体氢氧化钠的混合物,极易吸收水蒸汽,经常用作干燥剂),测定过氧化氢溶液中溶质的质量分数。测得相关数据如下:整套装置16克。 (1)双氧水样品中加入二氧化锰,二氧化锰起 作用,反应生成氧气的物质的量为 。 (2)计算该过氧化氢溶液中溶质的质量分数。(写出计算过程) (3)实验装置中锥形瓶上加接盛有碱石灰的干燥管作用是_________________________。如果实验装置中不接盛有碱石灰的干燥管,测得的过氧化氢溶液溶质的质量分数会偏大,原因是 。 每日一练(20) 班级 姓名 1、一包黑色粉末可能由氧化铜、炭粉中的一种或两种组成为探究其组成,某化学兴趣小组的学生进行实验研究。学生掌握的知识: 碳粉具有可燃性:在氧气中能燃烧,该反应的化学方程式__________________________,能观察到的现象是__________________________________________。 碳粉具有还原性:能与氧化铜反应,该反应的化学方程式__________________________。 [提出假设] ①黑色粉末可能是氧化铜②黑色粉末可能是木炭粉 ③黑色粉末可能是______________。 [设计实验] 同学甲:将干燥的CO与A中的黑色粉末反应,并检验其产物。在给黑色固体加热前,应先通入CO,目的是 。装置中的气球起___________________作用。若黑色粉末变红色,同学甲推断黑色粉末一定含有氧化铜,可能含有碳粉。 同学乙:关闭弹簧夹X,给排尽空气后的盛有黑色粉末的硬质玻璃管加热。一段时间后,若黑色粉末不变色,澄清石灰水也不变浑浊,请你帮助同学乙推断黑色粉末_______________。 同学丙:取少量粉末于试管中,再加入过量盐酸试剂,发现固体全部溶解,溶液呈蓝色。同学丙推断黑色粉末一定只含有氧化铜。该实验的化学反应方程式是____________________________________________。 2、实验室用98%的浓硫酸配制成稀硫酸,并与锌粒反应制取氢气。 (1)查阅资料。20℃时不同质量分数硫酸的密度(g/mL) 质量分数 0% (纯水) 1% 4% 10% 16% 24% 32% 36% 44% 49% 60% 98% 密度 1.00 1.01 1.02 1.07 1.11 1.17 1.24 1.27 1.34 1.39 1.50 1.84 分析以上数据,可得出结论:(写2条) ① ; ② ; (2)计算。配制200g24.5%的稀硫酸需 g 98%的浓硫酸和 g水。 实际操作时,取98%的浓硫酸 mL(精确到1mL)。 (3)配制稀硫酸。 分别用量筒量取所需水和浓硫酸,先将 倒入烧杯中,然后 。查看更多