- 2021-05-21 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届浙江学考一轮复习考点精讲通用版考点47离子浓度大小的比较学案
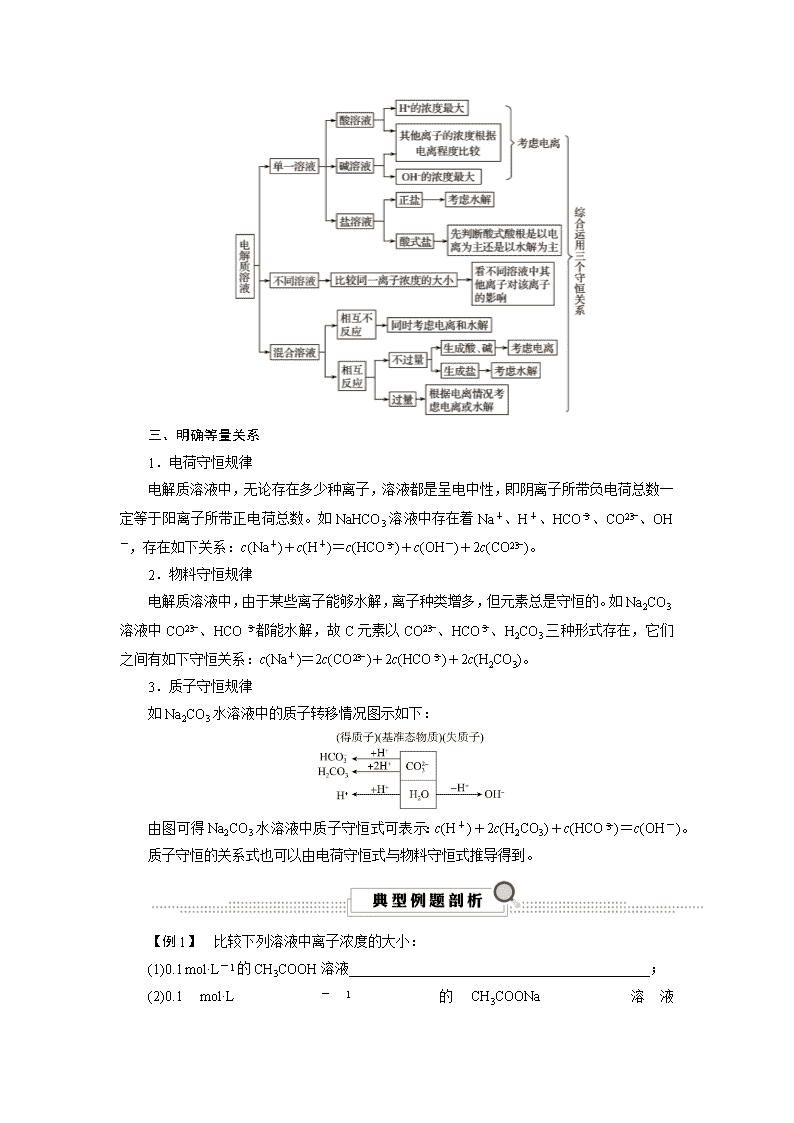
考点47 离子浓度大小的比较 知识条目 必考要求 加试要求 1.弱电解质水溶液中的电离平衡 a b b 2.多元弱酸的分步电离 a 3.盐类水解的简单应用 b b 4.多元弱酸盐的分步水解b b 一、理论基础 1.电离理论 (1)弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离,如氨水溶液中:NH3·H2O、NH、OH-浓度的大小关系是c(NH3·H2O)>c(OH-)>c(NH)。 (2)多元弱酸的电离是分步进行的,其主要是第一步电离(第一步电离程度远大于第二步电离)。如在H2CO3溶液中:H2CO3、HCO、CO、H+的浓度大小关系是c(H2CO3)>c(H+)>c(HCO)>c(CO)。 2.水解理论 (1)弱电解质离子的水解损失是微量的(双水解除外),但由于水的电离,故水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质的浓度。如NH4Cl溶液中:NH、Cl-、NH3·H2O、H+的浓度大小关系是c(Cl-)>c(NH)>c(H+)>c(NH3·H2O)。 (2)多元弱酸酸根离子的水解是分步进行的,其主要是第一步水解,如在Na2CO3溶液中:CO、HCO、H2CO3的浓度大小关系应是c(CO)>c(HCO)>c(H2CO3)。 二、分析方法 三、明确等量关系 1.电荷守恒规律 电解质溶液中,无论存在多少种离子,溶液都是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数。如NaHCO3溶液中存在着Na+、H+、HCO、CO、OH-,存在如下关系:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO)。 2.物料守恒规律 电解质溶液中,由于某些离子能够水解,离子种类增多,但元素总是守恒的。如Na2CO3溶液中CO、HCO都能水解,故C元素以CO、HCO、H2CO3三种形式存在,它们之间有如下守恒关系:c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3)。 3.质子守恒规律 如Na2CO3水溶液中的质子转移情况图示如下: 由图可得Na2CO3水溶液中质子守恒式可表示:c(H+)+2c(H2CO3)+c(HCO)=c(OH-)。 质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到。 【例1】 比较下列溶液中离子浓度的大小: (1)0.1 mol·L-1的CH3COOH溶液___________________________________________; (2)0.1 mol·L-1的CH3COONa溶液 ________________________________________________________________________; (3)0.1 mol·L-1的Na2CO3溶液________________________________________________________________________; (4)0.1 mol·L-1的NaHCO3溶液________________________________________________________________________。 【解析】 (1)CH3COOH属于弱电解质,应考虑电离平衡,CH3COOHCH3COO-+H+(主要),H2OH++OH-(极微弱),则c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)。弱电解质(弱酸、弱碱、水)的电离是微弱的。因此对于弱电解质而言,电离出的离子浓度远小于电解质分子的浓度。 (2)CH3COONa属于含有弱酸根的盐,应考虑水解平衡,CH3COONa===CH3COO-+Na+(完全电离),CH3COO-+H2OCH3COOH+OH-(主要),H2OH++OH-(极微弱),则c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。 (3)Na2CO3属于含有弱酸根的盐,应考虑水解平衡,Na2CO3===CO+2Na+(完全电离),CO+H2OHCO+OH-(主要),HCO+H2OH2CO3+OH-(次要),H2OH++OH-(极微弱),则c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)。 (4)NaHCO3属于酸式盐,溶液中即存在HCO的水解,也存在HCO的电离,已知NaHCO3呈碱性,则HCO水解程度大于HCO的电离程度,所以需先考虑HCO的水解。NaHCO3===HCO+Na+(完全电离),HCO+H2OH2CO3+OH-(主要),HCOCO+H+(次要),H2OH++OH-(极微弱),则c(Na+)>c(HCO)>c(OH-)>c(H+)>c(CO)。 【答案】 (1)c(H+)>c(CH3COO-)>c(OH-) (2)c(Na+)>c(CH3COO-)>c(OH-)>c(H+) (3)c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+) (4)c(Na+)>c(HCO)>c(OH-)>c(H+)>c(CO) 【提炼】 对于单一溶质的溶液,首先判断溶质种类,若为弱酸、弱碱则考虑电离平衡,若为含有弱酸根或弱碱根的盐则考虑水解平衡。对于酸式盐,则需根据溶液实际的酸碱性,判断电离和水解程度的大小,并按照程度由大到小,依次考虑。 【例2】 已知Va L 0.1 mol·L-1 CH3COOH与Vb L 0.1 mol·L-1 NaOH充分混合, (1)若恰好完全反应,则Va________(填“>”“<”或“=”)Vb,pH________(填“>”“<”或“=”)7,离子浓度大小关系为________________________________________________________________________; (2)若反应后溶液pH=7,则Va________(填“>”“<”或“=”)Vb,离子浓度大小关系为________________________________________________________________________; (3)若Va=2 L,Vb=1 L,pH________(填“>”“<”或“=”)7,离子浓度大小关系为________________________________________________________________________。 【解析】 (1)若要恰好反应,CH3COOH和NaOH物质的量相等,则Va=Vb,反应后溶质为CH3COONa单一溶质,则溶液中离子浓度大小关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。 (2)若反应后的pH=7,则CH3COOH需微量过量,来抵消CH3COONa的水解影响,再根据c(CH3COO-)=c(Na+),则溶液中离子浓度大小关系为c(Na+)=c(CH3COO-)>c(OH-)=c(H+)。 (3)当Va=2 L,Vb=1 L时,反应后溶液中存在CH3COONa和过量的CH3COOH,且两者的物质的量之比为1∶1,此时CH3COOH的电离程度大于CH3COONa的水解程度,则溶液呈酸性。在溶液中CH3COONa===CH3COO-+Na+(完全电离),CH3COOHCH3COO-+H+(主要),H2OH++OH-(极微弱),则溶液中离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。 【答案】 (1)= > c(Na+)>c(CH3COO-)>c(OH-)>c(H+) (2)c(Na+)=c(CH3COO-)>c(OH-)=c(H+) (3)< c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 【提炼】 对于酸碱中和的混合溶液,可根据下面的解题思路进行分析: 【例3】 将标准状况下2.24 L CO2缓慢通入1 L 0.15 mol·L-1的NaOH溶液中,气体被充分吸收。下列关系不正确的是( ) A.c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO) B.2c(Na+)=3[c(H2CO3)+c(HCO)+c(CO)] C.c(Na+)>c(CO)>c(HCO)>c(OH-)>c(H+) D.2c(OH-)+c(CO)=c(HCO)+3c(H2CO3)+2c(H+) 【解析】 根据数据计算可得CO2 + 2NaOH===Na2CO3 + H2O 0.075 0.15 0.075 CO2+H2O + Na2CO3===2NaHCO3 0.025 0.025 0.05 反应后溶液中存在0.05 mol Na2CO3和0.05 mol NaHCO3 A.符合电荷守恒①,正确;B.根据物料守恒,反应后溶液中,n(Na)=0.15 mol,n(C)=0.1 mol,则n(Na)/n(C)=3/2,所以2c(Na+)=3[c(H2CO3)+c(HCO)+c(CO)]②,正确; C.Na2CO3===CO+2Na+(完全电离),NaHCO3===HCO+Na+(完全电离),以CO+H2OHCO+OH-为主,所以c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+),错误;D.根据电荷守恒①和物料守恒②,②-①×2可推导得到。 【答案】 C 【提炼】 (1)书写电荷守恒时需注意不只是各离子浓度的简单相加,如K2S溶液中,电荷守恒式为c(K+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)①,2c(S2-)的系数2代表一个S2-带2个负电荷,不可漏掉。 (2)书写物料守恒时,需记住在电解质溶液中,由于某些离子能够水解,离子种类增多,但元素总是守恒的。如K2S溶液中,n(K)/n(S)=2/1,K元素只以K+形式存在,S元素以S2-、HS-、H2S三种形式存在,则c(K+)=2c(S2-)+2c(HS-)+2c(H2S)②。 (3)书写质子守恒可采取通过电荷守恒和物料守恒推导得到,约简原则为去除在溶液中没有得失质子的微粒,如K2S溶液中,需要约简掉K+,①-②可得c(H+)+c(HS-)+2c(H2S)=c(OH-)。 【例4】 常温下,用浓度为0.100 mol·L-1的NaOH溶液分别逐滴加入20.00 mL 0.100 0 mol·L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图。下列说法正确的是( ) A.V(NaOH)=10.00 mL时,两份溶液中c(X-)>c(Y-) B.V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) C.V(NaOH)=20.00 mL时,c(OH-)>c(H+)>c(Na+)>c(X-) D.pH=7时,两份溶液中c(X-)=c(Na+)=c(Y-) 【解析】 根据加入NaOH溶液体积和混合溶液pH变化曲线可知,HY为强酸,HX为弱酸。当V(NaOH)=10.00 mL时,反应后溶液溶质分别为HX和NaX,HY和NaY,且物质的量均相等。当V(NaOH)=20.00 mL时,都恰好反应,则反应后溶液溶质分别为NaX和NaY。A.由于HY为强酸,所以c(X-)<c(Y-),错误;B.V(NaOH)=10.00 mL时为HX和NaX混合溶液,且物质的量相等,根据图中pH,此时溶液呈酸性,说明HX的电离大于X-的水解,所以c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),正确;C.V(NaOH)=20.00 mL时恰好完全反应生成NaX,溶液呈碱性,所以c(Na+)>c(X-)>c(OH-)>c(H+),错误;D.当pH=7时,(HX和HY所需NaOH不同,HX所需NaOH少),c(Y-)>c(X-),错误。 【答案】 B 【提炼】 对于图像题,首先看清纵坐标、横坐标表示的意义,其次要注意关键的点表示的意义。对于酸碱中和反应,溶液显中性不一定是酸碱恰好完全反应。恰好完全反应,溶液pH不一定等于7。具体溶液中微粒浓度大小的判断,需要根据实际情况,判断电离和水解程度大小,并通过考虑程度大的那个过程来解题。 【例5】 改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/(c(H2A)+c(HA-)+c(A2-))]。下列叙述错误的是( ) A.pH=1.2时,c(H2A)=c(HA-) B.lg[K2(H2A)]=-4.2 C.pH=2.7时,c(HA-)>c(H2A)=c(A2-) D.pH=4.2时,c(HA-)=c(A2-)=c(H2A) 【解析】 A.由图像可知pH=1.2时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),故A正确;B.pH=4.2时,c(H+)=10-4.2 mol·L-1,c(HA-)=c(A2-),K2(H2A)==c(H+)=10-4.2,则lg[K2(H2A)]=-4.2,故B正确;C.由图像可知,pH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知c(HA-)>c(H2A)=c(A2-),故C正确;D.pH=4.2时,c(HA-)=c(A2-),但此时c(H2A)≈0,如体积不变,则c(HA-)=c(A2-)=0.05 mol·L-1,c(H+)=10-4.2 mol·L-1,如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,故D错误。 【答案】 D 【提炼】 溶液微粒平衡浓度与pH关系图 (1)横坐标为pH,纵坐标为溶液中各离子的平衡浓度或各离子的分布分数(即溶液中某酸碱组分的平衡浓度占其总浓度的分数)。 (2)关注曲线的交点,通常可以根据交点的数据计算出电离常数。 (3)比较离子浓度大小时,可以借助图像中信息进行比较。查看更多