- 2021-05-21 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版化学反应与能量变化学案
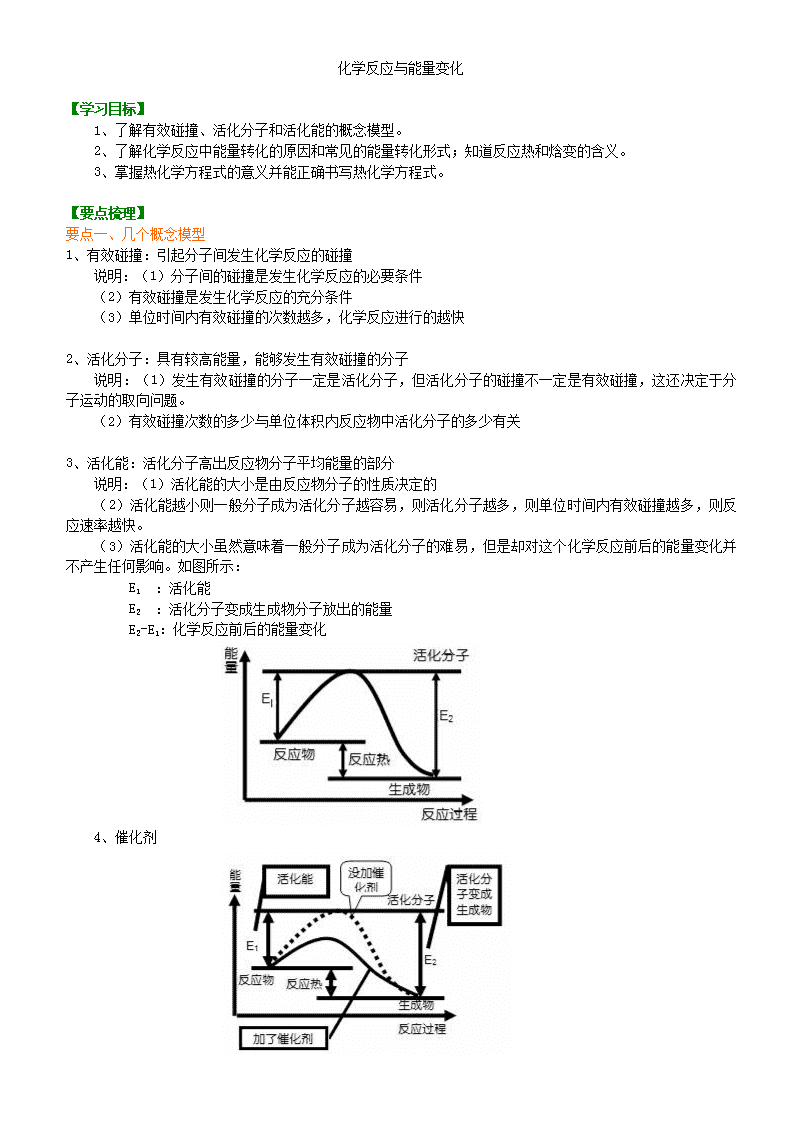
化学反应与能量变化 【学习目标】 1、了解有效碰撞、活化分子和活化能的概念模型。 2、了解化学反应中能量转化的原因和常见的能量转化形式;知道反应热和焓变的含义。 3、掌握热化学方程式的意义并能正确书写热化学方程式。 【要点梳理】 要点一、几个概念模型 1、有效碰撞:引起分子间发生化学反应的碰撞 说明:(1)分子间的碰撞是发生化学反应的必要条件 (2)有效碰撞是发生化学反应的充分条件 (3)单位时间内有效碰撞的次数越多,化学反应进行的越快 2、活化分子:具有较高能量,能够发生有效碰撞的分子 说明:(1)发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞,这还决定于分子运动的取向问题。 (2)有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关 3、活化能:活化分子高出反应物分子平均能量的部分 说明:(1)活化能的大小是由反应物分子的性质决定的 (2)活化能越小则一般分子成为活化分子越容易,则活化分子越多,则单位时间内有效碰撞越多,则反应速率越快。 (3)活化能的大小虽然意味着一般分子成为活化分子的难易,但是却对这个化学反应前后的能量变化并不产生任何影响。如图所示: E1 :活化能 E2 :活化分子变成生成物分子放出的能量 E2-E1:化学反应前后的能量变化 4、催化剂 说明:如图所示,催化剂改变了反应过程 要点二、反应热 焓变等相关概念 1、反应热 定义:在化学反应过程中放出或吸收的热量 符号:用Q表示 单位: kJ/mol 2、焓变 含义:焓是表述物质所具备的能量大小的物理量,符号为H。△H为生成物的总焓与反应物的总焓之差,称为化学反应的焓变。△H=H(生成物)-H(反应物) 说明: (1)反应热与焓变的关系 热化学研究表明,对于等压条件下进行的化学反应,如果反应中物质的能量变化只转化成热能,而没有转化为电能、光能等其他形式的能,则该反应的反应热就等于反应前后物质的焓的改变。数学表达式:QP=∆H,其中:Qp表示在压强不变的条件下化学反应的反应热。 (2)△H的正负与吸放热的关系 当△H为“-”或小于0,为放热反应;当△H为“+”或大于0,为吸热反应。 (3)吸放热与物质能量的关系 放热反应中:反应物总能量大于生成物总能量,反应后体系能量降低;即△H<0。 吸热反应中:反应物总能量小于生成物总能量,反应后体系能量升高;即△H>0。 (4)吸放热与化学键的关系 反应物分子断键时吸收的能量>生成物分子成键时释放的能量,则化学反应为吸热反应。 反应物分子断键时吸收的能量<生成物分子成键时释放的能量,则化学反应为放热反应。 要点三、热化学方程式 1、概念:能够表示反应热的化学方程式叫做热化学方程式。 例如: H2(g)+Cl2(g)=2HCl(g);△H= -184.6 kJ/mol 2、意义:既表明了化学反应中的物质变化,也表明了化学反应中的能量变化。 要点诠释: (1)热化学方程式必须标出能量变化。 (2)热化学方程式中必须标明反应物和生成物的聚集状态,因为反应热除跟物质的量有关外,还与反应物和生成物的聚集状态有关。 (3)热化学方程式中各物质的化学计量数只表示物质的量,因此可以用分数,但要注意反应热也发生相应变化。 【高清课堂:化学反应与能量变化】 要点四、正确理解和应用热化学方程式的注意事项 1、普通化学方程式只表明了化学反应中的物质变化;热化学方程式是表示反应所放出或吸收热量的化学方程式,它既表明了化学反应中的物质变化,又表明了化学反应中的能量变化。 2、△H只能写在标有反应物和生成物状态的化学方程式的右(后)边,即只有在热化学方程式中出现。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/mol。 3、反应热△H与测定条件(温度、压强等)有关。书写热化学方程式时,应注明△H的测定条件(温度、压强),未指明温度和压强的反应热△H,指25℃(298K)、101kPa时的反应热△H(绝大多数反应热△H是在25℃、101kPa时测定的)。 4、物质本身具有的能量与物质的聚集状态有关。反应物和生成物的聚集状态不同,反应热△H的数值以及符号都可能不同。因此,必须注明物质(反应物和生成物)的聚集状态(气体:g 液体:l 固体:s 稀溶液:aq),才能完整地体现出热化学方程式的意义。热化学方程式中,不用“↑”和“↓”。 5、普通化学方程式中,各物质化学式前的化学计量数可以表示物质的分子数、物质的量等含义;但是在热化学方程式中,只表示该物质的物质的量,所以可以是整数、分数、或小数。对相同化学反应,化学计量数不同,反应热△H也不同。如: 。 6、相同条件(温度、压强),相同物质的化学反应(互逆反应,不一定是可逆反应),正向进行的反应和逆向进行的反应,其反应热△H数值相等,符号相反。如: 7、反应热△H的单位kJ/mol中的“/mol”是指化学反应整个体系(即指“每摩化学反应”),而不是具体指该反应中的哪一种物质。如 指“每摩反应”,放出571.6kJ的能量,而不是指反应中各物质的物质的量。 8、不论化学反应是否可逆,热化学方程式中的反应热△H表示反应进行到底(完全转化)时的能量变化。 如:是指2mol SO2(g)和1mol O2(g)完全转化为2mol SO3(g)时放出的能量。若在相同的温度和压强时,向某容器中加入2mol SO2(g)和1mol O2(g)反应达到平衡时,放出的能量为Q,因反应不能完全转化生成2mol SO3(g),故Q<197kJ。 9、关于反应热的大小比较问题,注意理解:有两种情况,其一是比较Q(热量值),那么就只与反应热的数值有关,与“+”“-”符号无关,“+”“-”只表示吸热或放热;其二是比较△H,那么就与“+”“-”符号有关。 如 两反应的反应热的关系为aΔH4;发生同样的燃烧反应,物质的量越多,放出的热量越多,故ΔH5>ΔH6;碳酸钙分解吸收热量,ΔH7>0,CaO与H2O反应放出热量,ΔH8<0,显然ΔH7>ΔH8。 【总结升华】反应焓变大小比较的三种方法 1.同一反应,生成物状态不同时: A(g)+B(g)====C(g) ΔH1<0,A(g)+B(g)====C(l) ΔH2<0,因为C(g)====C(l) ΔH3<0,则ΔH3=ΔH2-ΔH1,所以ΔH2<ΔH1。 2.同一反应,反应物状态不同时:S(g)+O2(g)====SO2(g) ΔH1<0,S(s)+O2(g)====SO2(g) ΔH2<0,,ΔH2+ΔH3=ΔH1,则ΔH3=ΔH1-ΔH2,又ΔH3<0,所以ΔH1<ΔH2。 3.两个有联系的不同反应相比: C(s)+O2(g)====CO2(g) ΔH1<0,C(s)+ O2(g)====CO(g) ΔH2<0,根据常识可知CO(g)+ O2(g)====CO2(g) ΔH3<0,又因为ΔH2+ΔH3=ΔH1,所以ΔH2>ΔH1。 举一反三: 【变式1】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( ) A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1 B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1 C.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1 D.2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1 【答案】A 【变式2】如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题: (1)实验中观察到的现象是____________________。 (2)产生上述现象的原因是____________________。 (3)写出有关反应的离子方程式________________。 (4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。 【答案】 (1)①镁片上有大量气泡产生; ②镁片逐渐溶解; ③烧杯中析出晶体 (2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 (3)Mg+2H+=Mg2++H2↑ (4)小于查看更多